
Vol. 35, n.º 1, 2002
REVISTA
ESPAÑOLA DE Vol. 35, n.º 1, 2002 |
M. J. Palomo-González, J. Pérez-Requena, M. Rego-González1, M. López-Nieto1, C. Cañizares Benítez2
Servicio de Anatomía Patológica. Hospital Universitario Puerta del Mar. 1 TEAP. 2 Supervisor Anatomía Patológica.
RESUMEN
Introducción: Las Regiones Organizadoras Nucleolares (NOR) son segmentos de DNA que codifican el RNA ribosómico, el cual está directamente relacionado con la síntesis proteica y la proliferación celular. Mediante técnicas de impregnación argéntica se pueden detectar las proteinas asociadas a los NORs (AgNORs), siendo su cantidad proporcional a la actividad proliferativa. Esto parece tener importancia para distinguir entre tumores benignos y malignos.El objetivo de este trabajo es determinar la utilidad de la expresión de AgNORs en el diagnóstico diferencial de neoplasias foliculares tiroideas.
Material y métodos: La técnica se realizó sobre piezas quirúrgicas correspondientes a 10 adenomas y 7 carcinomas foliculares tiroideos. La técnica de plata fue la original de Ploton (1986) con viraje con cloruro de oro, fijación con tiosulfato sódico y contraste con rojo nuclear extra. Se evaluaron mediante microscopía óptica en 100 células tumorales por caso: número de puntos AgNOR por núcleo, localización, distribución y número de núcleos con 5 o más puntos AgNOR.
Resultados: El número de puntos AgNOR por núcleo resultó significativamente mayor en los carcinomas que en los adenomas foliculares, así como el número de núcleos con 5 o más puntos AgNOR por cada 100 células. El número de núcleos con puntos AgNOR agrupados (versus dispersos) fue mayor en los carcinomas que en los adenomas, mostrando los carcinomas mayor cantidad de puntos localizados en el centro del núcleo y menor proporción de casos con un punto AgNOR único. La antigüedad de los casos de archivo no afectó negativamente los resultados de la técnica.
Conclusiones: En las neoplasias foliculares tiroideas el número medio de puntos AgNOR por núcleo, el número de núcleos con 5 o más puntos AgNOR y la disposición agrupada de los mismos pueden ser útiles en la distinción entre adenomas y carcinomas tiroideos.
Palabras clave: Regiones Organizadoras Nucleolares; AgNOR; Neoplasias foliculares tiroideas; Impregnación argéntica.
SUMMARY
Background: The Nucleolar Organizer Regions (NOR) are segments of DNA that encode ribosomal RNAwhich is directly related to protein synthesis and cellular proliferation. Silver-staining methods allow detection of AgNORproteins with the amount of silver-stained proteins proportional to cell proliferative activity. This seems to be important in distinguishing between benign and malignant tumors. The aim of this study is to determine the utility of the expresion of AgNORs in the differential diagnosis of follicular thyroid neoplasms.
Material and Methods: 17 surgical specimens of follicular thyroid neoplasms (10 adenomas and 7 carcinomas) were studied. Ploton’s original silver technique (1986) with gold toning, fixation with sodiumthiosulfate and counterstaining with nuclear red extra was carried out. One hundred cells per case were evaluated, taking into account the mean number of Agnor dots per nucleus, their location, distribution and the number of cells with five or more dots.
Results: The total mean number of AgNOR dots per nucleus was significantly higher in carcinomas than in adenomas as was the number of nuclei with 5 or more AgNOR dots. Carcinomas were frequently found to present AgNOR dots grouped in a central cluster. Adenomas showed small, dispersed and peripheral dots which were often unique. The technique applied did not appear to have been adversely affected by the time elapsed in the older cases.
Conclusions: The mean total number of AgNOR dots per nucleus, the number of nuclei with 5 or more AgNOR dots and the grouped distribution of them may be useful in the differential diagnosis of follicular adenoma and carcinoma of thyroid.
Key words: Nucleolar Organizer Regions; AgNOR; Follicular Thyroid Neoplasms; Silver Techniques.
INTRODUCCIÓN
Las Regiones Organizadoras Nucleolares (NOR) son segmentos de ADN que codifican el ARN ribosómico, y fueron descritas por primera vez por Heitz (1931) y Mc Clintock (1934) (1). Estas regiones se encuentran asociadas íntimamente a un conjunto de nucleoproteínas ácidas específicas que pueden ser detectadas mediante técnicas de impregnación argéntica, denominándose entonces Regiones Organizadoras Nucleolares Argirofílicas (AgNOR). Estas técnicas fueron llevadas a cabo inicialmente por Howel y Black (1980) y por Ploton y col. (1982). Posteriormente, con técnicas electroforéticas, estas proteínas han sido identificadas tanto en interfase (nucleolina y proteína B23), como en mitosis (subunidades de ARN polimerasa I y factor transcripcional UBF) (2). Los AgNOR se visualizan en forma de puntos localizados en el núcleo. Su número, localización, disposición, intensidad de tinción y morfología, han demostrado en numerosos estudios tener relación con la actividad transcripcional de la célula, y por tanto con la ploidía, así como con la actividad proliferativa tumoral (2).
Diferentes parámetros de cuantificación de AgNOR (número, tamaño, y distribución) han sido objeto de estudio con la finalidad de discriminar entre neoplasias benignas y malignas, tanto en muestras biópsicas como citológicas (3,5).
La técnica original de Ploton (1986) que consistía en impregnación argéntica en un tiempo (4), ha sufrido algunas modificaciones para incrementar la calidad de la tinción y disminuir a la vez los depósitos inespecíficos de plata metálica que dificultan la correcta evaluación de la técnica, destacando las siguientes: viraje con Cloruro de Oro (6), fijación de la coloración con Tiosulfato Sódico (7), pretratamiento con Autoclave (8), e incubación en Microondas (9).
Las neoplasias foliculares tiroideas son lesiones de diagnóstico difícil. Por este motivo han sido objeto de numerosos estudios en los que los AgNOR se han utilizado para discriminar entre tumores benignos y malignos, habiéndose encontrado diferencias significativas en el número de puntos y su disposición dentro del núcleo entre adenomas y carcinomas, tanto en biopsias (3,10) como en citologías (11,12,13); si bien es en las muestras citológicas donde algunos autores han encontrado mayor cantidad de resultados no concluyentes (14,15).
MATERIAL Y MÉTODOS
MUESTRAS
Se estudiaron 17 neoplasias foliculares tiroideas pertenecientes a biopsias de archivo del Hospital Puerta del Mar de Cádiz, entre los años 1984 y 2000. Se realizaron cortes de tres micras con un microtomo tipo Minot, y se montaron sobre portas pretratados (silanizados), que incluían cada uno de ellos tejido linfoide amigdalar como control de la técnica.
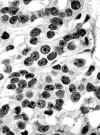
Fig. 1. Imagen correspondiente a
tinción de AgNOR en un adenoma folicular tiroideo. Los puntos AgNOR son escasos
y no se disponen agrupados (1.000 aumentos).
PROCEDIMIENTO TÉCNICO
Tras desparafinación en xilol, los portaobjetos se hidrataron a través de alcoholes en serie decreciente (Absoluto, 96% y 70%) y se dejaron en agua desionizada.
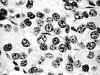
Fig. 2. Tinción de AgNOR en un
carcinoma folicular tiroideo. Se aprecian núcleos con múltiples puntos AgNOR.
Destaca la presencia de puntos agrupados constituyendo aglomerados irregulares
(1.000 aumentos).
Posteriormente se incubaron en una solución argéntica que consistía en una mezcla de dos partes de Nitrato de Plata al 50% más una parte de Gelatina al 2% en una solución de Ácido Fórmico al 1%. La solución de trabajo se elaboró en el momento de su uso, filtrándose a través de papel de filtro doble (el de uso normal del laboratorio). La incubación se llevó a cabo en jarras verticales de Coplin en oscuridad durante 45 minutos a temperatura ambiente. A continuación, los portas se lavaron varias veces en agua desionizada (aproximadamente 10 minutos) y se viraron en Cloruro de Oro al 0,05% durante 15 segundos. Después se lavó en agua desionizada (5 minutos), se fijó la coloración con Tiosulfato Sódico al 5% (4 minutos) y se lavó en agua corriente (5 minutos). La contratinción se realizó con Rojo Nuclear Extra durante 1 minuto, lavado con agua corriente, deshidratación, xilol y montaje con D.P.X.

Fig. 3. Microfotografía del tejido
linfoide amigdalar usado como control de la técnica. Los linfocitos presentan
un único punto AgNOR (muy ocasionalmente dos) nítidamente delimitado (1.000
aumentos).
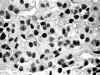
Fig. 4. El tejido que había
sufrido previamente congelación lenta en criostato no mostró tinción de
AgNOR. Este caso correspondía a un carcinoma de células de Hürtle (1.000
aumentos).
MÉTODO DE EVALUACIÓN
La cuantificación de los AgNOR se realizó me diante microscopía óptica con objetivo de inmersión de 1000 aumentos, sin conocimiento previo del diagnóstico histopatológico de cada caso. Se evaluaron los siguientes parámetros en 100 núcleos de células tumorales elegidas al azar:
1) Número de puntos AgNOR por núcleo (contabilizándose cada punto reconocible como individual).
2) Número de núcleos con 5 ó más puntos AgNOR.
3) Localización de los puntos AgNOR: Central, Periférica y Mixta; considerándose centrales los localizados aproximadamente en el centro del núcleo, periféricos aquellos que contactaban con la membrana nuclear, y mixtos en los casos en que coexistían puntos centrales y periféricos.
4) Distribución, estableciendo dos categorías: Agrupados y Dispersos. Los agrupados presentaban puntos AgNOR en contacto y los dispersos no.
RESULTADOS
Las lesiones foliculares benignas y malignas mostraron diferencias en el número de puntos AgNOR por núcleo, en su localización y en la distribución de los mismos. El número de puntos AgNOR por núcleo resultó significativamente mayor en los carcinomas (2,51±0,53) que en los adenomas foliculares (1,97±0,43) (análisis de la varianza, p<0,05).También existió diferencia significativa entre el número de núcleos con 5 ó más puntos AgNOR entre carcinomas (3,6±0,02) y adenomas foliculares (0,4±0,01), siendo marcadamente superior entre los carcinomas (test de Mann-Whitney, p<0,005). El número de núcleos en los que los puntos AgNOR se presentaban agrupados fue mayor en los carcinomas (7±0,05) que en los adenomas (2,9±0,03), si bien, este dato se hallaba en el límite de la significación estadística (análisis de la varianza, p=0,08).
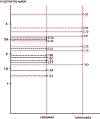
Gráfico 1. Comparación del número promedio de puntos AgNOR por núcleo
en adenomas y carcinomas foliculares tiroideos.
Los carcinomas presentaron un punto único de AgNOR en el 24,6% de los núcleos frente al 37,2% de los núcleos con punto único que mostraron los adenomas (análisis de la varianza, p>0,05). En el 52,9% de los núcleos de los carcinomas, los AgNOR contactaban con la membrana nuclear (localización periférica), mientras que en los adenomas presentaron este patrón el 62,2% de los núcleos. Los carcinomas mostraron, de manera inversa, un 38,3% de núcleos con AgNOR centrales y un 8,9% con patrón mixto frente a los 29,3% y 7,4% respectivos encontrados en los adenomas (análisis de la varianza, p>0,05).
No encontramos diferencias apreciables en la calidad de la técnica entre los casos recientes y los más antiguos. Asimismo, no observamos tinción de puntos AgNOR en tres casos (que fueron desechados) cuyo material había sido utilizado en su totalidad para estudio intraoperatorio mediante congelación lenta en criostato.
DISCUSIÓN
Nuestro trabajo aporta datos respecto al número y distribución de puntos AgNOR en los núcleos de las células tumorales, que pueden ayudar a discriminar entre adenomas y carcinomas foliculares tiroideos, a pesar de existir cierto solapamiento de valores, similar al detectado por distintos autores (13,14). Los resultados obtenidos en nuestro trabajo son superponibles a los descritos en numerosos estudios previos (3,10,11,12,13) sobre neoplasias foliculares tiroideas; si bien, éstos son más parecidos a los obtenidos cuando los AgNOR se estudiaron sobre material histológico que sobre citológico, siendo solamente en citologia (PAAF e improntas), donde existen trabajos que no encuentran relación significativa entre los AgNOR y malignidad (15,16). La significación estadística de los parámetros estudiados en nuestro trabajo resultó similar a la de otros autores, independientemente que éstos efectuaran la evaluación de los AgNOR por análisis microscópico ó con ayuda de técnicas de análisis de imagen (3,10,11,12,13).
En cuanto a las modificaciones que hemos introducido en la técnica original, cabe mencionar que el viraje con Cloruro de Oro al 0,05% contribuyó a resaltar la tinción de plata, delimitando las estructuras argirofílicas. El reemplazo de la plata metálica por oro en este paso consiste en una reacción de oxidación-reducción, en la cual el oro metálico sustituye a la plata metálica en los mismos sitios donde ésta se depositó (6). Con el viraje con Cloruro de Oro conseguimos una notable reducción de la tinción de fondo no específica de la cromatina nuclear, lo que hizo que los AgNOR fueran más claramente definidos.
El tratamiento de los cortes con Tiosulfato Sódico al 5% contribuye a conseguir una tinción permanente de la plata (fijación de la impregnación argéntica) (7). El paso por esta solución eliminó en gran parte la tinción no específica de fondo. También se observó que si el tiempo de permanencia en esta solución excedía de los 4 minutos, resultaba perjudicial para la técnica porque atenuaba e incluso eliminaba la tinción de AgNOR.
Si bien existen autores que propugnan el uso de material previamente congelado (de intraoperatoria), con el objeto de reducir al máximo el tiempo de fijación formólica (3), en nuestro trabajo, los casos que habían sufrido congelación previa no presentaron tinción de AgNOR y tuvieron que ser eliminados del estudio. Consideramos que este artefacto tan severo podría ser debido a su congelación lenta en el criostato.
A pesar de que otros trabajos afirman que las muestras de archivo muy antiguas y fijadas con formol dificultan la tinción y evaluación de AgNOR, debido a los precipitados de pigmento formólico (5), no hemos observado dicho pigmento granular en nuestros casos de archivo. Creemos que esto probablemente sea debido a que el formol utilizado en la fijación estaba tamponado al 10%.
En conclusión pensamos, a la luz de los resultados de nuestro trabajo, que el estudio de los AgNORs utilizando las modificaciones descritas para la técnica de impregnación argéntica, podrá ser de utilidad en el diagnóstico diferencial de neoplasias foliculares tiroideas, fundamentalmente en aquellos casos en los que no fuera posible llegar al diagnóstico mediante el estudio de los parámetros histopatológicos tradicionales.
BIBLIOGRAFÍA
Derenzini M. The AgNORs. Micron 2000; 31: 117-120.
Sirri V, Roussel P, Hernandez-Verdún D. The AgNOR proteins: qualitative and quantitative changes during the cycle cell. Micron 2000; 31: 121-126.
Rüschoff J, Prasser C, Cortez T, Höhne HM, Hohenberger W, Hofstädter F. Diagnostic value of AgNOR staining in follicular cell neoplasms of the thyroid: Am J Surg Pathol 17 (12): 1281-1288, 1993.
Öfner D, Schmid KW. Standarized AgNOR analysis: its usefullness in surgical oncology. Histochem Cell Biol 1996; 106: 193-196.
Pich A, Chiusa L, Margaria E. Role of the Argyrophilic Nucleolar Organizer Regions in tumor detection and prognosis. Cancer Detect and Prevent 1995; 19(3): 282-291.
Delahunt B, Avallone F, Ribas JL, Mostofi FK. Gold toning improves the visuilization of Nucleolar Organizer Regions in Paraffin Embedded Tissues. Biotechnic and Histochemistry 1991; 66(6): 316-320.
Linder LE. Improvements in the silver-staining technique for Nucleolar Organizer Regions (AgNOR). J Histochem Cytochem 1993; 41: 439-445.
Öfner D, Bankfalvi A, Riehemann K, Bier B, Böcker W, Schmid KW. Wet Autoclave pretreatment improves the visualization of silver-stained Nucleolar Organizer-Region-Associated Proteins in Routinely Formalin-Fixed and Paraffin-Embedded Tissues. Modern Pathol 1994; 7(9): 946-950.
Li Q, Hacker GW,Danscher G, Sonnleitner U, Grimelius L. Argyrophilic nucleolar organizer regions. Histochem Cell Biol 1995; 104: 145-150.
Kawasaki F, Onoda N, Ishikawa T, Ogawa Y, Ikelda K, Sugamo S, Kato Y, Chung KH. Evaluation of argyrophilic nucleolar organizer regions (AgNORs) in differentiated thyroid carcinoma as an indicator for disease recurrence. Oncol Rep 2000; 7(4): 853-857.
Shechtman L, Koren R, Horowitz A, Schechtman I, Halpern M, Gal R. Diagnostic value of AgNOR staining in thyroid cytology. Analyt Quant Cytol Histol 1998; 20: 187-191.
Solymosy T, Tóth V, Sápi Z, Bodó M, Gal I, Csanádi L. Diagnostic Value of AgNOR Method in thyroid cytopathology. Diagn Cytopathol 1996; 14: 140-144.
Karmakar T, Dey P. Role of AgNOR in diagnosis of thyroid follicular neoplasms on Fine-Needle Aspiration Smears. Diagn Cytophatol 1999; 12: 148-151.
Zaczek M, Szot W, Chlap Z. Argyrophilic Nucleolar Organizer Regions in proliferative lesions of the thyroid gland. Analyt Quant Cytol Histol 1996; 18: 1-8.
Khan EM, Pandey R. Differential diagnosis of Fine Needle Aspiration Smears of thyroid nodules.Cytologic Features and AgNORs. Acta Cytol 1996; 40: 959-962.
Nairn ER, Crocker J, MC Govern J. Limited value of AgNOR enumeration in assessment of thyroid neoplasms (letter). J Clin Pathol 1988; 41; 41: 1136.