
Vol. 35, n.º 2, 2002
REVISTA
ESPAÑOLA DE
Vol. 35, n.º 2, 2002 |
José Luis Gil-Salú, Inmaculada Domínguez-Pascual1, José Pérez-Requena2, Elena Maestro-Sarrión2, Juan Bosco López-Sáez3, Manuel López-Escobar
Servicio de Neurocirugía. Unidad de Investigación1. Servicio de Anatomía Patológica2. Servicio de Medicina Interna. Sección Oncológica3. Hospital Universitario Puerta del Mar. Cádiz. Hospital Clínico de Puerto Real. Cádiz3
RESUMEN
Objetivos: Establecer si los cultivos primarios de tumores cerebrales son válidos como método de estudio «in vitro» para la extrapolación y aplicación clínica futura de ensayos terapéuticos.
Material y método: Se obtuvieron 8 cultivos primarios a partir del material de biopsia de pacientes con tumores cerebrales (2 glioblastomas multiformes, 1 ependimoma, 1 oligodendroglioma anaplásico y 4 meningiomas). Se valoró la expresión inmunohistoquímica a la proteína ácida glial fibrilar, vimentina, antígeno epitelial de membrana, S-100 y CD57 en el material tumoral parafinado y en los cultivos primarios correspondientes.
Resultados: Se obtuvo una estrecha correlación en la expresión inmunohistoquímica, para cada tumor a los antígenos estudiados, entre el material parafinado y los cultivos primarios (23/24, 95.8%). Únicamente se apreció una disminución en la intensidad de dicha expresión, cuando esta era positiva en el material parafinado (7/18, 38.9%), en el cultivo primario correspondiente, pero en ningún caso con resultados negativos en parafina se evidenció positividad en el cultivo celular (0/6, 0%).
Conclusiones: Las técnicas inmunohistoquímicas son válidas para caracterizar a los elementos celulares de los cultivos primarios obtenidos de tumores cerebrales, permitiéndonos complementar a otros métodos como la citomorfología y validarlos como «banco de pruebas» para futuros estudios con aplicación clínica y terapéutica.
Palabras clave: tumores cerebrales, cultivos primarios, inmunohistoquímica.
SUMMARY
Aim: To evaluate the effectiveness of brain tumors primary cell cultures by «in vitro» studies for future clinical applications in therapeutic trials.
Material and methods: Eight primary cultures were established from biopsies from eight patients with brain tumors (2 glioblastomas multiforme, 1 ependymoma, 1 anaplastic oligodendroglioma and 4 meningiomas). Paraffin embedded tissues and primary cell cultures were evaluated for the expression of fibrillar glial acid protein, vimentin, epithelial membrane antigen, S-100 and CD57.
Results: A close correlation was observed between paraffin and primary cell cultures immunohistochemistry expression for antigens studied in each tumor (23/24, 95.8%). A low expression (33.3%, 6/18) was found in the primary cultures, when positive in paraffin tissue (6/18, 33.3%), but there were no positive results in cell cultures when the expression in paraffin was negative (0/6, 0%).
Conclusions: Immunohistochemical staining is a powerful and valid tool for characterizing primary cell cultures, and complements other methods, such as cytomorphology. Antigen markers available for immunological characterization by «in vitro» studies might serve for future clinical pathological and therapeutical trials.
Key-words: brain tumors, primary cultures, immunohistochemistry.
INTRODUCCIÓN
Los cultivos celulares obtenidos de tumores cerebrales son parte integral de la rutina diaria en la mayor parte de los laboratorios dedicados a la neuro-oncología con el propósito de estudiar su cariotipo, describir las características oncogénicas y la resistencia o sensibilidad a drogas o terapias complementarias. Proporcionan la oportunidad de investigar muchos de los parámetros celulares e interacciones que acontecen «in vitro» en unas condiciones experimentales que pueden ser controladas y repetidas (1).
Muchos de los progresos conseguidos hasta la fecha en la oncogénesis, desarrollo y respuesta a la terapia de los tumores cerebrales han resultado de los estudios practicados «in vitro», como las técnicas de cálculo de la cinética celular en gliomas, la comprensión de las interacciones entre células gliales, neuronas, células endoteliales y tumorales, o la identificación de los mecanismos celulares implicados en la resistencia a drogas (2).
Los cultivos primarios se emplean tanto como los cultivos de líneas celulares en estas investigaciones, aportando la ventaja de reflejar de forma más fidedigna las características y funciones del tumor del que proceden. Si bien las singularidades de una línea celular pueden ser mejor definidas, es cierto que pierden muchas de sus propiedades respecto a la muestra tumoral original, por lo que los resultados que obtengamos en ellos no pueden extrapolarse a los tumores cerebrales «in vivo», salvo que el estudio pormenorizado de estos mostrara características muy semejantes (3).
Un paso imprescindible en el estudio de los cultivos de tumores cerebrales es la caracterización de las células de los cultivos resultantes (4). Habitualmente las técnicas de citomorfología e inmunohistoquímica son las empleadas, aunque métodos tales como la hibridación «in situ» para transcriptores genéticos específicos, histoquímica enzimática y microscopía electrónica pueden complementarlas (2).
Como paso inicial en la Unidad de Investigación de nuestro centro de trabajo, al dedicarnos al estudio de los mecanismos de resistencia y sensibilidad a drogas, hemos querido comprobar si los cultivos primarios de los tumores cerebrales objeto de nuestras investigaciones cumplían las mismas características que las del tumor del que procedían, basándonos en técnicas de citomorfología e inmunohistoquímica.
MATERIAL Y MÉTODO
Un total de ocho muestras histopatológicas obtenidas de pacientes que fueron intervenidos de tumores cerebrales entre Septiembre de 2000 y Junio de 2001 fueron estudiadas. La recogida de muestras se realizaba en el propio quirófano de Neurocirugía en condiciones de asepsia, de una porción representativa del tumor, siendo introducidas inmediatamente en medio de cultivo mínimo esencial (Dulbecco’s minimum essential medium, DMEM) y conservadas a 4°C para iniciar su procesado en las primeras 24 horas.
En la Unidad de investigación y manipulando siempre las muestras en campanas de flujo laminar, se procedía a trocear la muestra, siempre mayor de 4 cc de volumen, sometiéndola a una digestión enzimática con colagenasa tipo I-a , a 37°C. durante 90 minutos, en un frasco de Roux con 50 cc de DMEM. Posteriormente recogíamos el sobrenadante que centrifugamos a 1600 rpm a 4°C durante 7 minutos. El «pellet» de células resultantes era recogido empleando 5 cc de medio de cultivo completo (MCC) (para 5 cc: 4,25 cc de DMEM; 50 microlitros de glutamina; 600 microlitros de suero de ternera fetal; 100 microlitros de una solución antibiótica: cloxaciclina, gentamicina y ampicilina) y depositado en un flask que se conservaba en posición horizontal a 37°C en un ambiente con 5% de CO2 durante los días siguientes.
En el microscopio de contraste de fases se vigilaba diariamente el crecimiento de las células en cultivo, renovándose cada 4 días el MCC hasta observar el tapizamiento de la superficie del flask por las células en cultivo en monocapa. En ese momento se procedía a «levantar» las células de la superficie del flask empleando tripsina, 5 minutos a 37°C en ambiente con 5% de CO2, y luego se neutraliza con suero de ternera fetal, en cantidades equivalentes, y se centrifuga a 1600 rpm a 4°C durante 7 minutos, hasta obtener un «pellet» de las células en suspensión.
Para el estudio citomorfológico e inmunohistoquímico hemos empleado una cámara de 24 pocillos en cuyo fondo colocamos un cristal cubreobjetos sobre el que añadimos 1 cc de la suspensión de células en MCC. Lo conservamos a 37°C en ambiente con 5% de CO2 y cuando las células tapizan la superficie del cubreobjetos procedemos al estudio citomorfológico de las células en monocapa con hematoxilina y al estudio inmunohistoquímico con soluciones de anticuerpos que se incuban 30 minutos a temperatura ambiente, revelándose con el sistema «Envision» de Dako, que utiliza peroxidasa y diaminobencidina. Las técnicas empleadas han sido:
a) Tinción con hematoxilina de las células en monocapa sobre cubreobjetos.
b) Empleo de soluciones de anticuerpos (Ac) mono- o policlonales para el estudio inmunohistoquímico con los siguientes Ac:
Para el glioblastoma multiforme: PGFA, vimentina y S-100.
Para el oligodendroglioma: vimentina, CD57 y S-100.
Para el ependimoma: PGFA, vimentina y S-100.
Para el meningioma: vimentina, E.M.A. y S-100.
(PGFA: Ac policlonal de conejo, Ventana; S-100: Ac policlonal de conejo, Ventana; Vimentina: Ac monoclonal de ratón, clona V-9, Dako; EMA: Ac monoclonal de ratón, clona Mc5, Ventana; CD57 (Leu7): Ac monoclonal de ratón, Concepta).
Las características citomorfológicas eran definidas bajo visión microscópica y las inmunohistoquímicas se realizaron estableciéndose «a priori» una puntuación según la intensidad de la tinción, tanto para el cultivo en monocapa como para el tumor del que procedían en parafina, en:
++: intensa y difusa
+: leve difusa o focal
–: negativa
RESULTADOS
El estudio citomorfológico de cada cultivo primario obtenido nos permite estudiar las características celulares en cada tipo de tumor. Así por ejemplo las células oligodendrogliales muestran una morfología redondeada, sin procesos o expansiones citoplasmáticas, a diferencia del glioblastoma multiforme, cuyas células presentan una apariencia pleomórfica, con tendencia a la fusión entre sus prolongaciones. El ependimoma evidencia en cultivo unas células de morfología regular, pero aisladas entre sí, sin establecer conexiones citoplasmáticas. En el caso de los meningiomas, la morfología fusiforme de sus células, con tendencia al crecimiento uniforme y cohesionado entre ellas, se mantiene en el cultivo en monocapa (fig. 1).
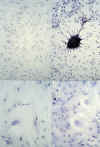
Fig. 1. Citomorfología en cultivos
primarios. Superior-izquierda: meningioma; superior-derecha: glioblastoma
multiforme; inferior-izquierda: glioblastoma; inferior-derecha: glioblastoma.
El estudio inmunohistoquímico comparativo para cada tumor entre el cultivo primario y la parafina queda reflejado en las tablas I y II. Cada tabla muestra de forma comparativa los resultados según la técnica inmunohistoquímica, en el primer caso para los tumores gliales y en el segundo para los meningiomas. Se presentan algunos de estos resultados para las células del cultivo primario en la figura 2.
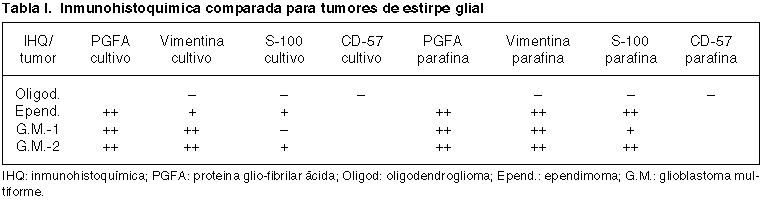
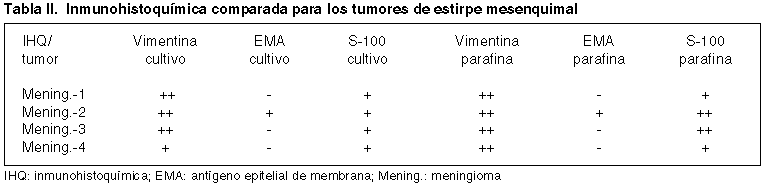

Fig. 2. Inmunohistoquímica en
cultivos primarios. Superior-izquierda: vimentina en meningioma (+);
superior-derecha: vimentina en meningioma (++); inferior-izquierda: PGFA en
glioblastoma (++); inferior-derecha: S-100 en ependimoma (+).
DISCUSIÓN
Los cultivos primarios de tumores cerebrales de estirpe neuroepitelial y mesenquimal son un magnífico «banco de pruebas» para el estudio de las características citocinéticas y oncogénicas, así como para comprobar «in vitro» la quimio- o radiosensibilidad de los mismos. Frente a ellos, los cultivos de líneas celulares tumorales muestran en el tiempo una adaptación al crecimiento «in vitro» que se acompaña frecuentemente de la pérdida de características propias del tumor original y cambios progresivos en el número de cromosomas. Son, no obstante, más sencillos de manejar que los cultivos primarios, crecen continuamente y se puede obtener un mayor número de células, además de disponer de una información más abundante de sus características (5). Sin embargo, las propiedades individuales de cada tumor y la heterogeneidad de hallazgos de la cinética celular tumoral, oncogénesis y respuesta clínica (6,7), hace que incluso «in vitro» diversas modalidades de tratamiento quimioterápico tengan resultados dispares según se empleen y se valoren los resultados en cultivos primarios o en líneas celulares establecidas (8).
Como muestra la figura 1 en los cultivos primarios sus características citomorfológicas son propias de cada tipo tumoral, pudiendo reconocerse por su morfología las células de un oligodendroglioma, meningioma o glioblastoma multiforme con relativa facilidad, a pesar de no disponer de tejido de sostén ni de las formaciones vasculares asociadas que en los estudios histopatológicos convencionales nos permiten su diagnóstico.
Las técnicas inmunohistoquímicas complementan a la anterior y como se refleja en las tablas I y II, en los cultivos primarios siguen un patrón muy semejante para cada tumor al de la parafina. Si bien otros autores han encontrado un 100% de positividad a la tinción con vimentina (9), en nuestro caso un 75% en los de estirpe glial y en 100% de los meningiomas mostraron ese resultado. En todos los casos, la expresión a vimentina en las células en cultivo se correspondía con la de la parafina. En el caso de la PGFA, Farr-Jones y colaboradores refieren un 62% de positividades de las células en cultivo (9), frente a un 100% de los cuatro tumores neuroepiteliales por nosotros testados, coincidiendo con los resultados de Lolait y cols. (10,11). En todos ellos también existe una concordancia completa con la inmunotinción en la parafina. En nuestros 8 casos estudiados el resto de los antígenos testados, S-100, EMA y CD57, muestran coincidencia entre la población celular del cultivo y la parafina, salvo en una glioblastoma que siendo positivo a S-100 para esta última, no lo era para las células en cultivo.
Respecto a la intensidad de la expresión para la tinción inmunohistoquímica se evidencia en 7/24 (29%) del total de los estudios realizados, o en un 7/18 (38,9%) si consideramos sólo los positivos en la parafina, una disminución en dicha intensidad, coincidiendo con los resultados que publican Lolait y cols.(10), haciendo referencia a la pérdida de inmunoreactividad que con los distintos pases de cultivo pueden acontecer en los cultivos primarios. Esta es una característica que ha sido reconocida también por otros autores (12) reflejando, no obstante, que las células que mantienen las características tumorales por más tiempo son las que expresan una mayor inmunoreactividad. De forma semejante ocurre con los marcadores de la cinética tumoral, como la bromodeoxiuridina, cuyo resultado decrece con el tiempo en las células en cultivo, indicando junto a lo anterior, algún mecanismo no identificado de diferenciación «in vitro», particularmente para los astrocitomas de alto grado de malignidad (12).
Estos hallazgos confirman los estudios de otros autores sobre la utilidad de los cultivos primarios de tumores cerebrales para poder testar en ellos diversas modalidades de tratamiento quimio- y radioterápico. Establecen que para que las células en cultivo no pierdan las características semejantes a las del tumor de la que proceden, los pases de cultivo deben ser los mínimos imprescindibles hasta tener completo el crecimiento en monocapa. Tras los estudios terapeúticos «in vitro» podremos investigar las características oncogénicas que definan cada tipo de respuesta y seleccionar de esta forma a los pacientes que se puedan beneficiar del tratamiento quimio- y/o radioterápico complementario a la cirugía.
BIBLIOGRAFÍA
Bigner D, Bigner SH, Ponten J. Heterogeneity of genotypic and phenotypic characteristics of fifteen permanent cell lines derived from human gliomas. J.Neuropathol Exp Neurol 1981; 40: 201-29.
Ali-Osman F, Schofield D. Cellular and molecular studies in brain and nervous system oncology. Cur Opin Oncol 1990; 2: 655-65.
Westphal M, Hänsel M, Hamel W, et al. Karyotype analysis of 20 human glioma cell lines. Acta Neurochir 1994; 126: 17-26.
Kimmel DW, Shapiro JR, Shapiro WR. In vitro drug sensitivity testing in human gliomas. J Neurosurgery 1987; 66: 161-71.
Murphy M, Chen JN, George DL. Establishment and characterization of a human leptomeningeal cell line. J Neurosci.Res 1991; 30: 475-83.
Gil-Salú JL, González-Darder JM. Consideraciones sobre la citogenética y los factores de proliferación celular en la oncogénesis de los astrocitomas anaplásicos y glioblastoma multiforme. Neurocirugía 1998; 9: 199-208.
Gil-Salú JL, González-Darder JM, Barcia-Albacar JA, et al. Significación pronóstica de los factores de proliferación celular y del gen p53 en gliomas malignos supratentoriales del adulto. Neurocirugía 2001; 12: 125-32.
Bouterfa H, Picht T, Keb D, et al. Retinoids inhibit human glioma cell proliferation and migration in primary cell cultures but not in established cell lines. Neurosurg 2000; 46: 419-30.
Farr-Jones MA, Parney IF, Petruck KC. Improved technique for establishing short term human brain tumor cultures. J Neurooncol 1999; 43: 1-10.
Lolait SJ, Harmer JH, Auteri G, et al. Expression of glial fibrillary acidic protein, actin, fibronectin, and factor VIII antigen in human astrocytomas. Pathology 1983; 15: 373-8.
Lolait SJ, Underwood JR, Mu FT, et al. Vimentin intermediate filaments in cultures of human meningiomas. Neuropathol Appl Neurobiol 1984; 10: 321-31.
Kharbanda K, Sarkar C, Dinda AK, et al. Morphological appearance, growth kinetics and glial fibrillary acidic protein (GFAP) expression in primary in vitro explant culture of astrocytic neoplasms. Acta Oncol 1993; 32: 301-6.
Agradecimientos: el presente trabajo ha sido realizado con la ayuda y colaboración de la Unidad de Investigación del Hospital Puerta del Mar, Cádiz y del grupo de investigación CTS445 de la Junta de Andalucía.