
Vol. 35, n.º 3, 2002
REVISTA
ESPAÑOLA DE
Vol. 35, n.º 3, 2002 |
Marta Carrera, Carlota González, Enric Condom, Roger Bernat
Servicio de Anatomía Patológica de la Ciudad Sanitaria y Hospitalaria de Bellvitge (CSUB). Barcelona.
Es recomendable el examen de la biopsia del riñón pre-trasplante o post-perfusión por varias razones:
Proporciona datos con los que deberán compararse las alteraciones observadas en futuras biopsias muestra alteraciones preexistentes como fibrosis intersticial, arteriosclerosis, glomeruloesclerosis y trombosis capilares que permiten valorar en biopsias posteriores la progresión de la nefropatía crónica o la toxicidad por tacrolimus/ciclosporina entre las causas a descartar en el deterioro de la función renal no debido a rechazo.
Es considerada obligatoria en donantes en las situaciones siguientes: edad avanzada, hipertensión, diabetes mellitus, necrosis tubular, coagulación intravascular diseminada o un aumento inexplicable de la creatinina sérica antes de la muerte.
Es imprescindible para el aprovechamiento de riñones subóptimos en los trasplantes dobles.
Es necesaria cuando se observan lesiones sospechosas de neoplasia o cuando macróscópicamente el riñón ofrece aspecto patológico (cicatrices, infarto).
El tamaño de la muestra es fundamental en la obtención de resultados, se recomienda una cuña de 10 mm en la superficie renal y 5 mm de profundidad. Se trata de evitar que la muestra se limite al área subcapsular que suele tener cicatrices y glomérulos esclerosados, no representativos del estado del resto del parénquima.
La urgencia del dictamen obliga al estudio histológico de alguna biopsia a cualquier hora del día y hasta la actualidad se ha venido haciendo mediante congelación. La congelación permite reconocer el número de glomérulos esclerosados, la fibrosis intersticial y la arteriosclerosis. La adaptación de técnicas como el tricrómico de Masson a cortes por congelación puede ayudar en esta tarea. Es obvio que los problemas de interpretación de las biopsias obtenidas por congelación son mayores que los de las biopsias procesadas en parafina.
El aumento de la edad de los donantes cuya causa principal de muerte son los accidentes vasculares cerebrales ha aumentado el número de estudios urgentes. La valoración de riñón adecuado para trasplante de donante añoso a dos receptores mediante biopsia por congelación obliga a ser muy cauteloso y a diferir el resultado a parafina si no se demuestran riñones normales o prácticamente normales. El índice de afectación crónica de Banff valorando semicuantitativamente intersticio, túbulos y vasos, más el porcentaje de glomérulos esclerosados es el que reúne todos los parámetros necesarios en éstos casos. Dando un valor entre 1 y 3 a cada parámetro un riñón adecuado para un trasplante standard no debe sobrepasar un valor global de 4. La afectación glomerular, tubular, intersticial y vascular suele ser proporcional entre sí, en cada biopsia. La afectación severa de uno de estos cuatro parámetros se acepta como razón que contraindica el trasplante.
El examen por congelación permite demostrar un estado aceptable o no aceptable para trasplante doble con menor riesgo de error, ya que se acepta que el grado de esclerosis sea superior a 4 (según el esquema apuntado arriba) y no exceda de 6 para cada uno de los riñones.
La coagulación intravascular no descarta un donante si se demuestra reducida a unos pocos glomérulos. En caso contrario el trasplante esta contraindicado.
Algunos donantes portadores de Glomerulonefritis especialmente la Glomerulonefritis con IgA mesangial muy frecuente en determinadas áreas, han sido trasplantados sin que se haya detectado una alteración significativa de la función del injerto. Es más, algunos casos aislados han mostrado la desaparición de los depósitos con el tiempo en una segunda biopsia. Resultados similares están descritos en Glomerulonefritis membranoproliferativas tipo I y Glomeruloesclerosis focal y segmentaria.
El hallazgo de un nódulo en la superficie del riñón es una indicación de biopsia el primer diagnóstico a excluir es el de Carcinoma. El diagnóstico diferencial debe incluir el Leiomioma (llamado también «capsuloma»), Lipomas y Angiomiolipomas y la Ectopia adrenal, alteraciones, que permiten el aprovechamiento de los órganos sin ningún problema.
Los lipomas (fig. 1A) pueden ser muy difíciles de diagnosticar en biopsias por congelación porque el tejido adiposo se corta mal y deben tenerse presentes cuando los cortes dan un espacio «en blanco» en el lugar donde se halla el «tumor». El examen macroscópico con una lupa puede acabar de convencer al patólogo de que este tejido blando y amarillo es grasa. La ectopia adrenal no es infrecuente (Tisher), algunas veces su localización fuera del riñón ha llevado a interpretarla como «metástasis» de un Carcinoma de Células Renales (WU) y puede ser de diagnóstico muy difícil si no se observa una cápsula que delimite la separación entre el tejido adrenal y el renal. Algunas veces las células adrenales se hallan totalmente en continuidad con el riñón y ofrecen un aspecto de transformación lipomatosa (fig. 2D).
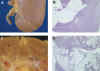
Fig. 1. Lipomas:
A) Nodulos amarillentos subcapsulares; B) Sección microscópica de A mostrando
un lipoma subcapsular que profundiza en la cortical; C) Nódulo amarillento
subcapsular que ocupa todo el espesor de la cortical en profundidad; D) Sección
microscópica de C mostrando un angiomiolipoma.
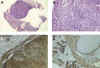
Fig. 2. Ectopía
Adrenal: A) Biopsia urgente de lesión nodular amarillenta que muestra una
lesión bien delimitada del parénquima renal; B) Otro ejemplo de ectopía
adrenal con células de aspecto ligeramente xantomatoso en continuidad a las
células tubulares renales; C) Positividad para Vimentina en el tejido adrenal;
D) EMA positivo en algunas células tubulares renales y negativo en las células
adrenales.
El hallazgo de una tumoración epitelial genera un problema más difícil que esta relacionado con las características histológicas del tumor, su tamaño y la posibilidad de bilateralidad o metástasis de la lesión.
Según la clasificación de las neoplasias renales (Bostwick) se separan dos grandes grupos. Como benignas: Adenoma Papilar (AP), Oncocitoma Renal (OR), y Adenoma Metanéfrico (AM). Como malignas: Carcinoma Renal de Células Claras (CRCC), Carcinoma Renal Papilar (CRP) Carcinoma Renal Cromófobo (CRC), Carcinoma de Ductos Colectores (CDC) y Carcinoma Renal Inclasificable (CRI).
El diagnóstico diferencial entre estas lesiones es muy claro a excepción de la diferenciación entre AP y CRP y en tumores muy pequeños entre AP y CRCC. Si bien durante mucho tiempo el tamaño tumoral estableció la diferencia entre Adenoma y Carcinoma (con diámetro superior a 3 cm. Toda lesión tumoral se consideraba carcinoma), en la actualidad el tamaño no tiene el mismo valor para todos los tipos de tumores.
Cualquier tumor que contiene células claras independientemente de su tamaño, debe ser considerado Carcinoma (Mostofi WHO) y cualquier tumor de células de citoplasma abundante y eosinofílico lleno de mitocondrias, independientemente de su tamaño, debe ser considerado un Oncocitoma (Störkel).
Por su frecuencia los tumores papilares requieren un pequeño comentario. El criterio del tamaño de la lesión ha evolucionado con el tiempo. Si hace unos años se admitía la benignidad de todos los tumores papilares de tamaño inferior a 3 cm este umbral se ha reducido a 0,5 cm (Störkel). Aunque esta distinción por el tamaño entre benignidad y malignidad es arbitraria se considera que el riesgo de aparición de carcinoma en el receptor es muy bajo (Randawa, Banff web). No es infrecuente que estas lesiones sean múltiples (fig. 3A) y bilaterales (Rosai) y por último, pequeños tumores papilares pueden hallarse en el espesor del parénquima y pasar totalmente desapercibidos (fig. 3D).

Fig. 3. Tumores
papilares: A) Múltiples nódulos amarillentos subcapsulares de diámetro
interior a 0,5 cm; B) En un corte por congelación la diferenciación entre el
tumor y el riñón normal se basa en el aspecto regular de los túbulos, el
citoplasma rosado (derecha) y la presencia ocasional de calcificaciones en el
tumor; C) Algunos tumores papilares tienen mayor crecimiento en profundidad de
los que muestra la superficie; D) Pueden observarse nódulos papilares
totalmente intrarenales y no detectables macroscópicamente.
Por otro lado se presentan problemas de diagnóstico histológico ya que en el AP el tamaño de las células puede ser variado y su citoplasma puede presentar diferente densidad y aspecto de células claras. Esta morfología es todavía más difícil de observar en los cortes por congelación que son los que se han venido utilizando hasta la actualidad para poder hacer el diagnóstico en el intervalo entre la extracción y la colocación del injerto. Desde el punto de vista genético la diferenciación de un tumor papilar con el CCC es posible pero no esta al alcance de la rutina. Los tumores papilares (AP y CRP) tienen alteraciones en los mismos genes (sí bien las de los CRP son más extensas), y diferentes de las alteraciones genéticas de los CRCC (Störkel). En resumen el diagnóstico diferencial más difícil de una pequeña lesión tumoral se establece entre un AP un CRP y un CRCC.
La experiencia referida en la literatura es breve (Heinz-Peer). También es baja la incidencia de carcinoma renal en el riñón trasplantado a pesar de la incidencia estimada (basada en datos autópsicos) entre 7 a 25% de pequeñas neoplasias de células renales en donantes. En conjunto parece razonable aceptar donantes con pequeñas neoplasias epiteliales (Randawa) pero no hay unanimidad y algunos centros rechazan cualquier órgano con neoplasias epiteliales pequeñas. Quedan por elucidar:
Conducta a seguir ante los tumores renales de tamaño igual o inferior a 0,5 cm.
Aprovechamiento de otros órganos como hígado y corazón en caso de donante multiórganico con tumores renales no detectados ecográfica ni macroscópicamente.
BIBLIOGRAFÍA
Rosai J. Surgical Pathology Mosby, 1996, pg. 1153.
Heinz-Peer G, Helbich T, Nötting B, Klauser R, Mülbacher F, Hübsch P. Renal cell carcinoma in an allograft kidney transplant. Transplantation 1994; 57: 475-7.
Heinz-Peer G, Helbich T, Barnas U, Mayer G, Mülbacher F, Mostbeck GH. Renal cell carcinoma of donor origin in two kidney transplants from a single donor. Transplantation 1995; 59: 912-3.
Memoria de la Organización Nacional de Trasplantes 1999. Rev Esp Trasp 2000; 9: 3-6.
Bostwick DG, Eble JN, Murphy GP. Conference Summary Diagnosis and Prognosis of Renal Cell Carcinoma: 1997 Workshop. Cancer 1997; 80, 975-6.
Mostofi FK, and CJ davis. Histological typing of kidney tumours. WHO Int. Histological Classification of Tumours. Second edition, Springer 1998.
Störkel S, Eble JN, Adlakha K, Amin M, Blute ML, Bostwick DG, Darson M, Delahunt B, Iczkowski K, Classification of Renal Cell Carcinoma Cancer 1997; 80: 987-9.
Wu T, Bihrle R, Yum MN. Heterotopic adrenal cortical adenoma masquerading as metastatic renal cell carcinoma. J of Urol 161 1999; 595-6.
Randhawa PS. Banff 2001 report: www.tpis.pathology.pitt.edu.