
Vol. 35, n.º 3, 2002
REVISTA
ESPAÑOLA DE
Vol. 35, n.º 3, 2002 |
Laia Bernet, Rafael Cano, Marco Bustamante1, José Manuel Cordero2
Servicio de Patología, Servicio de Digestivo1. Servicio de Medicina Nuclear2. Hospital La Ribera. 96 245 81 00. Carretera de Corbera, s/n. Alzira. 46600 Valencia.
RESUMEN
Introducción: El estudio histológico del ganglio centinela axilar (GC) está estableciéndose como un procedimiento de rutina en la cirugía del carcinoma infiltrante de mama. Los falsos negativos descritos son imputables tanto a la identificación del verdadero ganglio centinela como al protocolo aplicado para el estudio de dicho ganglio.
Nuestro objetivo fue estudiar la sensibilidad del procedimiento intraoperatorio cuando incluye la técnica de la citoqueratina.
Material y Metodos: Estudiamos 42 enfermas de carcinoma infiltrante de mama, todas ellas estadiadas clínicamente N0 (TNM), protocolizadas para cirugía radical o conservadora de la mama con vaciamiento axilar.
El estudio intraoperatorio del GC se efectuó realizando pares de cortes de 4( a intervalos de 40( hasta agotar la pieza . De cada par de cortes, uno se tiñó con H/E y el otro mediante una técnica rápida de CK por congelación.
Resultados: De las 42 enfermas, 15 tenían metástasis en el GC, de las cuales 6 no tuvieron metástasis a ningún otro nivel axilar. De las 15 enfermas mencionadas, 10 fueron micrometastásicas exclusivamente (depósito tumoral ( 2 mm). De ellas, 2 no fueron diagnosticadas en los cortes de H/E y sí en los cortes teñidos con CK.
Conclusiones: Nuestros datos apoyan que el estudio intaoperatorio rutinario de GC debe incluir la técnica de la CK rápida para obtener óptimos resultados.
Palabras clave: Ganglio centinela, citoqueratina, intraoperatoria.
SUMMARY
Introduction: Histopathological examination of the axillary sentinel node (SN) is becoming a routine procedure in the surgical phase of infiltrating ductal carcinoma of the breast (IDC). The SN exam may yield false negatives mainly due to failure to identify the SN but some of the false negatives may be the result of the pathological examination procedure applied. Our objective was to study the procedure sensibility when the cytokeratine technique was included in the interoperative protocol.
Material and Methods: 42 cases of IDC of the breast clinically staged N0 by TNM nomenclature were assigned to breast surgery (either radical or conservative) along with conventional axillary node dissection.
The interoperative protocol of the SN included processing the node ‘in toto’ by taking paired 4 (m separated 40 (m in depth until the entire tissue was used. For each pair of sections, one was stained with H&E and the other with a fast method for CK.
Results: Of the 42 patients, 15 had SN involvement by metastasis and for 6 of them this was the only site of metastatic disease, with no metastases being found in the rest of the nodes of the axillary dissection. Of these 15 cases, 10 were micrometastasis (size of metastasis = or < 0.2 cm.); 2 of the 10 were found only by CK staining.
Conclusions: Although our series was limited, we believe our results justify the increase in cost and in the time spent on the procedure and consider that CK staining should be included in the routine interoperative consultation of the SN.
Key words: Sentinel node, cytokeratin, frozen section.
INTRODUCCIÓN
La biopsia de ganglio centinela (GC) está estableciéndose como un procedimiento de rutina en la cirugía del carcinoma infiltrante de mama. El concepto de GC en cirugía de cáncer de mama se basa en el hecho de que el tumor drena de una manera lógica del primer al último nivel linfático axilar, siendo el primero de todos los niveles el GC. La localización de este primer drenaje o GC se relaciona con la anatomía funcional individual.
El valor predictivo del GC no sólo depende de su correcta identificación, de la uni-multifocalidad del tumor primario o de la posibilidad de metástasis «en salto» a otros ganglios posteriores al centinela en el drenaje linfático, sino también, y de manera decisiva, del protocolo utilizado para el estudio intraoperatorio del GC. Ello explica, al menos en parte, la gran variación en la tasa de falsos negativos referida en la literatura, que oscila entre el 0 y el 24% (1,2).
Por otra parte, se ha sugerido que la enfermedad metastásica oculta puede ser un predictor de recurrencia en el 25% de los casos sin metástasis ganglionares que desarrollan recurrencia a lo largo del tiempo (3,4), lo cual refuerza la necesidad de un estudio minucioso y de un diagnóstico preciso.
MATERIAL Y MÉTODOS
Las pacientes incluidas en el estudio fueron todas mujeres con cáncer de mama operable (T1-T2 o T3 según el sistema TNM de estadiaje), sin evidencia clínica de metástasis axilares (N0) y que fueron protocolizadas para cirugía conservadora o radical con vaciamiento axilar.
Fueron criterios de exclusión el embarazo o lactancia, radiación o biopsia previas, multifocalidad o multicentricidad y fallo en la identificación del trazador en la gammagrafía (2 casos). La muestra final estuvo constituída por 47 casos cuyos detalles clínico-patológicos se detallan en las tablas I y II.


Se realizó inyección peritumoral de entre 900 y 1800 microCi de 99mTc-nanocoloide de albúmina humana (Nanocoll®, Nycomed-Amersham), obteniéndose imágenes gammagráficas al cabo de un mínimo de 2 horas de su administración. La identificación intraoperatoria de los ganglios centinela se realizó mediante el empleo de una sonda de detección modelo Navigator GPS®.
Se admitió como GC hasta un máximo de tres ganglios linfáticos.
Todos los GC fueron cortados en dos mitades si eran menores de 0,5 cm. y en cortes seriados a 2-3 mm. si eran mayores de 0,5 cm. Cada corte se incluyó en una cápsula independiente y se le asignó un número de orden. De cada bloque se hicieron 2 secciones consecutivas de 4 micro-m a intervalos de 70 micro-m, de las cuales una se tiñó con H/E. Sólo en caso de que la H/E fuera negativa para metástasis, se procedía a teñir cada uno de los cortes-pareja con la técnica inmunohistoquímica de Citoqueratina para congelación (protocolo Dako EnVisionTM) (5).
Se recogieron los siguientes datos: identificación de la paciente, diagnóstico y tamaño del tumor primario, presencia o ausencia de invasión linfo-vascular, número de GC identificados, número de bloques incluidos, número de cortes de H/E y CK de cada uno de ellos, presencia o ausencia de macro y micrometástasis en el/los GC y cociente entre número de ganglios positivos en el vaciamiento axilar y número total de ganglios aislados en el mismo.
RESULTADOS
El tiempo máximo consumido para el estudio del GC fue de 50 minutos y el tiempo mínimo de 20 minutos, con un tiempo medio de 35 min.
De las 47 enfermas incluidas, 16 pacientes tenían metástasis en el GC (34,0%).
De ellas, 10 tenían micrometástasis exlusivamente (21,2%). Todas las micrometástasis se diagnosticaron entre el primer y cuarto nivel de corte histológico. Todas las metástasis fueron diagnosticadas en los cortes de H/E. Sin embargo, dos micrometástasis fueron diagnosticadas sólo en las CK (fig. 1), lo que significa un porcentaje del 4,7%.
No se observó ningún falso negativo.
En 6 casos (12,7%), el GC fue el único positivo de todo el vaciamiento. En el resto de las enfermas, se encontró, al menos, otro ganglio positivo.
En un caso, se hallaron inclusiones epiteliales benignas intraganglionares que fueron diagnosticadas en los cortes de H/E.
Sobre estos datos, se elaboró una tabla 2 x 2 , a partir de la cual se calcularon la sensibilidad, especificidad, valor predictivo positivo (VPP) y valor predictivo negativo (VPN) de la prueba.
Comparando en una tabla 2 x 2 los resultados del ganglio centinela con los del vaciamiento ganglionar, calculamos la sensibilidad, especificidad, valor predictivo positivo (VPP) del GC, valor predictivo negativo (VPN) y cociente de probabilidades de un resultado positivo (LR) de la prueba (tabla III).
Sensibilidad: 1
Especificidad: 0,81
VPP: 0,62
VPN: 1
LR: 6,2

Comparando la sensibilidad del protocolo intraoperatorio para GC sólo con H/E e incluyendo la CK para cortes congelados, se obtuvo que en el 12,5% de las enfermas había células tumorales que no habían sido diagnosticadas en los cortes teñidos con H/E.
DISCUSIÓN
Nuestros resultados indican que el GC es una prueba de alta sensibilidad y valor predictivo positivo para detectar enfermedad metastásica en el vaciamiento axilar.
Sin embargo, la especificidad es relativamente baja, dato que puede ser atribuible a la escasa casuística de que disponemos.
Hasta el momento, no hay evidencia definitiva de que un GC negativo se correlacione invariablemente con una axila negativa, excepto tal vez en los tumores T1a-b (6).
Si el GC es positivo, por el contrario, existe 6 veces más posibilidades de encontrar metástasis en el vaciamiento axilar.
De especial interés es el tema de las micrometástasis, cuyo valor pronóstico no ha sido todavía definido en cáncer de mama, aunque existen estudios retrospectivos que describen su efecto adverso tanto sobre las tasas de recurrencia como de supervivencia (7).
Se ha referido que la detección de micrometástasis aumenta desde un 6,8% (3,8) hasta un 10% (Cox, datos no publicados) o un 20% (9), según el protocolo de estudio histológico aplicado. La sensibilidad de la técnica en estas series oscila entre el 88,1% y el 96%, con una especificidad y valor predictivo positivo del 100%.
En nuestra serie, de 16 casos con metástasis en el GC, 10 fueron micrometastásicos y, de ellos, 2 fueron diagnosticados exclusivamente en los cortes teñidos con citoqueratina (12,5%) (figs. 1 y 2). En ambos casos, el diagnóstico del tumor inicial era de carcinoma lobular.
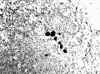
Fig. 1. Cúmulo de células epiteliales, CK-positivas, menor de 2 mm, en
el parénquima ganglionar (200x).
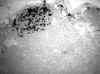
Fig. 2. Células epiteliales,
CK-positivas, en el parénquima ganglionar y seno marginal del ganglio centinela
(200x).
En un caso, se diagnosticaron inclusiones epiteliales benignas, citoqueratina-positivas, cuyo diagnóstico diferencial con un depósito metastásico se hizo atendiendo a los criterios histológicos observados en los cortes de H/E.
Todavía no ha sido demostrado si el estudio protocolizado de GC con citoqueratinas es realmente útil o coste-efectivo y recomendaciones recientes indican que hasta que se haya demostrado el impacto negativo de las micrometástasis en la supervivencia global y en el intervalo libre de enfermedad de las pacientes con cáncer de mama no está justificado dicho coste fuera del ámbito de estudios clínicos (10).
El número medio de cortes teñidos con CK necesario para cada caso oscila en nuestro estudio alrededor de 8 cortes por GC, lo que supone un coste económico añadido que oscila alrededor de los 48¤ sólo para aquéllos casos donde la H/E no haya sido positiva para metástasis (65,9%).
Aunque el tiempo medio necesario desde que se recibe la pieza hasta la emisión del informe de la biopsia intraoperatoria es variable en función tanto del número de ganglios centinelas como de la necesidad o no de realizar la CK intraoperatoria, la media, en nuestro laboratorio, es de 35 min., tiempo aceptable por el cirujano y durante el cual trabaja sobre el tumor primario.
Creemos que un porcentaje del 12,5% de falsos negativos es una tasa excesiva para la conservación de la axila y que, en base a nuestros resultados, puede ser drásticamente reducido con el uso protocolizado de la citoqueratina en congelación.
Estudios prospectivos en marcha definirán el impacto de las micrometástasis diagnosticadas sólo por CK sobre el curso global de la enfermedad y sus tasas de recurrencia. Mientras, el hecho de que el procedimiento haya sido asumible tanto en tiempo como en coste económico por un hospital de nuestras características apoya la idea de que el estudio intraoperatorio del GC debe incluir la CK en cortes congelados para los casos en que el estudio con H/E sea negativo si se plantea la cirugía axilar conservadora como una posibilidad terapéutica en la cirugía del cáncer de mama.
BIBLIOGRAFÍA
Viale G, Bosari S, Mazzarol G, Galimberti V, Luini A, Veronesi P, Paganelli G, Bedoni M, Orvieto E. Intraoperative Examination of Axillary Sentinel Lymph Nodes in Breast Carcinoma Patients. Cancer 1999; 85(11): 2433-8.
Fitzgibbons PL, Page D, Weaver D, Thor a, Craig a, Clark G, Ruby S, O’Malley f, Simpson JF, Connolly JL, Hayes DF, Edge SB, Lichter A, Schnitt SJ. Prognostic Factors in Breast Cancer-College of American Pathologists Consensus Statement 1999. Arch Pathol Lab Med. 2000; 124: 966-78.
Weaver DL, Krag DN, Ashikaga T, Harlow S, O’Connell M. Pathologic Analysis of Sentinel and Nonsentinel Lymph Nodes in Breast Carcinoma. Cancer 2000; 88: 1099-107.
Hainsworth PJ, Tjandra J, Stillwell RG, Machet D, Henderson MA, Rennie GC et al. Detection and significance of occult metastases in node-negative breast cancer. Br J Surg 1993; 80(4):459-63.
Ruck P. EnVision for rapid immunostaining in intraoperative frozen section diagnosis. Dako facts 2001; Vol1,n.º 2: 6-7.
Mincey B, Bammer T, Atkinson E, Perez E. Role of Axillary Node Dissection in Patients With T1a and T1b Breast Cancer: Mayo Clinic Experience. Arch Surg 2001; 136(7): 779-782.
Mascasrel I, Bonichon F, Coindre JM, Trojani M. Prognostic signficance of breast cancer axillary lymph node micrometastases assessed by two special techniques: reevaluation with longer follow-up. Br J Cancer 1992; 66:523-27.
Liberman L. Pathologic Analysis of Sentinel Lymph Nodes in Breast Carcinoma. Cancer 2000; 88(5): 971-7.
Turner R, Ollila D, Stern S, Giuliano A. Optimal Histopathologic Examination of the Sentinel Node for Breast Carcinoma Staging. Am J Surg Pathol 23(3); 1999: 263-7.
Lawrence WD. ADASP recommendations for processing and reporting of lymph node specimens submitted for evaluation of metastatic disease. Virchows Arch 2001; 439: 601-3.