
Vol. 36, n.º 1, 2003
REVISTA
ESPAÑOLA DE
Vol. 36, n.º 1, 2003 |
Andrés Pérez Barrios, M.I.A.C.1, Nuria Alberti Masgrau1, Pedro P. De Agustín de Agustín, F.I.A.C.1, Celestino Rodríguez2, Dimitra Rigopoulou2, Federico Hawkins Carranza2, Francisco José Martínez Tello1
1 Departamento de Anatomía Patológica. Hospital 12 de Octubre. Madrid. 2 Servicio de Endocrinología. Hospital 12 de Octubre. Madrid.
RESUMEN
El diagnóstico en punción aspiración con aguja fina de «Proliferación-Neoplasia Folicular» en la patología tiroidea es poco preciso en determinar la condición neoplásica benigna o maligna de las lesiones foliculares.
Este diagnóstico se basa en que haya celularidad folicular destacable o aumentada de carácter neoplásico y escaso o ausente coloide de fondo, tratando de establecer un diagnóstico concreto de benignidad o malignidad, con prioridad en este último de la exéresis quirúrgica.
En este trabajo relatamos nuestra experiencia en 200 casos con el diagnóstico citopatológico de «Proliferación Folicular» y la exéresis quirúrgica, excluyendo los diagnósticos de benignidad (Bocios Coloides, Tiroiditis) o malignidad (Carcinoma Papilar, Medular u otros) con características propias.
Tras el examen histológico, 83 casos (42%) fueron lesiones benignas (71, Hiperplasia Uni o Multinodular; 6, Hiperplasia Difusa y 6, Tiroiditis Linfocitaria Crónica). 65 (32,5%) correspondieron a Adenomas Foliculares.
52 casos (26%) fueron Carcinomas: (27, Carcinoma Papilar; 20, Carcinoma Folicular; 3, Carcinoma Medular; 1, Carcinoma Epidermoide de Laringe poco diferenciado; 1, Carcinoma Metastásico de Colon). En 58 casos (29%) se enunció ademas el diagnóstico de Sospecha de malignida, confirmándose en 39 (68%) la presencia de carcinoma.
Se postula que en el 70% de estos diagnósticos, deben ser prioritarios para la cirugía por su carácter neoplásico, tratando de delimitar las lesiones neoplásicas más agresivas. La media de la exéresis quirúrgica en los casos que fueron Carcinomas fue de 112±98 días.
Palabras Clave: Punción-Aspiración con Aguja Fina, PAAF, Tiroides, Proliferación-Neoplasia Folicular.
SUMMARY
«Follicular proliferation» is an imprecise term used in cytological diagnosis of samples obtained from fine needle aspiration (FNA) of the thyroid gland. This diagnosis covers a relatively broad spectrum of reactive and neoplastic lesions.
The diagnosis of follicular proliferation is based on two criteria: increased follicular cell density and scanty or absent colloid substance. We use this diagnosis in order to indicate early surgical treatment of well-differentiated follicular neoplasms.
In this paper, we comment 200 cases diagnosed as follicular proliferation by FNA of the thyroid gland. All cases of colloid goiter, thyroiditis or carcinoma with specific findings (papillary, medullary or other) were excluded.
On hIstological examination of the surgical specimens, 42% (83 cases) were considered benign: 71 cases of uni or multinodular goiter (of which 67% presented mixed or adenomatoid areas), 6 diffuse hyperplasias and 6 chronic thyroiditis. 32.5% (65 cases) were diagnosed as follicular adenoma. Carcinoma was diagnosed in 52 cases (26%): 27 papillary carcinomas, 20 follicular carcinomas, 3 medullary carcinomas, 1 poorly differentiated laryngeal squamous carcinoma and 1 metastatic colonic carcinoma.
In 58 cases (29%) an additional diagnosis of suspicious form malignancy was made. Histology examination demonstrated carcinoma in 39 (68%) of these cases.
Since in 70% of these cases a final diagnosis of malignancy was rendered, we suggest that they must be considered candidates for early surgery. The average time between diagnosis and surgical excision was 112±98 days.
Key Words: Fine Needle Aspiration (FNA), Thyroid, Follicular Proliferation/Neoplasm.
INTRODUCCIÓN
« From our data it is evident that diagnosis by fine needle aspiration biopsy cytology of the thyroid gland makes posible selection of patients for surgery with a high degree of accuracy when there is a question of whether palpable thyroid nodules are benign or malignant» T. Löwhagen, 1979.
El diagnóstico en Punción Aspiración con Aguja Fina (PAAF) de « Proliferación-Neoplasia Folicular» en la patología tiroidea es un término genérico poco preciso en determinar la condición neoplásica benigna o maligna de las lesiones foliculares.
Este diagnóstico se basa en que en las extensiones haya celularidad folicular destacable o aumentada de carácter neoplásico con coloide escaso o ausente de fondo. Incluye aquellas lesiones foliculares verosímilmente tumorales sin características propias que deben de ser preferentes para la exéresis quirúrgica, excluyendo aquellas con un diagnóstico concreto o ya tipificado de malignidad.
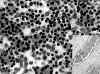
Fig. 1. PAAF
de Tiroides. Giemsa-QCA. x200. Proliferación Folicular. Microfolículos.
Recuadro inferior: Tejido. HE. x100. Carcinoma Folicular. Invasión linfática
capsular.
Los criterios histológicos para definir la malignidad en las lesiones tiroideas foliculares estan bien definidos por la presencia inequívoca de infiltración de la cápsula de la lesión, los vasos linfáticos o venosos periféricos o claramente el parénquima tiroideo (19, 38, 39, 40) (fig. 1), lo que no es posible determinar en el cuadro citológico con sólo las imágenes celulares o arquitecturales en la PAAF.
Esta revisión trata de identificar las diferencias citopatológicas, dentro de lo posible, entre neoplasias tiroideas de patrón folicular con bajo-indeterminado riesgo de malignidad y aquellas con sospecha o alto riesgo de malignidad.
FUNDAMENTO HISTORICO
Las primeras referencias a la citología por punción con aguja fina del tiroides se encuentran en el artículo de Martín y Ellis en 1934 (45); entre 1948 y 1954 hay publicados numerosos trabajos de Piaggio Blanco, Tempka et al, Lopes – Cardozo en su «Clinical Cytology», Bonneau o Schmidt et al. (15). El fundamento y desarrollo completo de la técnica lo realizan en la década de 1950-1960 componentes de la escuela sueca, Söderstrom , Einhorn, Franzèn y Zajicek (59); algo posteriores a estos últimos y sin embargo decisivos por sus aportaciones y experiencia en la implantación de la punción con aguja fina en nuestro país fueron Torsten Löwhagen y Jan S Willems: (43,44). Manfred Dröese aporta excelente iconografía de la patología tiroidea por punción y de la experiencia centroeuropea de Hauptmann y Skrabalo (15). Kini (40) junto con Hamburger y Kline (41) en sus respectivos libros, explican ampliamente la patología tiroidea por punción, aportando datos diagnósticos e iconograficos en el estudio de las neoplasias foliculares tiroideas.
SITUACIÓN DE LA TÉCNICA Y CRITERIOS DIAGNOSTICOS
La PAAF tiroidea es actualmente un eslabón mas de la cadena en el protocolo de actuación sobre el nódulo tiroideo. En el Hospital 12 de Octubre se realizaron 4.750 punciones de tiroides entre los años 1991 y 2000, con un promedio de 400 a 500 PAAF anuales. En el 7% se efectuó el diagnóstico de «Neoplasia-Proliferación Folicular». Los pacientes para la punción fueron remitidos de los distintos Servicios hospitalarios o de los ambulatorios del Area: Cirugía, Endocrinología, Ginecología, Oncología, etc. La PAAF la realizó en el 95% de los casos un Anatomopatólogo y si hubo dificultad en la palpación, la hizo un radiólogo, con control ecográfico.
Al paciente, previa cita, se le coloca en decúbito supino y con el cuello en variable hiperextensión, realizandose la PAAF con el material y la técnica de aspiración habituales (43,59). Es importante conocer las características macroscópicas del coloide habitual, que puede ser hemático o no. Si la lesión es notoriamente sangrante en una primera punción se saca la aguja y se incide en otra localización.
El material obtenido se extiende en un portaobjetos y se seca al aire para hacer tinción de Giemsa modificada —QCA, Panóptico Rápido. Química Clínica Aplicada. Distribuidor: Francisco Soria Melguizo—. Las lesiones que son celulares muestran al extenderlas «grumos» o «arenillas» blanquecinas de tejido tiroideo, claramente distintas de aquellas que muestran principalmente coloide «en sábana». Si la lesión lo permite y la sustancia es grumosa, se obtienen mas extensiones para fijación inmediata en alcohol de 96° y hacer la tinción de Papanicolaou; esta técnica nos permitirá reconocer la morfología nuclear o los nucleólos y si procede, parte de estos frotis podrán reciclarse para estudio inmunocitoquímico. De igual modo se pueden destinar algunas de las punciones para su inclusión y fijación en glutaraldehido y estudio ultraestructural.
Para el diagnóstico de Proliferación Folicular se consideran como criterios citopatológicos prioritarios los de «ausencia de coloide» y la manifiesta «celularidad» de las extensiones junto con el resto de las apreciaciones citopatológicas adaptadas de T. Löwhagen y cols. (43,44), (cuadro 1), (figs. 1, 3, 4 y 5). En nuestros casos los frotis celulares estuvieron definidos por la presencia de mas de 10 grupos, en placa o sincitiales, de más de 10 células cada uno, con patrón folicular o trabecular.
Se consideró ademas como «Sospecha» de malignidad e indicándolo así en el informe citopatológico, la presencia asociada de: Microfolículos, estratificación nuclear y formación de sincitios celulares, irregularidad de las membranas nucleares ó presencia de nucleólos prominentes (figs. 1, 5 y 6). En estas lesiones siempre se indicó como necesaria la exéresis quirúrgica mas inmediata.
La precisión en determinar si una lesión proliferativa folicular fué un adenoma o un carcinoma dependió tanto de la calidad de la muestra obtenida, de la aplicación de los criterios ya enunciados y de la experiencia en la observación de la patología tiroidea.
De acuerdo con S Kini (40), las lesiones histopatológicas que pueden corresponder con el diagnóstico de Proliferación Folicular, en la PAAF, en sentido estricto, son:
1. Hiperplasia Multinodular con áreas adenomatosas.
2. Adenomas Foliculares y Oncocíticos.
3. Carcinomas Foliculares y Oncocíticos.
4. Variantes Foliculares del Carcinoma Papilar.
Con criterios citológicos estrictos, el porcentaje de malignidad y de patología adenomatosa en los diagnósticos de proliferación folicular, debería ser superior al 70% ( 5,14,15,40,42,43,52,55), (figs. 1, 3 y 4).
En este diagnóstico a su vez se excluyen las lesiones malignas con su diagnóstico citológico propio: Carcinomas Papilares, Carcinomas Medulares, otras Neoplasias.
En este trabajo aportamos nuestra experiencia en 200 casos con el diagnóstico citopatológico de «Neoplasia-Proliferación Folicular» y la exéresis quirúrgica, excluyendo el resto de las punciones tiroideas con los diagnósticos de benignidad (Bocios Coloides, Tiroiditis) o malignidad (Carcinoma Papilar, Medular u otros) con características propias.
EXPOSICIÓN DE NUESTROS RESULTADOS
Entre el mes de Enero de 1990 y el de Diciembre de 1999 se realizaron 4.870 PAAF de tiroides en las que en 300 casos (6,16%) se estableció el diagnóstico de Proliferación v.s. Neoplasia Folicular. En 200 (67%) y según el tipo de lesión, se realizó nodulectomía, hemitiroidectomía, tiroidectomía subtotal o tiroidectomía total en los carcinomas.
170 pacientes (85%) fueron mujeres y 30 (15%) varones, con edades entre 21 y 90 años y una media de 45 años. El tiempo medio de exéresis quirúrgica fue de 112±94 días en las lesiones que fueron malignas, considerándose clínicamente prioritarias para cirugía aquellas con criterios citopatológicos de sospecha de malignidad, nódulos con crecimiento progresivo, palpación dura o si fueron varones y mayores de 45 años.
De estos 200 casos, 83 (41,5%) correspondieron a lesiones benignas, 65 (32,5%) a Adenomas Foliculares y 52 (26%) a Carcinomas, (tabla 1).
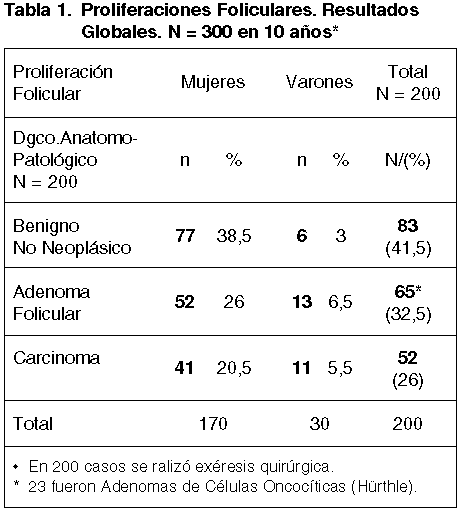
De los 52 casos que fueron Carcinomas, los hallazgos histopatológicos se muestran en la tabla 2.
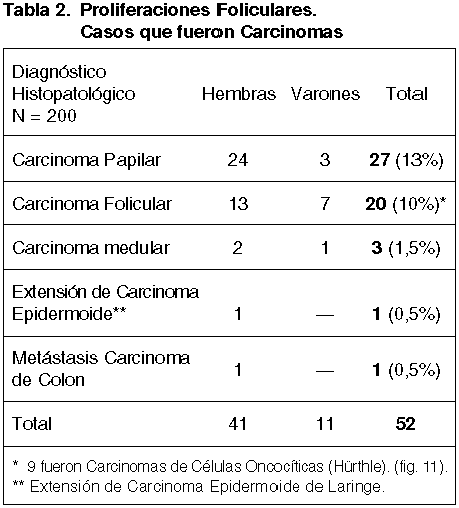
27 (13%) de estos diagnósticos se confirmaron como Carcinomas Papilares, los más frecuentes entre los carcinomas tiroideos, hallándose 5 en la comprobación histopatológica como Variantes Foliculares de esta neoformación (fig. 9).
Tambien con respecto al número total de casos hay una mayor proporcionalidad de Carcinomas Foliculares en varones (7 v/13 h) y menor proporción de Carcinoma Papilaren varones con relación a las hembras afectadas (3 v/24 h).
9 (45%), de los 20 Carcinomas Foliculares, lo fueron de tipo Oncocítico-Hürthle.
En 58 (29%) de estos casos se enunció ademas el de Sospecha de malignidad, confirmándose en 39 (68%) la existencia de malignidad: 23, Carcinoma Papilar; 12, Carcinoma Folicular; 2, Carcinoma de Células oncocíticas; 1, Carcinoma Medular; 1, Carcinoma Epidermoide de Laringe).
La mayor parte de los Carcinomas Papilares (85%, 23 de 27) fueron considerados como sospechosos. Sin embargo, sólo 14 (70%) de los 20 Carcinomas Foliculares, se consideraron con sospecha de malignidad.
Tanto el Carcinoma Medular, la Metás tasis de Carcinoma de Colon como el Carcinoma Epidermoide sin diferenciación se consideraron como Sospechosos.
El carcinoma Medular mostró un patrón trabecular-folicular sin especificidad para establecer tal diagnóstico. El Carcinoma Epidermoide no mostraba en la PAAF células con diferenciación escamosa, por lo que no fue posible establecer tal diagnóstico. La neoplasia colónica mostraba células de citoplasma amplio epitelioide y no cilíndrico estratificado como suele ser habitual, por lo que se interpretó como de Sospecha de Carcinoma Papilar.
En los 19 con sospecha restantes, en los que no se confirmó la malignidad, 12 (63%), fueron Adenomas Foliculares; 4, fueron Hiperplasias Nodulares; 2, Hiperplasias Difusas y 1, Tiroiditis Linfocitaria.
La Sensibilidad global de los diagnósticos para que las lesiones fueran Adenomas o Carcinomas fue de 60%. Considerando aquellas con diagnóstico de Sospecha de malignidad, y que fueron Carcinomas, la Sensibilidad fue de 68%. La media de la exéresis quirúrgica en los casos que fueron Carcinomas fue de 112±98 días.
De los 83 casos que fueron lesiones benignas, 71 correspondieron a Hiperplasias uni ó multinodulars, 6 a Tiroiditis Linfocitaria y 6 a Hiperplasias Difusas, como se expone en la tabla 3.
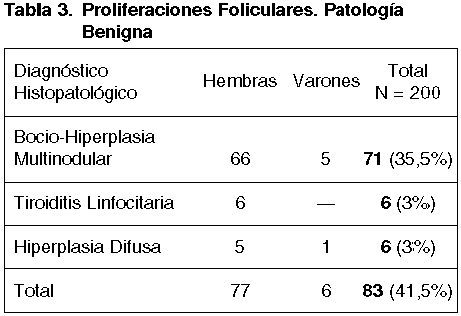
Los 71 casos con el Diagnóstico histopatológico de Hiperplasia multinodular mostraron en 48 (67%) áreas de patrón mixto macro —microfolicular— adenomatoide que podrían justificar el aspecto proliferativo.
En los 23 (33%) casos restantes la presencia de cierta cantidad de coloide, pese a la celularidad aumentada, podría haber decidido menor agresividad y enunciarse como «Proliferación Folicular de carácter Indeterminado», benigno o maligo (fig 7).
De los 6 casos de Tiroiditis Linfocitaria, 1 se consideró sospechoso de malignidad, por la gran celularidad exhibida (fig. 13). En 2 casos de Hiperplasia Nodular Difusa, las alteraciones citológicas en la PAAF —celularidad aumentada y cierto pleomorfismo— fueron sujetos del diagnóstico de sospecha.
Las técnicas de inmunomarcaje citológico se emplearon en la PAAF o en Intraoperatoria en casos especiales, para confirmar sobre todo los Carcinomas Medulares —Cromogranina, Calcitonina—, realizándose la técnica sobre las preparaciones previamente teñidas con Papanicolaou.
Las técnicas de Inmunomarcaje citológico para las Neoplasias Tiroideas, empleadas en nuestro Laboratorio se citan en la tabla 4.
Con el resto de inmunomarcadores CD –44, Ciclin –1, la experiencia en PAAF está en estudio.
COMENTARIOS Y DISCUSIÓN
En la PAAF de tiroides la incidencia de neoplasia maligna oscila entre el 5 y el 10% de los casos; 15-31% de estos casos corresponden a neoplasias foliculares benignas o carcinomas (3,4,7,34,36,51). Hay entidades benignas que igualmente pueden parecer «proliferaciones foliculares» y que debemos considerar antes de establecer un diagnóstico de neoplasia folicular. Estas lesiones estan definidas en el cuadro 1.
En el Hospital 12 de Octubre 7% de las PAAF de Tiroides anuales, corresponden a un diagnóstico de «Proliferación Folicular» en sentido general, cifra similar a la de otras publicaciones (2,19,24,26,32,33,36); en algunos de estos casos, además, se establece el de «Sospechoso de Malignidad», con la posibilidad de neoformación maligna.
En nuestra casuística, 26% de las lesiones con este diagnóstico fueron Carcinomas y el 32% fueron Adenomas Foliculares (58% de neoplasias). En otros estudios, el porcentaje de malignidad con este diagnóstico oscila entre el 15 y el 31%. (2,7,12,14,19,24,26,31,33,36,37, 41,42,43,50,59).
Con el diagnóstico de Proliferación Folicular se señala la importancia de establecer prioridad en la exéresis quirúrgica ademas de tratar de clasificar las lesiones en Adenomas o Carcinomas. De hecho, el porcentaje de Sospechosos de malignidad desde el trabajo publicado en 1985 (1), de 12,10% de casos con este diagnóstico se han reducido al 7% actual. Sin embargo el número de Neoplasias Malignas tiroideas con exéresis quirúrgica tras la PAAF ha aumentado de un 10% de las primeras épocas (1979-1985), a 21% actual (34); el porcentaje de operabilidad prioritaria de las lesiones más agresivas aumenta con el número de casos y la experiencia (7,31,44,50 ).
A diferencia de los Bocios coloides convencionales, en los que predomina el coloide, los macrófagos y los grupos celulares de tamaño pequeño, en las verdaderas Proliferaciones foliculares es prominente la celularidad en la que las placas o grupos tienden a ser amplios, estratificados en capas celulares y el diámetro nu clear, en general, es tambien mayor, superior a las 12 micras (8,17,18,47). En el capítulo correspondiente a la punción tiroidea del libro monográfico de J. Zajicek, en 1969 (59), T. Löwhagen separa del Bocio Coloide convencional el Bocio Neoplásico v.s Adenoma folicular y el Carcinoma Folicular. Se menciona tambien la presencia de Coloide en el interior de las estructuras microfoliculares como signo de agresividad (5,9,15, 39,43,55 ) (figs. 1, 5 y 6).
La presencia de células bizarras o con anisocariosis no es signo necesario de malignidad puesto que este tipo de células, de hábito regenerativo-reparativo, se observan en Bocios con fenómenos degenerativos, fibrosis o larga evolución; no obstante casos con estas alteraciones fueron objeto de Falsos Positivos en nuestra experiencia inicial (1,7,) (fig. 2).

Fig. 2. PAAF
de Tiroides. Giemsa-QCA x400. Bocio Coloide. Células bizarras-reparativas.
De acuerdo con S. Kini (40) se establece como mayor signo de agresividad la presencia de sincitios y estratificaciones en los grupos celulares, con presencia de mas cantidad de estructuras trabeculares en las proliferaciones foliculares de patrón embrionario (figs. 3 y 4) y más cantidad de estructuras laminares con microfolículos en las de tipo fetal (12), (fig. 5). Estas aseveraciones se confirman en trabajos posteriores (3,5), tratando incluso de subclasificar la agresividad delas lesiones foliculares para reducir la exéresis tiroidea inmediata sólo a los casos verdaderamente «Sospechosos» o clasificar como «Indeterminados» a aquellos con cirugía a mayor plazo (32,51).

Fig. 3. PAAF
de tiroides. Giemsa-QCA x200. Carcinoma Folicular. Patrón celular
embrionario-trabecular.
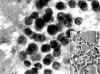
Fig. 4. PAAF
de Tiroides. Papanicolau. x400. Adenoma Folicular. Patrón
trabecular-microfolicular. Recuadro inferior: Tejido x200. Adenoma Folicular.
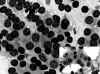
Fig. 5. PAAF
de Tiroides. Giemsa-QCA. x200. Proliferación Folicular. Microfolículos con
coloide. Recuadro inferior: Papanicolau. x200. Carcinoma Folicular.
Tambien, como signos de malignidad citológica o mayor agresividad, se señala la presencia de nucleólos patentes, la irregularidad de la membrana nuclear ó el aumento significativo del área nuclear (15,17,18), (fig. 6), situando aparte a las neoplasias de células oncocíticas, con área y diámetro nucleares más amplios.

Fig. 6. PAAF
de Tiroides. Proliferación folicular Sospechosa. Giemsa-QCA. x200. Patrón
trabecular-microfolicular. Núcleos irregulares. Recuadro inferior: Giemsa-QCA
x200. Microfolículos. Carcinoma Folicular.
En determinaciones de Citometría Estática, la Densidad Optica Nuclear —densidad de gris en la medición citométrica—, medida con análisis de imagen, está generalmente aumentada en los Adenomas y puede ser menor en los Carcinomas (17,18,21,22). T Löwhagen (8,43) ya observó una mayor variación en el tamaño nuclear en los Adenomas con respecto a los Carcinomas, tanto en el diámetro como en el área nuclear media, por encima de las 40-50 micras cuadradas.
En Citometría por Imagen o de Flujo, la Ploidía o a la Fase de Proliferación en las neoplasias foliculares muestran marcadas variaciones en los Carcinomas foliculares (10,17,18,21,22 ). La Aneuploidía en los Adenomas se establece como marcador de malignidad potencial (10,39). Al hallarse metástasis de Carcinomas Foliculares con patrón diploide, ó lesiones benignas con patrón hiperploide o incluso Aneuploide (10), no se establece como un criterio prioritario de malignidad.
La presencia de nucleólos visibles en más del 55% de los núcleos o formaciones nucleolares múltiples, favorece tambien el diagnóstico de malignidad (23,31,40,47).
Muchas lesiones foliculares en el examen histológico, tanto Adenomas como Carcinomas, tienen un patrón celular polimorfo, con áreas de células con escaso citoplasma, otras cuboideas, otras epitelioides o plasmacitoides, otras fusiformes. La característica común a todas estas lesiones histológicas es la escasa presencia o ausencia de estructuras foliculares bien desarrolladas o patrones sólidos, lo que se refleja en la celularidad «aumentada» o la estratificación celular anormal en la Punción con Aguja Fina (fig. 3). Este monomorfismo, polimorfismo o pleomorfismo sin características propias hace que el diagnóstico sea necesariamente de «Sospecha» de malignidad.
Las extensiones que muestran coloide acuoso mas o menos abundante, no viscoso, y patrón «celular» folicular algo prominente (fig. 7), deben considerarse, junto con otros autores y a nuestro parecer, como neoplasias de carácter « indeterminado « benigno ó neoplásico (9,51,52,55), aún siendo no obstante Proliferaciones Foliculares: El 33% de nuestros casos fueron Adenomas Foliculares y en el 36% bocios multinodulares que en la comprobación histológica mostraban áreas tisulares adenomatoides en 2/3 de los casos (tablas 1 y 3); este porcentaje de lesiones benignas es similar al de otros estudios (2,4,19,24,32,42,51).

Fig. 7 PAAF
de Tiroides. Proliferación folicular "indeterminada". Giemsa-QCA.
x100. Grupos foliculares numerosos y coloide. Tejido: Hiperplasia nodular
tiroidea con áreas adenomatosas.
En 23 casos (33%) de 83 que fueron no neoplásicos, hubiera sido posible la reclasificación de Proliferación Folicular a lesión benigna —Bocio Coloide— o similar.
En las Proliferaciones foliculares la cromatina nuclear suele ser grumosa, dispersa o con claros rasgos de hipercromasia. La presencia de hendiduras nucleares en la tinción de Papanicolaou o aclaramientos y aspecto microperforado ó «apolillado» de la cromatina en la tinción de Giemsa, junto con un patrón sincitial y laminar en los agrupamientos foliculares, deberá hacer pensar en una neoplasia papilar en la que los otros rasgos específicos (cuadro 1) no aparecen (16,20,46).

En nuestros 5 casos que fueron Carcinomas Papilares de patrón Folicular en la histología, predominaba el patrón laminar y sincitial de los grupos con presencia de microfolículos en 3 de los 5 casos y cromatina apolillada con ocasionales hendiduras en 4; en 1, había presencia de alguna inclusión intranuclear ocasional (fig. 8); en otro, la calidad del material citológico no permitió la tipificación. Fulciniti et al., justifica hasta un 88,8% de seguridad en este diagnóstico (20).
La presencia de estructuras papilares, psamomas o coloide homogéneo o las alteraciones nucleares características —hendiduras, perforaciones, inclusiones— permitiran el diagnóstico de Carcinoma Papilar (fig. 9), aunque excepcionalmente hayan sido descritas en lesiones benignas, tiroiditis o Adenomas y Carcinomas Foliculares (25,60). En el estudio del tejido tiroideo en intraoperatoria, estas alteraciones citológicas son particularmente útiles para el diagnóstico, junto a la observación histológica, en los carcinomas papilares.
La Galectina –3, junto con la Citoqueratina –19, (fig. 8) o Dipeptydil aminopeptidasa IV se revelan como marcadores específicos, junto con otros, de los Carcinomas Tiroideos (tabla 4) (6,11,13,29,35,54 ), aunque existe positividad en lesiones benignas como Tiroiditis linfocitaria (35,48), por lo que debe existir una correlación clínico-patológica adecuada en cada caso.
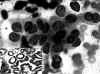
Fig. 8. PAAF
de Tiroides. Giemsa-QCA. x400. Proliferación folicular. Patrón laminar.
Núcleos apolillados o irregulares. Hay una pequeña inclusión intranuclear-no
se observó en el examen previo. Recuadro inferior. Tejido. x100. Citoqueratina
19 positiva. Carcinoma Papilar.
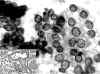
Fig. 9. PAAF
de Tiroides. Papanicolaou. x200. Patrón laminar con núcleos "claros"
y alguna indentación nuclear. Pequeños nucleolos. Recuadro inferior: Tejido.
HE. x100. Carcinoma Papilar de patrón folicular.
Tras los estudios actuales y de algunos autores (13) con inmunomarcadores histológicos, hasta un 60% de Adenomas Foliculares expresan posibilidades de ser malignos, por lo que desde el punto de vista citopatológico el diagnóstico de «Proliferación Folicular» en la PAAF, debe considerarse al menos como «indeterminado», benigno o neoplásico, hasta la comprobación anatomopatológica y con el diagnóstico añadido de «Sospecha» de malignidad en aquellos con criterios mas agresivos ya expuestos.
La tendencia a la dispersión celular, los rasgos plasmacitoides o la presencia de elementos celulares con patrón alargado o claramente fusiforme decantará hacia una neoplasia medular o permitirá la ejecución de Técnicas de —Cromogranina, Calcitonina— para su filiación (tabla 4), (fig. 10).
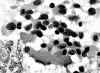
Fig. 10. PAAF
de Tiroides. Papanicolaou. x200. Células sueltas con aspecto polimorfo.
Binucleaciones. Núcleos de cromatina en "sal y pimienta". El material
homogéneo correspondía a amiloide. Recuadro inferior: Tejido x100. Calcitonina
positivo. Carcinoma Medular.
En definitiva, algunas delas lesiones sospechosas de malignidad en la PAAF serían susceptibles de estudio con los nuevos marcadores inmunohistoquímicos actuales.
Las células con cambios oncocíticos en los Adenomas ó Carcinomas pueden ser de tamaño y forma variables; se pensó que un mayor «monomorfismo» de la celularidad junto con mayor estratificación, iría mas a favor de malignidad (23,30,40); en nuestra experiencia con 9 Carcinomas y 23 Adenomas con cambios Oncocíticos no hubo diferencia significativa en el monormorfismo o las formas bizarras en las lesiones Adenomatosas o en los Carcinomas (fig. 11).

Fig. 11. PAAF
de Tiroides. Papanicolau. x200. Proliferación de células de Hürthle. Células
sueltas o en pequeños grupos laminares de carácter oncocítico. Correspondía
a un Carcinoma folicular.
En las neoplasias de células oncocíticas o de Hürthle, fueran benignas o malignas, el acierto en su identificación fué de 94% (30 de 32); sin embargo este porcentaje se redujo al 56% (5 de 9 Carcinomas Oncocíticos), si se consideraba la Sospecha de que fuera Carcinoma.
Nuestra experiencia con los Adenomas Trabeculares Hialinizantes se reflejan en un caso que se diagnosticó de Carcinoma Papilar (fig. 12); en otros casos, la sospecha diagnóstica es de Carcinoma Medular. Las alteraciones citológicas están bien descritas en el artículo de Goellner y Carney (27), con material hialino, inclusiones citoplasmáticas, núcleos irregulares, cromatina clara o apolillada y ocasionales inclusiones nucleares. En nuestro caso, el aspecto cromatínico y la disposición celular influyeron en el diagnóstico de Carcinoma Papilar. Las técnicas inmunocitoquímicas pueden ayudar al diagnóstico.
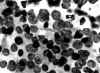
Fig. 12. PAAF
de Tiroides. Giemsa-QCA. x200. Proliferación folicular informada de Carcinoma
Papilar. Núcleos irregulares y de cromatina apolillada. Se insinuaban
inclusiones nucleares. En el tejido: Adenoma Trabecular Hialinizante.
Los estudios en relación con cambios genéticos en las neoplasias tiroideas,
muestran que en los Carcinomas Papilares hay frecuente reordenamiento del gen del Retinoblastoma —RET— en el 35% de la población general con este tumor y mayor en los expuestos a radiación (49). En los carcinomas Foliculares hay mutaciones puntuales en el gen RAS, (18% de los Adenomas y hasta el 53% en los Carcinomas Foliculares), con una fusión de genes de las porciones PAX8-PPAR gamma en los Carcinomas Foliculares más destacable, no existente en Carcinomas Papilares o en los Oncocíticos.
Tambien los carcinomas papilares sobreexpresan simultáneamente el protooncogen HGF (Factor de Crecimiento del Hepatocito) y su receptor HGF-R (c-met) y los Carcinomas Foliculares pierden este material genético con más facilidad que el Carcinoma Papilar en el brazo largo del cromosoma 7 (56).
En relación a los tumores de Células Oncocíticas (Hürthle), se ha observado mayor sobrexpresión del Factor E2F-1 que en otros tumores tiroideos (57).
En los Bocios con signos degenerativos o de larga evolución, puede ser frecuente la presencia de células atípicas o bizarras sueltas o en pequeños grupos y causa de falsa sospecha o falso diagnóstico de malignidad; es en el contexto del frotis citológico, en el que el coloide, el resto del epitelio folicular o la presencia de macrófagos hacen confirmar el origen reparativo-reactivo de tal celularidad anormal (15,34,40), (fig. 2).
En nuestros casos las 6 lesiones Proliferativas que fueron Tiroiditis Linfocitarias en la comprobación histopatológica mostraban en la PAAF un patrón común de estructuras foliculares mal definidas y presencia de cambios oncocíticos y escaso infiltrado inflamatorio crónico, lo que facilitó la falsa impresión de su carácter neoplásico (fig. 13). Algunos pacientes no vienen referidos con un historial clínico o analítico previo y ello influye en menor eficacia diagnóstica.

Fig. 13. PAAF
de Tiroides. Giemsa-QCA x200. Proliferación Folicular Oncocítica. No se
consideraron los escasos linfocitos presentes. En el tejido se trataba de una
Tiroiditis Linfocitaria Crónica con nódulos de células oncocíticas.
La falta de estudio clínico previo sirve tambien como explicación para los 6 casos de Hiperplasia Difusa Tiroidea en la comprobación histopatológica; la celularidad es «abundante» o muy abundante y si no se evidencian con claridad en los citoplasmas de las células foliculares las «vacuolas de extracción periféricas», es muy probable el sobrediagnóstico. La presencia de estas vacuolas periféricas ocasionales, no excluye la presencia de malignidad; incluso, la presencia de estas vacuolas ayuda a identificar lesiones metastásicas tiroideas, hasta el 57% en los casos referidos por Volansev et al. (58) y en un caso de experiencia personal en una metástasis vertebral (fig. 14), en un paciente con antecedentes de Carcinoma Folicular tiroideo.

Fig. 14. PAAF
de vértebra dorsal D-11. Giemsa-QCA x200. Aspecto epitelial y vacuolas
periféricas citoplasmáticas. Sugirió Metástasis de Carcinoma Folicular
Oncocítico. La Inmunocitotinción con Tiroglobulina fue positiva.
La Sensibilidad global para lesiones neoplásicas benignas ó malignas con este diagnóstico de Proliferación Folicular, fue de el 60%. Las cifras de Sensibilidad para el diagnóstico de Neoplasia benigna o maligna son muy variables, desde el 42% (2,4,19,24,26,28,50,51,52), hasta el 88%, cuando son sospechosas de malignidad (53).
CONCLUSIONES
El diagnóstico de «Proliferación-Neoplasia Folicular» debe limitarse a aquellas lesiones foliculares con:
1. Ausencia o muy escaso coloide. Fondo hemático.
2. Celularidad significativamente «aumentada»; más de 10 grupos foliculares con más de 6 a 10 células cada uno.
La PAAF sería «Sospechosa de malignidad» si tuviera los criterios citológicos descritos de mayor agresividad (sincitios, estratificación, nucleólos), que hicieran pensar en Carcinoma. Este diagnóstico debe de ser «prioritario» para la exéresis quirúrgica. En nuestros casos, globalmente, 26% fueron carcinomas y 68% de los casos con Sospecha de malignidad fueron carcinomas.
3. Un diagnóstico de Proliferación Folicular de agresividad «Indeterminada» será para aquellos casos con presencia de Coloide y celularidad aumentada con ausencia de caracteres de agresividad, considerándose a efectos quirúrgicos como «posible neoplasia» con tiempo de espera o seguimiento clínico adecuado antes de la exéresis.
4. No olvidar que hay Lesiones Benignas que pueden simular Proliferación-Neoplasia Folicular, destacando las Hiperplasias Difusas tiroideas y ocasionalmente las Tiroiditis (cuadro 1).
5. Las técnicas especiales: Inmunocitología, Microscopía Electrónica, pueden ayudar al diagnóstico precoz de neoplasias malignas tiroideas, en el material citológico de punción aspiración o en el de raspado-impronta quirúrgica de Intraoperatoria: Carcinomas Medulares o Papilares.
Agradecimientos:Al equipo médico colaborador en la realización de estas Punciones, Dres.: Claudio Ballestín Carcavilla, Alfredo Garzón Martín, Fernando López Ríos, Miguel Angel Martínez González y Jose Luis Rodríguez Peralto.
Al equipo ayudante y encargado de técnicas de laboratorio de citopatología, Sras.: Pilar Hernando Baraja, Julia Renero Agustín y Rosa García Martín, de Inmunocitoquímica.
BIBLIOGRAFÍA
De Agustín de Agustín PP, Pérez Barrios A, Hoyos sánchez M, Blázquez Elvira MP, Delgado del castillo JL: Diagnóstico citológico del nódulo frío tiroideo por punción aspiración con aguja fina. Patología 1985; Vol 18: 169-175.
Akerman M, Tennvall J, Björlund A, Martensson H and Möller T: Sensitivity and specificity of fine needle aspiration cytology in the diagnosis of tumors of the thyroid gland. Acta Cytol 1895; 29 (5): 850-855.
Atkinson B, Ernest CS, Li Volsi VA: Cytologic diagnosis of follicular tumors of the thyroid. Diagn Cytopathol 1986; 2: 1-3.
Baloch ZW, Fleisher S, Li Volsi VA, Gupta PK: Diagnosis of «Follicular neoplasm»: a gray zone in thyroid fine-needle aspiration cytology. Diagn Cytopathol, 2002; 26 (1): 41-44.
Barbaro D, Simi U, Lopane P, Pallini S, Orsini P, Piazza F et al.: Thyroid nodules with microfollicular findings reported on fine needle aspiration: invariably surgical treatment? Endocr Prct 2001; 7 (5): 352-357.
Bartolazzi A, Gasbarri A, Papotti M, Bussolati G, Lucante T, Khan A, et al. Thyroid Cancer Study Group: Application of an immunodiagnostic method for improving preoperative diagnosis of nodular thyroid lesions. Lancet 2001; 357 (9269): 1644-1650.
Bellido D, Aguirre M, Pérez Barrios A, de Agustín P, Rigopoulou D y Hawkins carranza F: Evaluación de la punción aspiración con aguja fina en el diagnóstico del Nódulo Tiroideo. Medicina Clínica 1985; 84 (7): 255-259.
Boon ME, Löwhagen T, Williams JS: Planimetric studies on fine needle aspirates from follicular adenoma and follicular carcinoma of the thyroid. Acta Cytol 1980; 24: 145-148.
Busseniers AE, Oertel YC: Cellular adenomatoid nodules of the thyroid: review of 219 fine needle aspirates. Diagn Cytopathol 1993; 9: 581-589.
Castro P, Sansonetty F, Soares P, Dias A, Sobrino-Simoes M: Fetal adenomas and minimally invasive follicular carcinomas of the thyroid frequently display a triploid or near triploid DNA pattern. Virchows Arch 2001; 438: 336-342.
Cheung CC, Ezzat S, Freeman JL, Rosen IB, Asa SL: Immunohistochemical diagnosis of papilaary thyroid carcinoma. Mod Pathol 2001; 14 (4): 338-342.
Cibas ES, Ducatman BS: Thyroid Gland. Cap 9. Follicular Lesions. In Cibas E S and Ducatman B S Ed., Cytology. Diagnostic Principles and Clinical Correlates., Philadelphia: W B Saunders, 1996. pp. 223-228.
Coli A, Bigotti G, Zucchetti F, Negro F, Massi G: Galectin-3 a marker of well differentiated thyroid carcinoma, is expressed in thyroid nodules with cytological atypia. Histopathology 2002; 40: 80-87.
Crissman JD, Drozdowicz S, Johnson C, et al: Fine needle aspiration diagnosis of hyperplastic and neoplastic follicular nodules of the thyroid. Annal Quant Cytol Histol 1991; 13: 321-328.
Droese M. In Cytological Aspiration Biopsy of the Thyroid Gland. F.K. Schattauer Verlag GmbH, Stuttgart-Germany, New York. Cap 13: Thyroid Tumors, 1980. p. 108-156.
Fadda G, Fiorino MC, Mulè A, Li Volsi VA: Macrofollicular encapsulated variant of papillary thyroid carcinoma as a potential pitfall in histologic and cytologic diagnosis. A report of three cases. Acta Cytol 2002; 46 (3): 555-560.
Ferrer-Roca O, Ballester Guardia E, Fernández Fernández E: Clasificación automática en Anatomía patológica. Experiencia en patología tiroidea y linfomas de alto grado de malignidad. Patología 1988; 21: 195-200.
Ferrer-Roca O, Ballester Guardia E, Martín Rodríguez JA: Morphometric, densitometric and flow cytometric criteria for the automated classification of thyroid lesions. Anal Quant Cytol Histol 1990; 12 (1): 48-55.
Frable W J and Frable M A: Fine-needle aspiration biopsy of the thyroid. Histopathologic and clinical correlations. Progress in Surgical Pathology 1980; Vol 1: 105-118.
Fulciniti F, Benincasa G, Vetrani A and Palombini L: Follicular variant of papillary carcinoma: cytologic findings on FNAB samples. Experience with 16 cases. Diagnostic Cytopathology 2001; 25 (2): 86-92.
Galera-Davidson H, Bibbo M, Bartels P H, Dytch H E, González Cámpora R, Wied GL, et al.: Differential diagnosis between follicular adenoma and follicular carcinoma of the thyroid by marker features. Anal Quant Cytol Histol 1986; 8 (3): 195-200.
Galera-Davidson H, Bartels PH, Fernández Rodríguez A, Dytch HE, Lerma-Puertas E, Bibbo M: Karyometric marker features in fine needle aspirates of invasive follicular carcinoma of the thyroid. Acta Cytol 1990; 12 (1): 35-41.
Galera-Davidson H and González Cámpora R. Thyroid. Cap 25: Follicular Neoplasia. In Bibbo M, ed. Comprehensive Cytopathology, Philadelphia: W B Saunders, 1997. pp. 656-659.
Giard RWM, Hermans J: Use and accuracy of fine needle aspiration cytology in histologically proven thyroid carcinoma. An audit using a National Pathology Database. Cancer Cytopathology 2000; 90 (6): 330-334.
Glant MD, Berger EK, Davey DD: Intranuclear cytoplasmic inclusions in aspirates of follicular neoplasms of the thyroid. A report of two cases. Acta Cytol 1984; 28 (5): 576-580.
Goellner JR, Gharib H, Grant CS, Johnson DA: Fine needle aspiration cytology of the thyroid, 1980 to 1986. Acta Cytol 1987; 31 (5): 587-590.
Goellner JR, Carney JA: Cytologic features of fine needle aspirates of hyalinizing trabecular adenoma of the thyroid. AJCP 1989; 91 (2): 115-119.
Goldstein RE, Netterville JL, Burkey B, Johnson J E : Implications of follicular neoplasms, atypia, and lesions suspicious of malignancy diagnosed by fine needle aspiration of thyroid nodules. Ann Surg 2002; 235 (5): 656-662.
González-Cámpora R, Galera-Ruiz D, Armas-Padrón JR, Otal-Salaverri C, Galera-Davidson H: Dipeptydil aminopeptidase IV in the cytologic diagnosis of thyroid carcinoma. Diagn Cytopathol 1998; 19 (1): 4-8.
González-Cámpora R, Herrero Zapatero A, Lerma Puertas E, Sánchez F, Galera-Davidson H: Hürthle cell and mitochondrion-rich cell tumors. A clinicopathologic study. Cancer 1986; 57 (6): 1154-1163.
Gray W, Mc Kee GT Eds.: Diagnostic Cytopathology. 2nd Ed. Cap. 23. Buley ID: The Thyroid Gland. 2002; pp. 587-591.
Greaves TS, Olvera M, Florentine BD, Raza AS, Cobb CJ, Tsao-Wei DD, Groshen S, Singer P, Lopresti J, Martin SE: Follicular lesions of thyroid. A 5-year fine-needle aspiration experience. Cancer Cytopathol 2000; 90 (6): 335-341.
Greenspan FS: The role of fine needle aspiration biopsy in the management of palpable thyroid nodules. AJCP (Suppl. 1) 1997; 108 (4): S26-S30.
Hawkins Carranza F, Bellido D, Bernal C, Rigopoulou D, Pérez Barrios A, De Agustín de Agustín PP, et al.: Fine needle aspiration biopsy in the diagnosis of thyroid cancer and thyroid disease. Cancer 1987; 59: 1206-1209.
Hirokawa M, Inagaki A and Sonoo H: Expession of Cytokeratin 19 in cytologic specimens of thyroid. Diagnostic Cytopathology 2000; 22 (3): 197-198.
Hsu C and Boey J: Diagnostic pitfalls in the fine needle aspiration of thyroid nodules. A study of 555 cases in Chinese patients. Acta Cytol 1987; 31 (6): 699-704.
Jarayam G: Fine needle aspiration cytologic study of the solitary thyroid nodule. Profile of 308 cases with histologic correlations. Acta Cytol 1985; 29 (6): 967-973.
Jorda M, González Cámpora R, Mora J, Herrero Zapatero A, Otal Salaverri C, Galera-Davidson H: Prognostic factors in follicular carcinoma of the thyroid. Arch Pathol Lab Med 1993; 117 (6): 631-635.
Johannessen JV, Sobrinho-Simoes M: Well differentiated thyroid tumors. Problems in Diagnosis and understanding. Pathol Ann 1983; Part I: 255-285.
Kini SR. En Tilde S Kline , editor. Guides to Clinical Aspiration Biopsy: Thyroid (2nd. Edition). New York: Igaku-Shoin; 1996. p. 59-127.
Kline TS: Handbook of Fine Needle Aspiration Biopsy Cytology. St Louis: Mosby, 1981.
López Guzmán A, Aramendi T, Alvarez Escolá C, Andía VM, Arranz A. Resultados histológicos en los casos de citología tioridea sospechosa de malignidad. Medicina Clínica 2000; 14-17.
Löwhagen T, Willems JS, Lundell G, Sundblad R and Granberg P-O: Aspiration biopsy cytology in diagnosis of thyroid cancer. World J Surg 1981; 5: 61-73.
Löwhagen T, Willems JS: Aspiration biopsy cytology in diseases of the thyroid. Advances in Clinical Cytology, Koss L G and Coleman DV Eds. 1981; Vol1: 201-231.
Martin HE and Ellis EB: Aspiration biopsy. Surg Gynecol Obstet, 1934; 59: 578-589.
Martínez Parra D, Campos Fernández J, Cinta Hierro-Guilmain C, Sola Pérez J, Pérez Guillermo M: Follicular variant of papillary carcinoma of the thyroid: To what extent is fine needle aspiration reliable? Diagn Cytopathol 1996; 15 (1): 12-16.
Montironi R, Braccischi A, Scarpelli M, Sisti S and Alberti R: Well differentiated follicular neoplasms of the thyroid: reproducibility and validity of a «decision tree» classification based on nucleolar and kariometric features. Cytopathology 1992, 3: 209-222.
Niedziela M, Maceluch J, Korman E: Galectin-3 is not an universal marker of malignancy in thyroid nodular disease in children and adolescents. J Clin Endocrinol Metab 2002; 87 (9): 4411-4412.
Nikiforova MN, Biddinger PW, Caudill ChM, Kroll TG, Nikiforov YE: PAX8-PPARgamma rearrangement in thyroid tumors. RT-PCR and immunohistochemical analyses. Am J Surg Pathol 2002; 26 (8): 1016-1023.
Oertel YC, Burman K, Boyle L, Ringel M, Wartofsky L, Van Nostrand D, et al.: Integrating fine-needle aspiration into a daily practice involving thyroid disorders: The Washington Hospital Center approach. Diagn Cytopathol 2002; 27 (2): 120-122.
Poller DN, Ibrahim AK, Cummings MH, Mikel JJ, Boote D, Perry M: Fine-needle aspiration of the thyroid. Importance of an indeterminate diagnostic category. Cancer Cytopathol 2000; 90 (4): 239-244.
Raber W, Kaserer K, Niederle B, Vierhapper H: Risk factors for malignancy of thyroid nodules initially identified as follicular neoplasia by fine needle aspiration: results of a prospective study of one hundred twenty patients. Thyroid 2000; 10 (8): 709-712.
Rensaw A: Interinstitutional review of thyroid fine-needle aspirations. Diagn Cytopathol 2002; 27 (2): 128-130.
Saggiorato E, Cappia S, De Giuli P, Mussa A, Pancani G, Caraci P, et al.: Galectin-3 as a presurgical immunocytodiagnostic marker of minimally invasive follicular thyroid carcinoma. J Clin Endocrinol Metab 2001; 86 (11): 5152-5158.
Suen KC: How does one separate cellular follicular lesions of the thyroid by FNA’s? Diagn Cytopathol 1987; 4: 78-81.
Trovato M, Fraggetta F, Villari D, Batolo D, Mackey K, Trimarchi F, Benvenga S: Loss of heterozygosity of the long arm of chromosome 7 in follicular and anaplastic thyroid cancer, but not in papillary thyroid cancer. J Clin Endocrinol Metab 1999; 84 (9): 3235-3240.
Volante M, Croce S, Pecchioni C, Papotti M: E2F-1 Transcription factor is overexpressed in oxyphilic thyroid tumors. Mod Pathol 2002; 15 (10): 1038-1043.
Volavsek M, Us-Krasovec M, Auersperg M, Hocevar M, Golouh R : Marginal vacuoles in fine needle aspirates of follicular thyroid carcinoma. Diagn Cytopathol 1996; 15 (2): 93-97.
Zajicek J. En George L Wied, editor, Chicago, Illinois. In Monographs in clinical cytology: Aspiration Biopsy Cytology. Part I , Cytology of Supradiaphragmatic Organs. T. Löwhagen: Thyroid. S. Karger-Basel. New York, 1969. p. 67-89.
Zirkin HJ: Follicular adenoma of the thyroid with intranuclear vacuoles and clear nuclei. A case report. Acta Cytol 1984; 28 (5): 587-592.