
Vol. 36, n.º 1, 2003
REVISTA
ESPAÑOLA DE
Vol. 36, n.º 1, 2003 |
Mercedes Santamaría Martínez, Ana Bertol Usoz, Irene Amat Villegas, Raquel Beloqui Pérez
Servicio de Anatomía Patológica. Hospital de Navarra. Pamplona.
RESUMEN
Introducción: Los tumores del estroma gastrointestinal (GIST) son tumores mesenquimales frecuentes que se originan en las células intersticiales de Cajal (CIC). Se localizan en la pared del tubo digestivo y afectan con poca frecuencia a la mucosa por lo que es difícil que sean detectados por biopsia endoscópica. En ocasiones el diagnóstico preoperatorio se puede hacer por PAAF (punción aspiración con aguja fina). Histológicamente es difícil predecir su comportamiento biológico. Nuestro propósito es el de valorar la eficacia de la impronta peroperatoria para el diagnóstico. Material y métodos. Hemos revisado citología de impronta peroperatoria de 11 pacientes que no tenían diagnóstico previo de GIST. Resultados. Los hallazgos citológicos dependen del tipo histológico del tumor y de la morfología celular. En general, las características citológicas son superponibles a las descritas en material de punción aspiración. Conclusiones. Mediante la citología por impronta es posible reconocer las características celulares y orientar el diagnóstico. Esta información puede ser útil para el manejo del paciente en el acto quirúrgico y para las indicaciones ulteriores de los estudios inmunohistoquímico y genético.
Palabras clave: GIST, impronta peroperatoria, citología.
SUMMARY
Introduction: Gastrointestinal stromal tumors (GIST) are frequent mesenchymal tumors originating from Cajal interstitial cells (CIC). They are localized in the digestive tract wall but do not usually involve the mucosa and therefore can be difficult to detect by endoscopic biopsy. A preoperative diagnosis can sometimes be made on the basis of fine needle aspiration (FNA) biopsy. In most of cases, even from histology it is difficult to predict their clinical behavior. Our aim is to evaluate the utility of intraoperative imprint material in diagnosis. Materials and methods: We review intraoperative imprint cytology from 11 patients without a preoperative GIST diagnosis. Results: Cytological findings depended on histological subtype and on their cellular morphology. In general, cytologic features from imprints were similar to those found in FNA material. Conclusions: By imprint cytology, it is possible to recognize cellular characteristics of GIST and thereby narrow down the diagnosis. This information can be useful for intraoperative management of the patient and establish the necessity to perform subsequent immunohistochemical and genetic studies.
Key words: GIST, intraoperative imprint, cytology.
INTRODUCCIÓN
Los tumores del estroma gastrointestinal (GIST) son los tumores mesenquimales más frecuentes en esta localización y comprenden un espectro de tumores que incluyen variantes benignas y malignas. Basados en la histología y tamaño del tumor es difícil predecir su potencial maligno (8,18). Se caracterizan por presentar un inmunofenotipo con expresión positiva para c-kit (antígeno CD-117) y CD-34 así como un perfil genético característico, que permite su diferenciación de otros tumores mesenquimales del tracto gastrointestinal (6,17,20). Se originan probablemente en las células intersticiales de Cajal (CIC) que se desarrollan en el mesénquima gastrointestinal y regulan la motilidad por impulso espontáneo, controlan el peristaltismo y la contracción muscular y son mediadoras en la neurotransmisión (13).
La mayor parte de los GIST se desarrollan en la pared del tubo digestivo y no suelen afectar a la mucosa, por lo que las posibilidades de obtener un material adecuado para el diagnóstico preoperatorio por biopsias endoscópicas está muy limitado (4). En los últimos años se ha utilizado como medio de obtención de material la punción aspiración (1,3,5,10,15,21,23).
En general el diagnóstico está basado en las biopsias quirúrgicas o laparoscópicas y frecuentemente no se consigue un diagnóstico preoperatorio. Nuestro propósito, en los casos en los que no hemos obtenido material de punción aspiración bajo control endoscópico o radiológico, es el de aproximarnos al diagnóstico mediante el estudio del material obtenido por impronta intraoperatoria.
MATERIAL Y MÉTODOS
Hemos revisado el material de impronta intraoperatoria de 11 pacientes de los archivos del Hospital de Navarra, recogidos en los últimos 5 años. En nueve de ellos no se había conseguido diagnóstico preoperatorio porque no se había hecho ni punción aspiración ni biopsia previa, y dos eran casos en los que el hallazgo del tumor fue accidental en el transcurso de una laparotomía por otra causa.
Seis pacientes eran varones y cinco mujeres. La edad estaba comprendida entre los 53 y 79 años con una media de 66 años. En siete de los pacientes la localización del tumor fue en estómago y sus tamaños oscilaron entre 0,5 y 12 cm. Uno era de localización en intestino delgado con un tamaño de 1 cm y otro en colon, que medía 0,4 cm. En los dos casos restantes el material citológico se tomó de metástasis en hígado y en pelvis, cuyos tamaños fueron respectivamente de 5 y 4 cm.
Un caso recidivó localmente en pelvis, seis casos no presentaron recidiva en el periodo de tiempo estudiado (4 años) y de cuatro pacientes no ha sido posible el seguimiento clínico. Cinco casos desarrollaron metástasis en hígado y peritoneo. Dos de los casos con tumor menor de 1cm fueron hallazgos casuales en intervenciones quirúrgicas por carcinoma de estómago y colon respectivamente (tabla 1).
En todos los casos se realizó impronta del tejido fresco en cuatro frotis. Dos se dejaron secar al aire y se tiñeron con MGG y otros dos se fijaron de forma inmediata en alcohol éter al 50% y se tiñeron con Papanicolaou modificado.
Se hizo correlación histológica en biopsia intraoperatoria y en material histopatológico incluido en parafina con tinción rutinaria y con el estudio inmunohistoquímico posterior en el material histológico en los que se realizó Vimentina (Biogenex 1/100), S-100 (DAKO 1/250), Actina (BioGenex 1/100), Enolasa (BioGenex, prediluído), CD-34 (BioGenex, prediluído) y CD-117 (DAKO, 1/50) (tabla 2).

RESULTADOS
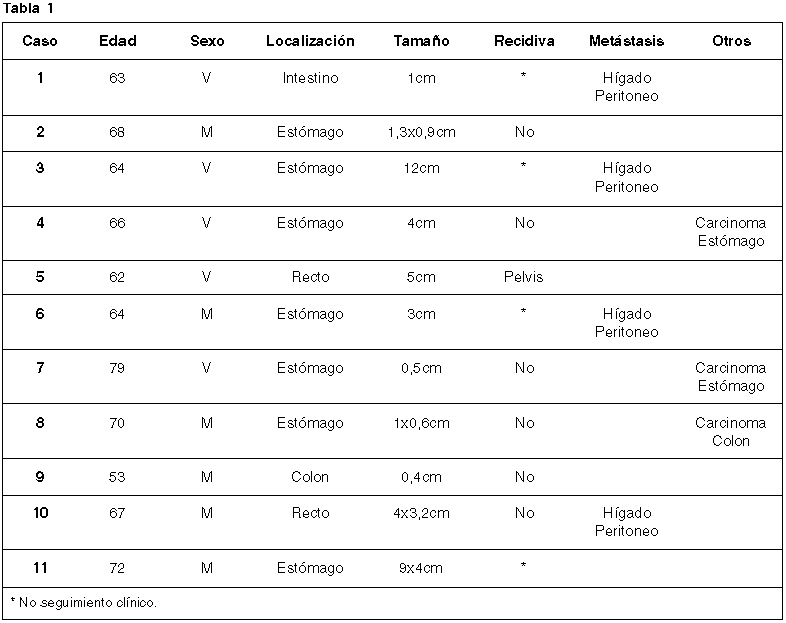
Hallazgos citológicos: Fueron variables dependiendo de la morfología del tumor y del predominio fusocelular o de células redondas o epitelioides. Las extensiones presentaban una diátesis hemorrágica y serosa con aislados polimorfonucleares, linfocitos, algunos restos celulares y fibrina. La celularidad era moderada, con marcada tendencia a la disgregación. En su mayor parte correspondían a células aisladas, en general mal conservadas, con frecuente pérdida del citoplasma. Cuando el citoplasma estaba presente era ligeramente basófilo y de límites imprecisos (fig. 1). Los núcleos, frecuentemente desnudos, eran alargados, con extremos romos, y con frecuencia presentaban dilataciones globulosas lo que les confería un aspecto amorcillado (fig. 2). A veces aparecían torsionados, con forma de coma o habichuela y con ocasionales indentaciones en la membrana nuclear (fig. 3). La cromatina era en general fina y uniformemente distribuida, sin que se apreciasen apenas nucléolos. Se entremezclaban con pequeños fragmentos de estroma acelular, de coloración basófila con Papanicolaou o metacromática con MGG o también con un escaso número de nú cleos.
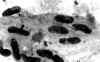
Fig. 1. Tendencia
a la disgregación celular y pérdida de los límites citoplasmáticos (MGG.
1000x).
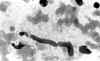
Fig. 2. Núcleos alargados de extremos
romos con dilataciones globulosas (MGG. 1000x).

Fig. 3. Núcleos con forma de habichuela
con indentaciones en la membrana nuclear (MGG. 1000x).
Cuando las células se presentaban en acúmulos se observaba una superposición de núcleos que no conservaban una estructura definida. Solamente de forma ocasional encontramos pequeños fragmentos de tejido con aspecto sincitial en los que los núcleos presentaban disposición ordenada o en empalizada. En estos fragmentos se distinguían a veces los límites citoplasmáticos (fig. 4). No observamos estructuras capilares.
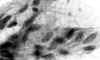
Fig. 4. Fragmento de aspecto sincitial con
límites citoplasmáticos visibles (Papanicolaou 1000x).
Solamente en un caso obtuvimos células de apariencia epitelioide. Los núcleos eran más redondeados u ovalados y en general de menor tamaño que en los de las células fusocelulares. A veces presentaban entrantes en el contorno nuclear e incluso adoptaban forma arriñonada. Ocasionalmente eran binucleadas. Podían apreciarse pequeños nucléolos. El citoplasma, cuando estaba conservado, era de aspecto claro y en algunas células aisladas era más denso y basófilo. Ocasionalmente se encontraban pequeñas vacuolas de tamaño uniforme que ocupaban toda la célula (fig. 5). Existían vacuolas citoplasmáticas muy aisladas. En las improntas no hemos observado figuras de mitosis. Dos casos presentaron un patrón celular mixto.
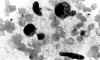
Fig. 5. Células de aspecto epitelioide
redondeadas con citoplasma conservado y pequeñas vacuolas citoplasmáticas (MGG
1000x).
Histológicamente, la mayor parte de los tumores eran del tipo fusocelular con células dispuestas en fascículos, con citoplasma pálido y a veces de aspecto fibrilar (fig. 6). El núcleo era ovoide, con cromatina vesicular. Las vacuolas citoplasmáticas eran poco frecuentes. En el tipo epiteliode, las células presentaban tendencia a disponerse en nidos. Eran células redondeadas con citoplasma eosinófilo y frecuentemente mostraban una zona perinuclear clara, con aspecto de haber sido originada por retracción nuclear.

Fig. 6. Corte histológico de tumor GIST
fusocelular (H-E. 600x).
Inmunocitoquímica: Durante los años en que se ha realizado este estudio se han empleado diferentes anticuerpos que dependían de las posibilidades de cada momento por lo que los resultados son variables y no concluyentes. La actina fue negativa en todos los casos. El CD-34 y el CD-117 fueron positivos (tabla 2).
DISCUSIÓN
Los tumores GIST se localizan con más frecuencia a lo largo de toda la pared abdominal desde esófago a recto. Debido a su localización extramucosa, las biopsias endoscópicas pueden resultar en muchos casos insuficientes para el diagnóstico, por lo que en muchos casos no es posible efectuar un diagnóstico preoperatorio (7). En la mayor parte de los trabajos publicados el diagnóstico de realiza por punción-aspiración (1,3-5,7,10,15,21,23) o por biopsia laparoscópica. La descripción citológica de los GIST está ya documentada en material obtenido por punción aspiración (1,2,4,7,9,11,16,17).
Los tipos citológicos descritos en GISTs son con mayor frecuencia los que corresponden a células de tipo fusocelular y en menor proporción a células de tipo epitelioide o epitelial. Las características citológicas que se obtienen en material de impronta intraoperatoria son semejantes a las descritas en el material de punción aspiración (4,7,15,17). Es interesante resaltar la pérdida de adhesividad de las células, que con frecuencia se observan aisladas y también los escasos fragmentos de estroma, densos y tridimensionales, que se obtienen en el material de punción-aspiración. No es frecuente que se encuentren células ordenadas o en empalizada ni tampoco estructuras capilares al contrario de lo que ocurre en el material de punción-aspiración.
En base a las atipias citológicas, no parece posible distinguir entre tumores benignos y malignos en parte porque los criterios de malignidad no están claros y porque su morfología se superpone a la de otras neoplasias fusocelulares o epitelioides del tracto gastrointestinal (16,19). Debido a su localización y morfología, el diagnóstico diferencial se plantea con todo tipo de neoplasias abdominales entre las que cabe considerar las neoplasias epiteliales primarias o secundarias, linfomas y tumores carcinoides. Sin embargo por la apariencia mesenquimal de las células, se puede en la mayoría de los casos, excluir estas neoplasias (21). La distinción entre GIST y otros tumores de células fusiformes de origen neurogénico o muscular no es posible por la citología y requiere estudio inmunocitoquímico (16,21). Mediante la evaluación citológica tampoco es posible predecir la agresividad del tumor, que queda reservada a la histología (7,16), la inmunohistoquímica y al estudio genético.
Las metástasis en hígado son relativamente frecuentes, sobre todo en los casos en que el tumor es de gran tamaño y en los casos en los que se evidencian atipias (17). En estos casos, cuando se realiza un estudio tanto de citología por punción, como por impronta o histológico de las lesiones hepáticas, el diagnóstico diferencial debe ser amplio y debe incluir a otros tumores de células fusiformes tales como leiomiosarcoma, fibrosarcoma, sarcoma neurogénico, histiocitoma fibroso maligno, sarcoma indiferenciado y carcinoma hepatocelular sarcomatoide.
Desde el punto de vista histológico se han descritos algunos criterios que favorecen la malignidad, como son: tamaño de la lesión mayor de 5 cm y una tasa de mitosis superior a 5 ¥ 50 campos de gran aumento (6,9,17). Otros parámetros pueden ser la presencia de necrosis, áreas de hemorragia, marcada hipercelularidad y atipias nucleares. El pronóstico varía también según el lugar de origen.
El inmunofenotipo de estos tumores es bastante característico: expresan c-kit (CD-117) en 81 a 94% (3,12,17,22) y CD-34 (70-80%), porcentajes que son variables según las series estudiadas. La actina es (–), aunque puede ser (+) en algunas ocasiones (20). La desmina y la proteína S-100 son negativas (19). Estas características inmunocitoquímicas ayudan a hacer el diagnóstico diferencial con leiomiomas, leiomiosarcomas y schwanomas ya que cuando existe la diferenciación a músculo liso la desmina y actina muestran positividad (14) y cuando hay diferenciación neural se puede encontrar positividad para S-100 y para otros marcadores como GFAP, NSE, NF, y sinaptofisina.
Algunos autores indican que es posible el diagnóstico de tumor GIST en material de punción aspiración cuando se realiza sobre él estudio inmunohistoquímico y genético (16,19). En nuestros casos el estudio no se realizó sobre el material de impronta sino sobre las piezas quirúrgicas de las que se realizaron las improntas.
Por su parte, uno de los marcadores característicos de estos tumores, el CD-34, no es muy específico. Es un antígeno progenitor de la célula mieloide y se expresa también en el endotelio, en neoplasias vasculares y en algunas células mesenquimales y neoplásicas (21).
El c-kit (CD-117) muestra también expresión, además de en los GISTs, en mastocitos y médula ósea, tumores de células germinales y melanocíticos y en carcinoma de mama y ovario (20). Además puede presentar una tinción débil o focal en otros tumores extragastrointestinales como fibrosarcoma, carcinoma de células fusiformes, leiomiosarcoma, histiocitoma fibroso maligno, rabdomiosarcoma y otros sarcomas.
El gen c-kit (CD-117) se encuentra localizado en el cromosoma 4q 1.2. y es codificador de una proteína transmembrana que pertenece a la familia de la tiroxina-kinasa. Esta proteína está ligada a un factor de crecimiento (stem cell factor) que está implicado en la supervivencia celular, proliferación y diferenciación. Las alteraciones genéticas del c-kit son muy heterogéneas, corresponden a ganancias, mutaciones (12,14), delecciones en el exon 11(codones 550 a 560) y menos frecuentemente a delecciones en los exones 9, 13 y 17.
Aproximadamente un 10% de los GIST muestran comportamiento maligno (16,17,20). En general los GISTs benignos no presentan alteraciones genéticas, mientras que si se encuentran en los GISTs con comportamiento maligno (14), que se manifiestan por extensión o infiltración a peritoneo o metástasis frecuentes a hígado y/o pulmón. Como consecuencia, en estos hay una menor supervivencia y mayor mortalidad (12,16,22). En algunos GISTs malignos no se han detectado alteraciones genéticas (14,16).
Lasota J et al (14) describen que existe una relación entre la expresión de c-kit y las mutaciones y que hay a su vez relación entre las mutaciones y la malignidad e indican una posible especificidad de las mutaciones.
El pronóstico de estos tumores depende de factores que se interrelacionan entre sí, como son la edad, la presencia de metástasis peritoneales o hepáticas (17), las características histológicas ya mencionadas y de un modo especial el tamaño del tumor y el número de mitosis, el inmunofenotipo, la ploidía y las mutaciones genéticas (2,15,17,19,20). A pesar de la relación entre las alteraciones genéticas y el comportamiento maligno de los tumores, no se excluye la posibilidad de que existan otros factores no conocidos hasta el presente.
En conclusión, mediante el estudio por impronta intraoperatoria de los GIST, podemos citológicamente llegar a reconocer y orientar el diagnóstico. Esto permite, en la mayor parte de los casos, estén o no asociados a otras patologías, adoptar un comportamiento quirúrgico adecuado. Además, los hallazgos citológicos nos permitirán sentar la indicación para realizar los estudios inmunocitoquímicos y genéticos necesarios para el correcto manejo y tratamiento en los pacientes con tumores GIST.
BIBLIOGRAFÍA
Ando N, Goto H, Niwa Y, Hirooka Y, Ohmiya N, Nagasaka T, Hayakawa T. The diagnosis of GI stromal tumors with EUS-guided fine needle aspiration with immunohistochemical analysis. Gastrointest Endosc 2002; 55: 37-43.
Boggino HE, Fernandez MP, Logroño R. Cytomorphology of gastrointestinal stromal tumor: diagnostic role of aspiration cytology, core biopsy and immunochemistry. Diagn Cytopathol 2000; 23: 156-60.
Cheuk W, Lee KC, Chan JK. c-kit immunocytochemical staining in the cytologic diagnosis of metastatic gastrointestinal stromal tumor. A report of two cases. Acta Cytol 2000; 44: 679-85.
Das DK, Pant CS. Fine needle aspiration cytologic diagnosis of gastrointestinal tract lesions. A study of 78 cases. Acta Cytol 1994; 38: 723-9.
Debol SM, Stanley MW, Mallery JS. Can fine needle aspiration cytology adequately diagnose and predict the behaviour of gastrointestinal stromal tumors? Adv Anat Pathol 2001; 8: 93-7.
Dematteo RP, Heinrich MC, El-Rifal WM, Demetri G. Clinical management of gastrointestinal stromal tumors: before and after STI-571. Hum Pathol 2002; 33: 466-77.
Dodd LG, Nelson RC, Mooney EE, Gottfried M: Fine-needle aspiration of gastrointestinal tumors. Am J Clin Pathol 1998; 109: 439-43.
Ernst SI, Hubbs AE, Przygodzki RM, Emory TS, Sobin LH, O’Leary TJ. KIT mutation portends poor diagnosis in gastrointestinal stromal/smooth muscle tumors. Lab Invest 1998; 78: 1633-6.
Fletcher CDM, Berman JJ, Corless C, Gorstein F, Lasota J, Longley BJ, Miettinen M, O’Leary TJ, Remotti H, Rubin BP, Shmookler B, Sobin LH, Weiss SW. Diagnosis of gastrointestinal stromal tumors: a consensus approach. Hum Pathol 2002; 343: 459-465.
Gu M, Ghafari S, Nguyen PT, Lin F. Cytologic diagnosis of gastrointestinal stromal tumors of the stomach by endoscopic ultrasound-guided fine-needle aspiration biopsy: cytomorphologic and immunohistochemical study of 12 cases. Diagn Cytopathol 2001; 25: 343-50.
Heinrich MC, Rubin BP, Longley BJ, Fletcher JA. Biology and genetic aspects of gastrointestinal stromal tumors: KIT activation and cytogenetic alterations. Hum Pathol. 2002; 33: 484-495.
Hirota S, Isozaki K, Moriyama Y, Hashimoto K, Nishida T, Ishiguro S, et al. Gain-of-function mutations of KIT in human gastrointestinal stromal tumors. Science 1998; 279: 577-580.
Kindblom LG, Remotti HE, Aldenborg F, Meis-Kindblom JM. Gastrointestinal pacemaker cell tumor (GIPACT): gastrointestinal stromal tumors show phenotypic characteristics of the interstitial cells of Cajal. Am J Pathol 1998; 152: 1259-69.
Lasota J, Jasinski M, Salormo-Rikala M, Miettinen M. Mutations in exon 11 of c-Kit occur preferentially in malignant versus benign gastrointestinal stromal tumors and do not occur in leiomyomas or leiomyosarcomas. Am J Pathol 1999; 154: 53-60.
Li P, Wei J, West AB, Perle M, Greco MA, Yang GC. Epithelioid gastrointestinal stromal tumor of the stomach with liver metastases in a 12-year-old girl: aspiration cytology and molecular study. Pediatr Dev Pathol 2002; 5: 386-94.
Li SQ, O’Leary TJ, Sobin LH, Erozan YS, Rosenthal DL, Przygodzki RM. Analysis of KIT mutation and protein expression in fine needle aspirates of gastrointestinal stromal/smooth muscle tumors. Acta Cytol 2000; 44: 981-6.
Miettinen M, El-Rifal W, Sobin LH, Lasota J. Evaluation of malignancy and prognosis of gastrointestinal stromal tumors: a review. Hum Pathol 2002; 33: 478-83.
O’Leary T, Berman JJ. Gastrointestinal stromal tumors: answers and questions. Hum Pathol, 2002; 33: 456-8.
Rader AE, Avery A, Wait CL, McGreevey LS, Faigel D, Heinrich MC. Fine-needle aspiration biopsy diagnosis of gastrointestinal stromal tumors using morphology, immunocytocheminstry and mutational analysis of c-kit. Cancer 2001; 93: 269-75.
Salormo-Rikala M, Kovatich AJ, Barusevicius A, Miettinen M. CD117: a sensitive marker for gastrointestinal stromal tumors that is more specific than CD34: Mod Pathol 1998; 111: 7228-34.
Seidal T, Edvardsson H. Diagnosis of gastrointestinal stromal tumor by fine-needle aspiration biopsy: a cytological and immunocytochemical study. Diagn Cytopathol 2000; 23: 397-401.
Taniguchi M, Nishida T, Hirota S, Isozaki K, Ito T, Nomura T, Matsuda H, Kitamura Y. Effect of c-kit mutation on prognosis of gastrointestinal stromal tumors. Cancer Res 1999; 59: 4297-300.
Wieczorek TJ, Faquin WC, Ribin BP, Cibas ES. Cytologic diagnosis of gastrointestinal tumor with emphasis on the differential diagnosis with leiomyosarcoma. Cancer 2001; 25: 276-87.