
Vol. 36, n.º 1, 2003
REVISTA
ESPAÑOLA DE
Vol. 36, n.º 1, 2003 |
Lourdes Porras1, Marcial García Rojo2, Sergio Rodríguez1, Jesús González García2, Helíades Portillo1, Manuel Carbajo Vicente2
Complejo Hospitalario de Ciudad Real, 11 de diciembre de 2001. 1Servicio de Medicina Interna. 2Servicio de Anatomía Patológica.
DATOS CLÍNICOS
Dra. Porras: Presentamos el caso de un varón de 72 años, diagnosticado a los 48 años de diabetes mellitus tipo 2 en tratamiento con insulina y con retinopatía y disautonomía diabética. También estaba diagnosticado de hipotiroidismo autoinmune y en los últimos meses distimia. Había tenido múltiples ingresos por descompensaciones diabéticas (cetoacidosis e hipoglucemias).
Ingresó en abril de 2001 con un cuadro de síndrome constitucional con clínica respiratoria y fiebre. En la exploración física destacaban, en aparato respiratorio, crepitantes secos en hemitórax derecho. En la analítica tenía aumento de VSG, fibrinógeno y PCR, e hipergammaglobulinemia policlonal. Anticuerpos ANA y anti-DNA negativos. El estudio de bacilos ácido-alcohol resistentes (BAAR) en esputo dio resultado negativo. Los marcadores tumorales mostraban CA19.9 de 426,8 U/mi (< 37 U/ml) y CEA de 12,8 U/mi (<5 U/ml). En las pruebas de imagen se objetivó en la radiografía de tórax y en el TAC toracoabdominal (fig. 1) un patrón alvéolo-intersticial de predominio en lóbulos posteriores, principalmente en pulmón derecho. Dentro del estudio por síndrome constitucional se realizó una ecografía abdominal, enema opaco y gastroscopia que fueron normales.
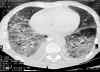
Fig. 1. TAC
torácico. Patrón intersticial pulmonar.
Fue dado de alta con seguimiento ambulatorio por la sospecha de un proceso tumoral no filiado tanto por la clínica de ingreso como por los resultados analíticos de los marcadores tumorales.
Reingresó en agosto de 2001 por una hipoglucemia con pérdida de conocimiento, desarrollando en 24 horas una insuficiencia respiratoria aguda (pH 7,23; pCO2 44 mmHg; pO2 36 mmHg; saturación O2 66,6%) que precisó ingreso en UCI con ventilación mecánica. En la radiografía de tórax mostraba un patrón alveolointersticial bilateral, con afectación mayoritaria en bases y campo medio derecho y se diagnostica y trata como edema agudo de pulmón de predominio derecho por sobrecarga de líquidos.
A su salida a planta seguía con insuficiencia respiratoria, síndrome febril y en la placa de tórax persistían los mismos infiltrados pulmonares. Por ello ante la sospecha de neumonía por aspiración en un paciente con pérdida de conocimiento, se instauró tratamiento con antibióticos de amplio espectro. Destacaba en la analítica leucocitosis con desviación izquierda, anemia normocítica normocrómica, aumento importante de reactantes de fase aguda y de LDH. En la orina elemental presentaba proteinuria no cuantificada y hematuria de 15-20 leucocitos/campo. Los hemocultivos fueron repetidamente negativos; BAAR en orina y esputo negativo; serología VHC, VHB, CMV, VIH, Legionella, Fiebre Q, Mycoplasma y Clamydias negativos; infección por Virus de Epstein-Barr pasada. Un nuevo estudio analítico inmunológico fue también negativo. La enzima convertidora de angiotensina estaba dentro del rango de la normalidad. Los marcadores tumorales CEA 9,5 U/ml y CA19.9 106,5 U/ml. Como persistía la insuficiencia respiratoria y ante los antecedentes de posible fibrosis pulmonar, se añadió al tratamiento corticoides a dosis de 1 mg/Kg peso y antibióticos antipseudomonas. El enfermo seguía con igual sintomatología de insuficiencia respiratoria y fiebre y se realizó una broncoscopia donde se observó en los árboles bronquiales y bronquios segmentarios de las bases, pequeños nódulos blanquecinos de mucosas con citología negativa. La biopsia transbronquial fue no representativa. Dada la situación clínica del enfermo sólo se pudo realizar un BAS cuyo cultivo y citología fueron negativos para gérmenes y células tumorales. Se realizó un nuevo TAC toracoabdominal donde se observó a nivel pulmonar un patrón reticular intersticial difuso con un engrosamiento interlobulillar, más marcado en los segmentos posteriores y un patrón en vidrio deslustrado de predominio derecho con derrame pleural bilateral (fig. 2). Como comenzó con dificultades para la deglución se hizo una gastroscopia, que se informó de candidiasis esofágica.
Fig. 2. Patrón en vidrio esmerilado de
predominio derecho.
El paciente seguía sin mejoría clínica ni radiológica, por lo que se añadió al tratamiento tuberculostáticos y antifúngicos de manera escalonada, pero a pesar de todo falleció por parada respiratoria.
En resumen, se trata de un paciente diabético de larga evolución, con afectación macro y microvascular por la diabetes y patología respiratoria no filiada. Se objetivaron unos marcadores tumorales elevados sin encontrar tumor primario. Ingresó por hipoglucemia e hizo un cuadro inflamatorio versus infeccioso de predominio respiratorio, que no respondió al tratamiento instaurado, a pesar de haber considerado que era un enfermo inmunodeprimido por su diabetes, su ingreso en UCI y por tratamiento corticoideo agresivo. Al final, fallece sin que se pudiera llegar a una conclusión diagnóstica con la batería de pruebas realizadas.
DICUSIÓN
Dr. Portillo (moderador): Como clínico responsable del paciente, ¿cuáles fueron los diagnósticos diferenciales que consideró como causa de los infiltrados pulmonares?
Dr. Rodríguez (internista): El planteamiento diagnóstico fue variando a lo largo de la evolución del paciente.
El primer día de ingreso en planta, presentaba un infiltrado alveolo-intersticial de predominio en hemitórax derecho, que dados los antecedentes de deterioro del nivel de conciencia y vómitos, nos sugería aspiración que le provocaba intensa disnea y taquipnea con fiebre. Se trató con antibióticos de amplio espectro con cobertura para anaerobios y evolucionó con mejoría parcial de los síntomas.
Con los hallazgos de TAC y revisando la historia clínica, nos encontramos que el paciente presentaba posiblemente una fibrosis pulmonar de predominio en hemitórax derecho. Por empeoramiento de la disnea y con la sospecha de actividad de dicho proceso fibrótico, se añaden corticoides.
A pesar de todo lo anterior, el paciente, presenta fiebre de nuevo con reaparición de los infiltrados alveolo-intersticiales bilaterales afectando a bases y campos medios con insuficiencia respiratoria severa.
En esta situación nos planteamos que sobre la patología pulmonar previa, la inmunodepresión y el CA19.9 elevado, se añade otra entidad responsable del agravamiento clínico. Los diagnósticos que se barajaron en este paciente fueron: procesos infecciosos (reactivación de tuberculosis, sobreinfección por hongos, Legionella, Pseudomona, etc.), neoplasias pulmonares -y entre ellas el carcinoma bronquioloalveolar-, vasculitis sistémicas con afectación pulmonar y la bronquiolitis obliterante con neumonía organizativa.
Dr. De la Torre (nefrólogo): Dado el cuadro de anemia, hematuria y proteinuria ¿se ha valorado la posibilidad de hemorragia pulmonar como causa de los infiltrados?
Dra. Porras: Cabe pensar en una enfermedad autoinmune como causa del proceso crónico de base que tenía el enfermo, con afectación principalmente pulmonar. Pero los anticuerpos fueron repetidamente negativos. La anemia apareció en el segundo ingreso, sin modificarse los valores a pesar del incremento de los infiltrados pulmonares. Por eso es más probable que se tratase de una anemia de trastornos crónicos. En cuanto a la hematuria, se justifica porque el enfermo fue sondado en UCI. Además si hubiera sido esa la causa de los infiltrados, el paciente debería haber mejorado con el tratamiento con corticoides, aunque sabemos que algunas enfermedades autoinmunes con hemorragia pulmonar pueden no responder a este tratamiento y precisar el uso de inmunosupresores.
Dr. G. Del Val (oncólogo): ¿Qué relevancia clínica tiene el marcador tumoral CA19.9 en este caso?
Dr. Rodríguez: Sabemos que no existe el marcador tumoral ideal. El CA19.9 es un antígeno carbohidratado con características estructurales comunes a los grupos sanguíneos de Lewis A y en individuos sanos está presente en glándulas salivares, bronquiales, próstata y meconio. Se eleva en presencia de neoplasias digestivas - la más frecuente la neoplasia de páncreas-, en los procesos colostáticos y menos frecuentemente con las neoplasias pulmonares.
La investigación de posibles tumores ya se venía haciendo desde el ingreso previo siendo negativa, en este ingreso todas las pruebas también fueron negativas, aunque no se pudo realizar colonoscopia.
Por otro lado el CA19.9 también se eleva en diversos procesos pulmonares que cursan con componente inflamatorio, como son: fibrosis pulmonares, tuberculosis, infecciones por hongos, otras micobacterias, etc. Esto último nos sirvió para intentar llegar al diagnóstico de la patología pulmonar.
DIAGNÓSTICO DIFERENCIAL CLÍNICO
Dra. Porras: El planteamiento del diagnóstico diferencial fue muy variado por la mala evolución clínica, el resultado de algunas pruebas y por no haberse podido realizar otras más específicas como el lavado broncoalveolar (LBA) y la biopsia pulmonar.
La primera orientación con el infiltrado alveolo-intersticial de predominio en hemitórax derecho y el antecedente de pérdida de conciencia fue hacía una neumonía por aspiración. Por ello, se trató con antibióticos de amplio espectro cubriendo los gérmenes anaerobios. Su evolución fue hacia una mejoría parcial de los síntomas.
Después, cuando empeoró su insuficiencia respiratoria, con aumento de los infiltrados pulmonares y considerando la posibilidad de una fibrosis pulmonar, dados los hallazgos en el TAC torácico y en las radiografías de ingresos previos, se añadieron al tratamiento corticoides a altas dosis. Además, el CA19.9 aumentado algunos autores lo correlacionan con una fase de actividad de fibrosis pulmonar. También el tratamiento con corticoides nos cubriría una posible hemorragia pulmonar como manifestación de una vasculitis sistémica (aunque el estudio inmunológico había sido negativo).
Como el paciente continuaba con empeoramiento del cuadro clínico se plantearon los siguientes diagnósticos diferenciales:
1. Sobreinfección pulmonar en un paciente inmunocomprometido —por su enfermedad diabética de base, tratamiento corticoideo a altas dosis, su estancia en UCI y la antibioterapia agresiva—, por un agente multirresistente o bacterias nosocomiales oportunistas (Pseudomona, Legionella, Stenotrophomona...); por hongos como Aspergillus (también existe algún caso publicado en relación con este hongo y el aumento del CA19.9) o especies de Cándidas.
2. Reactivación de tuberculosis, ya que presentaba lesiones antiguas específicas en vértices pulmonares, se trató con corticoides y también existe relación con el CA19.9.
3. Enfermedades fibróticas que afectan al parénquima pulmonar, donde está descrito un aumento del CA19.9, entre otros marcadores y que tienen un tratamiento específico (neumoconiosis, histiocitosis X, colagenosis con afectación pulmonar, sarcoidosis, proteinosis alveolar, linfangioleiomatosis, neumonía lipoidea crónica bronquiolitis obliterante con neumonía organizativa, etc.). Para el diagnóstico de estas entidades nos habría ayudado el LBA y la biopsia pulmonar.
4. Neoplasias pulmonares con elevación de marcadores tumorales entre ellas el carcinoma bronquioloalveolar, por la evolución y las manifestaciones radiológicas.
DATOS MORFOLÓGICOS
Dr. Gª Rojo: La citología del cepillado esofágico recibido dos días antes del óbito mostraba estructuras fúngicas correspondientes a Cándida (fig. 3).
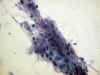
Fig. 3. Citología de esófago. Presencia
de abundantes Cándidas. Papanicolau x400.
En la autopsia, los pulmones tenían una consistencia y pesos aumentados (1.800 g), con una superficie de corte con pérdida difusa del patrón alveolar y presencia de un material amarillento-cremoso o purulento a la expresión (fig. 4).
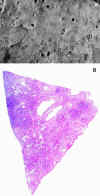
Fig. 4. Afectación difusa del parénquima
pulmonar con pérdida de espacios aéreos. (a) Fotografía macroscópica de
lóbulo inferior derecho. (b) Sección histológica de lóbulo superior derecho.
Histológicamente, se observó un doble patrón lesional, afectando con intensidad variable a todos los lóbulos pulmonares.
El primero de los patrones histológicos en pulmón consistía en una fibrosis intersticial marcada del parénquima con predominio de fibrosis evolucionada con colágeno laxo, parcheada, mostrando heterogeneidad en el tiempo de evolución de las mismas (fig. 5). En lóbulos superior e inferior izquierdo se apreciaban áreas de osificación focal, sin espacios medulares. En algunas áreas las lesiones eran más recientes y se caracterizaban por engrosamiento del intersticio que protruía hacia los espacios aéreos en forma de pólipos fibrosos revestidos por neumocitos altos, en cuyo interior la estroma era laxa, mixoide, y con escasos linfocitos (cuerpos de Masson) (fig. 6). En todas las secciones destacaba una distorsión de los espacios aéreos, frecuentemente dilatados, revestidos por epitelio de tipo cuboidal o bronquiolar, sin identificarse prácticamente en ninguna sección alvéolos de pared fina normal. Algunos neumocitos mostraban citoplasma amplio con un material hialino eosinófilo en su interior. El epitelio de los espacios aéreos era alto, y con frecuencia con atipia nuclear moderada. Algunos bronquiolos y espacios aéreos presentaban metaplasia epidermoide focal. En ambos lóbulos superiores y en lóbulo inferior derecho se identificaban nódulos linfoides (con frecuencia subpleurales), constituidos por linfocitos pequeños con algunas áreas hialinizadas.

Fig. 5. Transición entre áreas de
tabiques fibrosos gruesos y parénquima pulmonar con afectación inicial por el
proceso fibrosante, acompañado de un discreto infiltrado linfocitario. HE x100.
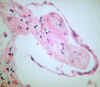
Fig. 6. Tejido conectivo laxo que protruye
hacia los espacios aéreos (cuerpos de Masson). HE x200.
El segundo patrón lesional también tenía una distribución parcheada, pero se caracterizaba por focos de necrosis del parénquima pulmonar (espacios aéreos y bronquiolos) y cúmulos de numerosos PMN neutrófilos en bronquiolos y alvéolos restantes, aunque sin ocupar la totalidad de estos espacios aéreos y acompañados de un exudado fibrinoso. Los focos de necrosis estaban bien delimitados y no eran confluentes. En ocasiones, la necrosis afectaba a la pared de los bronquiolos, que exhibían despegamiento del epitelio, edema y cúmulos de PMN neutrófilos en su pared, observándose una distribución peribronquiolar de estas lesiones (fig. 7). En otras áreas se identificaban frecuentes macrófagos entremezclados con los PMN neutrófilos y fibrina. En el borde de las áreas de necrosis, los neumocitos y las células epiteliales bronquiolares mostraban signos de infección viral por herpes simple, con núcleos muy irregulares, sin mitosis, con inclusiones eosinófilas intranucleares y algunas células binucleadas o multinucleadas (fig. 8).
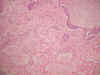
Fig. 7. Bronconeumonía aguda
necrotizante, de distribución peribronquial. HE x100.
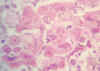
Fig. 8. Núcleos
de células epiteliales con inclusiones eosinófilas (Cowdry A) y otras con
núcleos envidrio esmerilado, sugestivo de infección por herpes simple. HE
x400.
Además del pulmón, también se identificaron lesiones características de virus del herpes simple en laringe (fig. 9), esófago y estómago.

Fig. 9. Esofagitis herpética. Úlcera con
presencia de inclusiones virales típicas en los núcleos de las células
epiteliales de los bordes. HE x100. Inset: Detalles de inclusiones virales. HE
x400.
Los glomérulos renales presentaban esclerosis focal aislada y engrosamiento de asas, a veces de forma nodular, en forma de globos eosinófilos en mesangio (nódulos mesangiales de Kimmelstiel-Wilson).
Otros hallazgos de autopsia fueron signos de hemofagocitosis en ganglios linfáticos y una esclerosis de túbulos seminíferos de distribución lobulillar, observándose en los túbulos restantes, una parada de la maduración en espermatocitos de primer orden.
La causa de la muerte probablemente es respiratoria, por neumonía herpética Y su expresión morfológica es una neumonía necrotizante extensa en ambos pulmones.
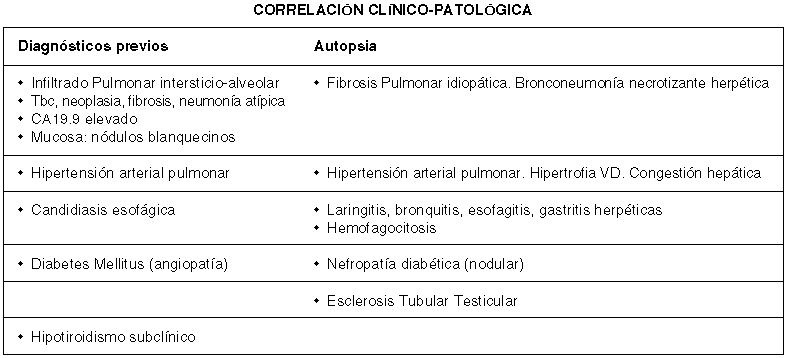
PRINCIPALES DIAGNÓSTICOS ANATOMOPATOLÓGICOS
— APARATO RESPIRATORIO:
Neumonía intersticial común evolucionada (fibrosis pulmonar idiopática)
Neumonía herpética
Derrame pleural bilateral
Bronquitis y laringitis de origen herpético
— APARATO DIGESTIVO:
Esofagitis herpética
Úlcera gástrica pilórica superficial (compatible con origen herpético)
— APARATO GENITOURINARIO:
Nefropatía diabética (glomeruloesclerosis nodular y arterioloesclerosis)
Esclerosis tubular focal en ambos testículos, con parada en la maduración en espermatocitos de primer orden.
CAUSA DE MUERTE: Atribuible a insuficiencia respiratoria por neumonía herpética.
DISCUSIÓN Y COMENTARIOS FINALES.
Dr. G. Del Val. ¿Por qué se utilizaron corticoides y cuáles pudieron ser las consecuencias derivadas de este uso?
Dr. Rodríguez: Se utilizaron corticoides a dosis de 1 mg/Kg de peso en este paciente por dos motivos, uno para el control de la disnea y otro porque se sospechó que el proceso fibrótico antiguo que arrastraba el paciente podría estar en una fase de actividad y la finalidad última era frenar el fenómeno inflamatorio severo.
Las consecuencias derivadas fueron la inmunodepresión celular que seguro ha contribuido a adquirir un germen oportunista.
Dr. García Rojo: En cuanto a los datos de incidencia, en un 4% de las autopsias es posible encontrar infección por virus del herpes simple en órganos internos. En estos casos, la neumonía intersticial difusa por virus del herpes simple puede ser la causa de muerte. Otras infecciones concomitantes descritas en estas autopsias incluyen Citomegalovirus, Aspergillus, Cándida y bacterias.
En la bibliografía es posible encontrar casos de neumopatía intersticial difusa causada por virus del herpes simple tipo 1, generalmente en pacientes mayores o inmunocomprometidos.
La Dra. Porras ya ha comentado la relación entre enfermedades autoinmunes y este tipo de patología pulmonar. La fibrosis intersticial se ha descrito en el lupus eritematoso sistémico (que puede presentarse como hemorragia alveolar aguda). Hay referencias de neumonía severa por herpes simple en algunos de estos pacientes con patología pulmonar y lupus eritematoso. Incluso, se han encontrado inmunocomplejos virales en pulmón en algunos estudios de pacientes con lupus eritematoso sistémico.
Dr. Portillo: ¿Por qué se utilizó tratamiento antituberculoso de manera empírica a pesar de que todas las investigaciones fueron negativas?
Dr. Rodríguez: Aunque todos los estudios encaminados a descartar la tuberculosis fueron negativos, no se excluye de manera definitiva, ya que no se pudo realizar biopsia pulmonar y no se había concluido el tiempo de crecimiento en los cultivos realizados.
No podemos olvidar el contexto del enfermo que arrastraba un deterioro progresivo, es diabético y en tratamiento con corticoides, sin olvidar que en radiografía de tórax previas tenia lesiones específicas en ambos casquetes apicales.
Otro dato que apoyó el tratamiento con antituberculostáticos fue el CA19.9 que se ha visto elevado en tuberculosis pulmonar.
En resumen, por todos estos argumentos podíamos estar enfrentándonos a una reactivación de una infección tuberculosa antigua.
Dr. Carbajo (patólogo): ¿Cuánto tiempo podemos calcular que el paciente podría ser portador de la fibrosis pulmonar?
Dr. Rodríguez: Revisada la historia clínica, en los ingresos previos no se diagnostica de esta entidad patológica al enfermo, pero desde el año 1996 y a raíz de un ingreso por neumonía en el hemitórax derecho, en la radiografía de tórax del alta se hace referencia a la existencia de un infiltrado intersticial fino en dicho hemitórax.
En el último ingreso en Medicina Interna en el TAC se pone de manifiesto la existencia de datos radiológicos sugerentes de fibrosis pulmonar.
Dra. Porras: Al preparar esta exposición, pude comprobar que en 1986 ya se observaba en sus radiografías de tórax un infiltrado intersticial predominante en pulmón derecho.
Dr. Carbajo: Llama la atención la discordancia entre la patología esofágica observada en vida y la puesta de manifiesto en la autopsia ¿Cómo se explica este hecho?
Dr. García Rojo: En la citología esofágica se observaban únicamente Cándidas. Revisados los frotis de este cepillado, de los esputos y del BAS, no fuimos capaces de encontrar lesiones sugestivas de infección viral y tampoco en la biopsia bronquial. Por otra parte, en el estudio autópsico del esófago sólo se identificaron lesiones por herpes simple (esofagitis aguda ulcerada), por lo que éstas debían ser recientes y el tratamiento antifúngico aplicado en los últimos días de vida del paciente debió ser eficaz en la eliminación de la candidiasis.
Dr. González (patólogo): La coexistencia de lesiones agudas por sobreinfección vírica en pulmón o los posibles episodios de neumonía aspirativa pudieron dificultar el diagnóstico del tipo específico de neumonía intersticial. Por ejemplo, la neumonía organizada idiopática o bronquiolitis obliterante con neumonía organizada parcheada (BOOP) también muestra protrusiones polipoideas (cuerpos de Masson) y macrófagos con lípidos. Afortunadamente, en este paciente, la heterogeneidad de las lesiones, su distribución irregular y la escasez de macrófagos intraalveolares eran signos histológicos muy sugestivos de neumonía intersticial común. Por otra parte, en este caso, las lesiones agudas sobreañadidas consistían, fundamentalmente, en una bronconeumonía necrotizante, pero si en las lesiones agudas hubiese predominado la presencia de abundantes macrófagos intraalveolares o membranas hialinas, el diagnóstico diferencial con neumonía intersticial descamativa o con neumonía intersticial aguda, respectivamente, hubiese sido más difícil.
Dr. Rodríguez: Después de haber escuchado al Dr. García Rojo, que nos ha expuesto los hallazgos autópsicos, quisiera hacer una reflexión. No pensamos que el posible proceso infeccioso intercurrente en este paciente fuera viral y concretamente un virus del grupo herpes. Por otro lado, es totalmente factible que así sea ya que el paciente era diabético, arrastraba un deterioro progresivo y estaba sometido a corticoterapia.
Pienso que este caso nos enseña a tener presente a los virus, concretamente al virus herpes simple como patógeno oportunista responsable de una afectación sistémica que puede causar la muerte, no sólo en pacientes inmunodeprimidos por trasplante de riñón o médula ósea o en los inmunodeprimidos por el VIH.
En este paciente ¿deberíamos haber instaurado terapia antiviral empírica?
Dr. Galiana (internista): También me planteo, a la vista del resultado de esta autopsia, que en los servicios de Medicina Interna existen muchos pacientes con patologías de base crónicas debilitantes que cursan inmunodepresión y que a veces toman corticoides. Habitualmente, no pensamos en los virus como patógenos oportunistas en presencia de infiltrados e insuficiencia respiratoria.
BIBLIOGRAFÍA
Bayada JM, Ghiglione B, Giordano P, Gilardi E, Marin H, Gilly R. Diffuse interstitial pneumopathy caused by herpes simplex virus type 1 in a 77-year-old patient. Rev Med Interne 1989; 10: 257-9.
Bello C, Richard C, Iriondo A, Mazorra F, Gandarillas MA, Ondiviela R, Conde E, Zubizarreta A. Neumonitis intersticial por virus herpes simple en un trasplante de medula ósea alogénico, tratada con éxito con aciclovir. Med Clin (Barc) 1988; 90: 380-2.
Fujita J, Obayashi Y, Yamadori I, Ohtsuki Y, Miyawaki H, Hojo S, Furukawa Y, Takahara J. Marked elevation of CA19-9 in a patient with idiopathic pulmonary fibrosis: CA19-9 as a bad prognostic factor. Respirology 1998; 3: 211-4.
Hughson MD, He Z, Henegar J, McMurray R. Alveolar hemorrhage and renal microangiopathy in systemic lupus erythematosus. Immune complex small vascular injury with apoptosis. Arch Pathol Lab Med 2001; 125: 475–83.
Takahashi T, Munakata M, Ohtsuka Y, Satoh A, Homma Y, Kawakami Y. Role of viral infections in acute exacerbation of idiopathic interstitial pneumonia. Nihon Kyobu Shikkan Gakkai Zasshi 1995; 33: 723-7.
Takayama S, Kataoka N, Usui Y, Inase N, Natori Y, Nakayama M, Miura H, Kimula Y. CA19.9 in patients with benign pulmonary diseases. Nihon Kyobu Shikkan Gakkai Zasshi 1990; 28: 1326-31.
Yonemaru M, Kasuga I, Kusumoto H, Kunisawa A, Kiyokawa H, Kuwabara S, IchinoseY, Toyama K. Elevation of antibodies to cytomegalovirus and other herpes viruses in pulmonary fibrosis. Eur Respir J 1997; 10: 2040-5.