
Vol. 36, n.º 2, 2003
REVISTA
ESPAÑOLA DE
Vol. 36, n.º 2, 2003 |
Angel Fernández-Flores, Manuel Orduña Yáñez1, Luis Bacariza Rastrollo2, Indalecio Fidalgo Alvarez3
Servicios de Anatomía Patológica, 1Radiodiagnóstico, 2Traumatología y 3Pediatría. Clínica Ponferrada. León. gpyauflowerlion@terra.es
RESUMEN
Presentamos un caso de Enfermedad por Arañazo de Gato en una niña de 10 años, con historia de exposición a un gato, clínica de la enfermedad, y positividad serológica frente a B.henselae (Inmunofluorescencia indirecta). Se realiza estudio anatomopatológico de adenopatías axilares y epitrocleares, objetivándose una linfadenitis granulomatosa epitelioide con necrosis purulenta central. Las técnicas histoquímicas habituales, incluyendo Warthyn-Starry, fueron negativas para microorganismos. Puesto que el cuadro morfológico no es patognomónico y debe ser evaluado en el contexto clínico, se discuten otras posibilidades diagnósticas.
Palabras clave: Enfermedad por Arañazo de Gato.
SUMMARY
We report a case of Cat Scratch disease in a 10 years old girl. After having been exposed to a cat, she developed clinical symptoms of the disease. The serological tests (Antibodies against B.henselae: Indirect Immunofluorescency) weres positive. We performed a morphological study of axillary and epithroclear nodes. An epithelioid granulomatous lymphadenitis with central necrosis was observed. The typical hystochemical techniques, including Warthyn-Starry, were negative for microorganisms.
The morphological picture, although suggestive of cat scratch disease, is not patognomonic, so other diagnostic possibilities are considered.
Key words: Cat Scratch Disease.
INTRODUCCIÓN
La Enfermedad por Arañazo de Gato (EAG) es la principal causa de agrandamiento crónico benigno de los ganglios linfáticos en población de edad inferior a los 18 años, grupo este en el que además se presentan el 80% de los casos.
Los criterios diagnósticos han variado a lo largo de la historia, siendo el cuadro histopatológico sugestivo de la enfermedad y orientativo de un estrecho grupo de procesos con la EAG a la cabeza.
Presentamos el estudio morfológico de un caso que cumple criterios diagnósticos de EAG.
DESCRIPCIÓN DEL CASO
Paciente de sexo femenino de 10 años de edad, que acude a consulta con dolor de 20 días de evolución en codo y brazo derechos. En los dos primeros días había tenido fiebre de 29oC. Hacía aproximadamente algo menos de dos meses que jugó con el gato de un familiar. Resto de antecedentes: Sin hallazgos.
La exploración revelaba una zona tumefacta trianguloide dolorosa de 12 x 9 cm en antebrazo derecho, con adenopatías dolorosas ipsiliaterales a niveles axilar (en plastrón de 8 x 6 cm) y epitroclear. Se acompañaban de lesiones del tipo eritema nodoso en cara anterior de ambas piernas. No presentaba fiebre.
La ecografía de las masas adenopáticas demostraba imágenes sugestivas de abscesificación en algunas de ellas. Existía una esplenomegalia uniforme moderada (Eje mayor 114 mm).
Radiografía de tórax sin alteraciones.
En la analítica destacaban (cifras en unidades x 103/mm3): Leucocitos 21,9; granulocitos 15; linfocitos 5,8; monocitos 11; plaquetas 424. VSG: 76 mm; Fosfatasa alcalina 319 UI/L; PCR: 15,8 ng/dl.
Frótis sanguíneo sin alteraciones. Fondo de ojo normal. Prueba de tuberculina: Negativa.
Hemocultivo: Negativo. Jugo gástrico: a) Cultivo para Mycobaterium tuberculosis: Negativo; b) Búsqueda de microorganismos en extensión directa: Negativo.
Anticuerpos anti-Franciscella tularensis en suero por aglutinación en tubo: Negativo.
Anticuerpos anti Bartonella henselae en suero por inmuno-fluorescencia indirecta: Positivo IgG (título 1:215) e IgM (título 1:128).
Se instauró tratamiento con Isoniacida y Azitromicina y se pautó drenaje quirúrgico de áreas eptiroclear y axilar enviándose el material obtenido a Anatomía Patológica.
HALLAZGOS PATOLÓGICOS
La biopsia epitroclear correspondía a diez fragmentos parduscos, el mayor de 1,2 cm de diámetro máximo. La biopsia axilar correspondía a seis fragmentos de aspecto adiposo, el mayor de 3 cm de diámetro, de los que se aislaron en total cuatro adenopatías, siendo la mayor de 2,3 cm de diámetro.
Las biopsias se fijaron 24 horas en formalina al 10%, y se incluyeron en parafina (en su totalidad en el caso de la epitroclear, y seis bloques de las adenopatías axilares) realizando tinciones de hematoxilina-eosina, Brown-Brenn, PAS, Ziehl-Neelsen, Giemsa y Warthin-Starry.
El estudio al microscopio revela, en ambos casos, una linfadenitis granulomatosa necrotizante abscesificada (fig. 1) Los granulomas muestran una corona radiada periférica de histiocitos epitelioides, con ocasionales células gigantes multinucleadas de tipo Langhans, rodeando zonas centrales de necrosis coagulativa y abscesos de polimorfonucleares netrófilos (fig. 2) Acompañan áreas de hiperplasia folicular reactiva inespecífica.
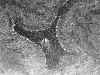
Fig. 1: Granuloma estrellado
epitelioide con abscesificación central, evidenciado en una de las adenopatías
axilares (Hematoxilina-Eosina, x 40).
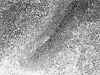
Fig. 2: Detalle de uno de los
granulomas, con necrosis purulenta central y corona radiada epitelioide
(Hematoxilina-Eosina, x100).
En la biopsia axilar existen además, granulomas similares en la grasa, junto con abundantes macrófagos xantomatosos. En ningún caso se observan microorganismos con las técnicas de Brown-Brenn, Ziehl-Neelsen, PAS ni Giemsa. La técnica Warthin-Starry en cortes repetidos es negativa.
El diagnóstico establecido fue de linfadenitis granulomatosa epitelioide abscesificada, junto con una nota comentario de que el cuadro era sugestivo de EAG, sin poder excluir por completo otros cuadros entre los que destacaban la tularemia, las microbacteriosis atípicas y el linfogranuloma venéreo.
DISCUSIÓN
La historia de la EAG se remonta a 1889, cuando se describieron los primeros casos de Síndrome Oculoglandular de Parinaud, que hoy sabemos, están en su mayoría asociados a EAG. Esta última fue descrita como entidad nosológica por primera vez en Francia en 1950 por Robert Debre, aceptándose entonces como criterios diagnósticos los síntomas clínicos, los datos epidemiológicos y el test intracutáneo de Hanger y Rose.
En la actualidad se considera un diagnóstico establecido si se cumplen tres o cuatro de los siguientes criterios: a) Historia de exposición a un gato 2 a 4 semanas antes de la aparición de la adenopatía con hallazgos de la lesión primaria o de inoculación; b) Prueba cutánea positiva; c) Otros resultados de laboratorio negativos para otros microorganismos responsables de adenopatías; d) Alteraciones histológicas características.
Nuestro caso cumplía los criterios a, c y d. Con respecto al criterio a, recuérdese que aunque la exposición al gato en el momento de la primera consulta había sido hacía «algo menos de dos meses», la paciente llevaba ya 20 días de evolución.
Numerosos agentes han sido considerados responsables de la enfermedad. Entre ellos virus, bacterias y Chlamydias. A finales de los años 80, se cultivó a partir de tejidos afectos la Afipia spp, considerada entonces como agente responsable de la EAG. En 1992, estudios de análisis microbiológico, estudios moleculares y epidemiológicos, pusieron en escena al Gramnegativo Bartonella henselae (primeramente Rochalimea), quedando algún caso ocasional atribuido a Afipia felis junto con algunos otros microorganismos más raramente aislados en casos de EAG, como la Rothia dentocariosa o la Bartonella Clarridgeriae (1).
La B. henselae, en inmunocompetentes puede dar lugar a un proceso febril inespecífico, o en ocasiones a una repuesta granulomatosa supurativa de las zonas infectadas, generalmente autolimitada, pudiendo en ocasiones verse afectados órganos como hígado, bazo, ojos, pulmón o sistema nerviosa central.
En inmunocomprometidos, la respuesta es curiosamente vasculoproliferativa, generalmente de curso fatal, pudiendo localizarse a los microoganismos tanto intra como extracelularmente y convirtiéndose casi siempre en un cuadro bacteriémico y diseminado. Cuadros asociados a la infección por B.henselae en inmunodeprimidos son la angiomatosis bacilar, la peliosis hepatis, la peliosis esplénica, la esplenitis granulomatosa, la septicemia recurrente, la hepatitis granulomatosa y la endocarditis.
Los gatos son los únicos reservorios de B.henselae, y generalmente son los gatos jóvenes los de potencial infectante, bien sea por contacto directo (arañazo, mordedura, lametón en heridas abiertas), bien por mediación de pulgas (2).
Desde el punto de vista morfológico, a nivel del área de inoculación puede en ocasiones demostrarse una zona de necrobiosis dérmica con reacción granulomatosa epitelioide en empalizada.
La enfermedad ganglionar es también granulomatosa, siendo característica la abscesificación central que llega a ser confluente. A veces puede acompañarse de expansión sinusal por células B monocitoides que puede recordar al Piringer-Kuchinka.
Este cuadro morfológico no es para nada patognomónico, y debe ser evaluado en el contexto clínico y de los hallazgos de laboratorio. Aunque sugestivo de EAG, deben excluirse otros patógenos responsables como las mycobacterias atípicas, la Frascinsella tularensis (tularemia), las Chlamydias (linfogranuloma venero) o más raramente la esporotricosis, la criptococosis o la coccidioidomicosis (10). En nuestro caso, dado que la provincia de León es zona habitual de Tularemia, principalmente en temporada de caza por manipulación de las piezas muertas, fue de especial importancia la exclusión serológica de dicha enfermedad, que podría resultar menos habitual en otras regiones.
La asociación de Enfermedad por Arañazo de Gato con eritema nodoso (EN), ha sido informada en varias ocasiones, aunque debe recordarse que en pacientes pediátricos es más corriente la asociación del último con la tuberculosis (9).
La tinción de Warthin-Starry, dentro de las dificultades de valoración del resultado, puede ser útil en la demostración de los bacilos responsables de la EAG, que aparecen preferentemente ubicados en las áreas de necrosis, aunque la negatividad de la técnica no excluye la enfermedad, como sucedió en nuestro caso.
Min y colaboradores, en una revisión de 46 casos con EAG y biopsia ganglionar, solo encuentran bacilos en un 33% de ellos (3) Abarca y colaboradores encuentran positividad con Warthin-Starry en 2 de 10 casos (6), y similares cifras se observan en otras series (7).
Se han desarrollado técnicas de inmunohistoquímica con anticuerpos frente a B.henselae (3) y existe la posibilidad de complementar los estudios con microscopía electrónica, observándose bacterias extracelulares de 0,8-1,5 mm de largo y 0,3-0,5 micras de ancho, presentes en el tejido colágeno degenerado y en las paredes vasculares.
Por último, las técnicas de reacción en cadena de la polimerasa frente a regiones de genes 16SrRNA (4,8), gltA y htrA (5), están siendo cada vez de más asistencia diagnóstica, habida cuente de lo dificultoso que ha resultado el cultivo del microoganismo.
Agradecimientos: Agradecemos al Servicio de Anatomía Patológica del Hospital del Bierzo, la ayuda técnica prestada en la realización de las fotografías.
BIBLIOGRAFÍA
Kordick DL, Hilyard EJ, Hadfield TL, Wilson KH, Steigerwalt AG, Brenner Dj, Breitschwerdt EB. Bartonella clarridgeiae, a newly recognized zoonotic pathogen causing inoculation papules, fever and lymphadenopathy (cat scratch disease). J Clin Microbiol 1997; 35: 1813-8.
Flexman JP, Lavis NJ, Kay ID, Watson M, Metcalf C, Pearman JW. Bartonella henselae is a causative agent of cat scratch disease in Australia. J Infect 1995; 31: 241-5.
Min KW, Reed JA, Welch DF, Slater LN. Morphologically variable bacilli of cat scratch disease are identified by immunocytochemical labeling with antibodies to Rochalimaea henselae. Am J Clin Pathol 1994; 101: 607-10.
Scott MA, McCurley TL, Vnencak-Jones CL, Hager C, McCoy JA, Anderson B, Collins RD, Edwards KM. Cat Scratch disease: Detection of Bartonella henselae DNA in archival biopsies from patients with clinically, serologically, and histologically defined disease. Am J Pathol 1996; 149: 2161-7.
Avidor B, Kletter Y, Abulafia S, Golan Y, Ephros M, Giladi M. Molecular diagnosis of Cat Scratch disease: A two-step approach. J Clin Microbiol 1997; 35: 1924-30.
Abarca K, Vial PA, Rivera M, Garcia C, Oddo D, Prado P, Ferres M. Bartonella henselae infection in Immunocompetente patients: Cat Scratch disease. Rev Med Chil 1996; 124: 1341-9.
Lamps LW, Gray FG, Scott MA. The histologic spectrum of hepatic Cat Scratch disease. A series of six cases with confirmed Bartonella henselae infection. Am J Surg Pathol 1996; 20: 1253-9.
Tapp RA, Roy AF, Corstvet RE, Wilson VL. Differential detection of Bartonella species and strains in cat scratch disease diagnostics by polymerase chain reaction amplification of 16S ribosomal RNA gene: J Vet Diagn Invest 2001; 13: 219-229.
Artola Aizald E, Gonotxategui Gonotxategui P, Lopez Palma F, Guerrero Pereda R, Unanue Tejera G, Palacio Pina M, Albisu Andrade Y: Erythema nodosum in pediatric patients. A study of 22 cases. An Esp Pediatr 1993; 39: 191-193.
Su WP, Duechle MK, Peters MS, Muller SA. Palisading granulomas caused by infectious diseases. AM J Dermatopathol 1992; 14: 211-215.