
Vol. 36, n.º 4, 2003
REVISTA
ESPAÑOLA DE
Vol. 36, n.º 4, 2003 |
Francisco Vera-Sempere1, Ana García1, Agustín Froufe1, Emilia Corell2, Francisco Ruiz2, Fernando Mayordomo1
1 Servicio de Anatomía Patológica y 2 Unidad de Patología Mamaria. Hospital Universitario La Fe. Universidad de Valencia. vera_fra@gva.es
RESUMEN
Introducción: El tumor de células granulares (TCG) es una lesión infrecuente en la mama, representando solo el 6-8% de los TCG, comprometiendo a menudo a la piel mamaria. Pacientes y métodos: Se revisa la casuística de TCG mamarios del Hospital Universitario La Fe de Valencia en un período de 19 años, con un total de 8000 especímenes biópsicos mamarios con 2200 diagnósticos de cáncer, realizando de forma retrospectiva un estudio morfológico (óptico, inmunohistoquímico y ultraestructural) a partir de material incluido en parafina. Resultados: Se detectan dos casos de TCG con afectación de piel mamaria con distinta presentación clínica (TCG como nódulo tumoral único y TCG como lesión tumoral múltiple en relación a una cicatriz de mastectomía previa). En ambas observaciones se comprobó, junto a otros datos ya conocidos (PAS + citoplásmica granular diastasa resistente, positividad a S-100, VT, CD68 y ultraestructura con numerosos cuerpos densos lisosomiales) la presencia de una reactividad inmunohistoquímica frente a a-inhibina. Conclusiones: Los TCG de glándula mamaria muestran reactividad inmunohistoquímica frente a a-inhibina, aspecto éste que amplia la aplicabilidad de este anticuerpo, sumándose al panel existente de inmunomarcadores en el diagnóstico de los TCG.
Palabras clave: Tumor de células granulares, mama, inmunohistoquímica, ultraestructura, a-inhibina.
SUMMARY
Introduction: Granular cell tumors (GCT) are infrequent in the breast, accounting for only a small proportion (6-8%) of all GCT, often manifesting as lesions affecting the mammary skin. Material and methods: 8000 breast biopsy specimens of mammary (with 2200 breast cancer diagnoses), processed over a 19 year period at La Fe University Hospital of Valencia, were reviewed by means of a retrospective morphological study (optical, immunohistochemical and ultrastructural examination) based on the original paraffin-embedded material for possible GCT. Results: Two cases of GCT with mammary skin involvement were found, with two different clinical presentations (CGT as a single tumor nodule and CGT as multiple tumoral lesions associated with a mastectomy scar). In addition to other already well known characteristics (cytoplasmic granules PAS + diastase resistant, positivity for S-100, VT and CD68, and numerous lysosomal dense bodies at ultrastructural level) both cases showed immunohistochemical reactivity against (a-inhibin. Conclusions: GCT affecting mammary skin shows immunoreactivity against a-inhibin, a feature which extends the applicability of this antibody on adding it to the existing immune marker panel for diagnosis of CGT.
Key words: Granular cell tumor, breast, immunohistochemistry, ultrastructure, a-inhibin.
INTRODUCCIÓN
Los tumores de células granulares (TCG) son neoplasias generalmente benignas, de probable origen schwanniano, que pueden afectar a distintas localizaciones (piel, celular subcutáneo, mucosas, partes blandas) incluyendo el tejido mamario. Morfológicamente muestran células, redondas o poligonales, de núcleos generalmente pequeños, redondos u ovales, y un citoplasma amplio eosinófilo, con múltiples granulaciones finas, PAS positivas diastasa resistente.
Las formas mamarias son sólo el 6-8% de todos los TCG (1), estimándose un diagnóstico de TCG por cada 1.000 diagnósticos de cáncer mamario (2). A menudo se trata de tumores con afectación de la piel mamaria, siendo rara la afectación glandular sin participación cutánea. Suelen aparecer entre los 30-50 años, si bien se han descrito casos en adolescentes y ancianas, e incluso en la mama del varón. El TCG mamario puede producir retracción de piel o incluso del pezón, así como fijación a planos periféricos y/o profundos, simulando a menudo clínica y radiológicamente un carcinoma mamario, si bien la mayoría de los casos van a tener un comportamiento benigno, con escasas observaciones con metástasis a distancia (1).
En el presente estudio se revisa la casuística de TCG mamarios en nuestro hospital aportando dos casos con distinta presentación clínica, señalando un nuevo dato inmunohistoquímico con relación a la reactividad frente a a-inhibina, un aspecto asimismo referido en los TCG del tracto biliar (3).
PACIENTES Y MÉTODOS
Se revisan de forma retrospectiva los archivos biópsicos de nuestro hospital en un período de 19 años, realizando una búsqueda manual sobre fichas de codificación de diagnósticos en el período 1981-94 con el código topográfico 04 (mama) y 01 (piel) y el código de neoplasia M9370 (mioblastoma de células granulares) del SNOMED (1.ª edición) y de otra mediante búsqueda literal por diagnósticos utilizando el programa Pat Win 3.0.1 en el periodo 1995-2001, detectando dos casos de TCG con afectación mamaria. Durante el periodo de tiempo revisado se han estudiado 8.000 especímenes mamarios, con 2.200 diagnósticos de cáncer de mama. En ambos casos se procedió a recopilar los datos clínicos y el material biópsico estudiado.
Caso n.º 1
Mujer postmenopaúsica de 55 años, sin antecedentes de patología mamaria, que presentaba un nódulo en CII derecho, de varios meses de evolución, ligeramente indurado de 2 cms de diámetro, adherido y retrayendo a la piel, con algún vello en su superficie. La mamografía mostró una glándula con áreas fibrosas irregulares, apreciándose aumento de densidad a nivel de la lesión nodular, aunque sin signos de malignidad, ni presencia de microcalcificaciones. Se realizó exéresis en bloque de la lesión acompañada de la piel suprayacente.
Caso n.º 2
Paciente de 45 años de edad estéril primaria, con neoplasia mamaria bilateral (carcinoma ductal infiltrante bilateral, pT1N0M0 y pT1N1bM0 respectivamente) tratada con mastectomía radical modificada bilateral y quimioterapia (doce ciclos de FEC-75, —epirubicina + ciclofosfamida + fluoracilo—) más análogos de LH-RH. Siete años después de la cirugía presentó tres lesiones nodulares induradas, de 0,3-0,4 cm de diámetro, en la prolongación axilar de la mama izquierda, cercanas a la cicatriz previa de mastectomía, más otra lesión nodular en región subescapular izquierda de 1 cm de diámetro, realizándose exéresis quirúrgica de todas las lesiones.
En ambas observaciones se realizó un estudio inmunohistoquímico retrospectivo frente a un panel de anticuerpos incluyendo RE/RPg (Dako ER/PR system), Ki-67 (Clon B126.1, Biomeda, 1/50), Vimentina (VT Dako, 1/000), S-100 (Dako, 1/2000), CD68 (clon PG-M1, Dako, 1/100), lisozima (Biomeda, prediluido), HMB-45 (Dako, 1/500), citoqueratina de bajo peso molecular 8/18 (clon 5D3, Medac, 1/40), AE 1-3 (Signet 1/50), EMA (Dako, 1/100), VT (Dako, 1/100), a-1-AT (Biomeda, prediluido), Bcl-2 (clon 124, Dako, 1/100), p53 (clon DO7, Novocastra, 1/50) y a-inhibina (clon R1, Dako, 1/100). A partir del material incluido en parafina se procedió a realizar inclusión para microscopía electrónica, utilizando una metodología previamente descrita (4).
RESULTADOS
El caso n.º 1 (lesión tumoral surgida de novo en el CII de mama derecha de una paciente de 55 años) se trataba un nódulo sólido de 2 x 2,3 cms de color amarillento, recubierto por una piel mamaria que mostraba (fig. 1) una densificación fibrosa de la dermis papilar alternando con áreas de discreto edema con cambios basofílicos. La piel presentaba anexos pilosebáceos con fibras musculares lisas (músculo erector pili) y sudoríparos. Engastada en el espesor dérmico, atrapando anexos, alcanzando el tejido celular subcutáneo y extendiéndose hasta la propia grasa estromal mamaria (fig. 2) aparecía una lesión cuneiforme de 1,5 x 1 cm, con su base paralela al trayecto epidérmico y su vértice dirigido hacia el interior de la mama.
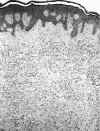
Fig. 1. Caso n.º 1: lesión tumoral
engastada en la dermis mamaria (HE, 100x).
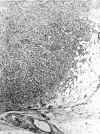
Fig. 2. Borde de crecimiento tumoral
de carácter expansivo, extendiéndose al tejido graso estromal mamario, con
algún pequeño agregado linfocitario en la periferia del tumor (HE, 100x).
La lesión estaba constituida por agregados de células de contorno poligonal o redondeado, de citoplasmas eosinofílicos finamente granulares (fig. 3), con gránulos PAS positivos diastasa resistente. Los núcleos centrales o ligeramente excéntricos eran redondos, regulares y homogéneos, sin atipia, polimorfismo ni mitosis. Entre los agregados de células granulares aparecían haces de fibras colágenas y algún pequeño tronco neural, englobado y rodeado por células granulares. La lesión en periferia (fig. 2) tenía un contorno redondeado con algunas lengüetas introduciéndose en la grasa mamaria, con algún pequeño agregado de elementos linfoides maduros a modo de manguitos perivasculares, así como algunos vasos linfáticos de luz dilatada.
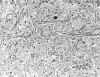
Fig. 3. Aspecto morfológico del tumor
mostrado agregados celulares de contorno redondeado o poligonal, con citoplasmas
oesinófilos, finamente granulares, con núcleos redondos, centrales o
ligeramente excéntricos (HE, 250x).
El caso n.º 2 (lesión múltiple en piel mamaria y subescapular) mostró similares características, apreciándose grupos e islotes de células granulares inmersas en un tejido fibroso de aspecto cicatricial, insinuándose los islotes entre haces de tejido colágeno. En uno de los fragmentos aparecía un trayecto neural hipertrófico de carácter serpenteante atrapado dentro de la proliferación de células granulares.
El estudio inmunohistoquímico (fig. 4) de ambas observaciones reveló similares características, con positividad citoplásmica para S-100, VT y CD-68 y negatividad para AE1-3, citoqueratina 8/18, EMA, desmina, mioglobina y HMB-45. También fueron negativos los RE/RPg pero sin embargo se observo positividad citoplásmica, granular, de carácter heterogéneo frente a a-inhibina (fig. 5), con una distribución similar a la de CD-68. El antígeno Ki-67 mostró en todas las lesiones un índice de proliferación muy bajo (1-2%), la oncoproteína p53 fue negativa y sólo se detectó una débil/moderada positividad citoplásmica frente a Bcl-2, lisozima y a-1-AT.

Fig. 4. Acusada inmunorreactividad
frente a proteína S-100 (a) y vimentina (b) (S-100 y VT, 250 y 400x).
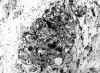
Fig. 5. Nidos de células granulares
mostrando positividad citoplásmica granular, de carácter heterogéneo, frente
a
El examen ultraestructural, a partir de material incluido en parafina, mostró grupos de células dispuestas de forma compacta con sus membranas celulares adosadas, en ocasiones con prolongaciones interdigitadas aunque sin sistemas especializados de unión. La periferia a menudo estaba cerclada por material de tipo lámina basal de apariencia reduplicada si bien en ocasiones las células se situaban en continuidad directa con fibras de colágena joven. Las células tumorales presentaban en los cortes semifinos gran número de gránulos (fig. 6), observándose a nivel ultraestructural su citoplasma completamente relleno por estructuras complejas lisosomiales con cuerpos osmiófilos densos y agregados vesiculares redondos de tamaño variable (fig. 7), con escasa presencia de mitocondrias pequeñas y retículo endoplásmico, predominando con mucho la presencia de complejos lisosomiales, lisosomas secundarios o fagolisosomas. No detectamos en este material obtenido a partir de tejido parafinado la presencia de microtúbulos dispuestos en forma paralela (cuerpos angulados) en el interior de los cuerpos lisosomiales.

Fig. 6. Corte semifino teñido con
azul de toluidina, obtenido a partir de material previamente incluido en
parafina, resaltando el carácter finamente granular de las células tumorales
(azul de toluidina, 1.000x).
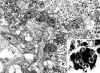
Fig. 7. Imagen ultraestructural
mostrando agregados de células tumorales, parcialmente cercladas en su
periferia por lámina basal de aspecto reduplicado, con citoplasmas rellenos por
abundantes estructuras osmiófilas densas de tipo lisosomial complejo. Detalle
(porción, inferior derecha) de los cuerpos osmófilos densos junto a la
presencia de agregados multivesiculares redondos y de tamaño variable (ME,
2.500 y 30.000x).
DISCUSIÓN
El TCG fue descrito bajo la denominación de mioblastoma de células granulares, siendo inicialmente considerado un tumor de origen miogénico, si bien más tarde datos inmunohistoquímicos y ultraestructurales (5), señalaron ya en la década de los ochenta un origen schwanniano. Diversos tipos celulares así como distintos tumores benignos y malignos (6-9) puedan mostrar rasgos superponibles a los TCG sugiriendo algunos autores que en realidad el TCG es un epifenómeno o cambio degenerativo añadido a diversas entidades (10).
Los TCG de mama son infrecuentes, generalmente afectando la piel mamaria, siendo los exclusivamente intraparenquimatosos muy inusuales. En nuestro estudio encontramos una ratio de 1 TCG/1000 cánceres de mama, muy similar a la referida en otros estudios (2,11). Inmunohistoquímicamente los TCG muestran positividad para S-100 (citoplásmica y nuclear) (12), VT, CD68 (13) y en ocasiones para a-1-QT (14), con negatividad para la mioglobina, desmina, queratinas, EMA y GFAP (15), al igual que frente a HMB-45 y MART-1 (16). El CEA puede ser positivo de forma inespecífica por una reacción cruzada con glicoproteínas antigénicamente relacionadas (17), siendo también positivo Leu-7 (CD57) (5,14,18) y catepsina B (14).
En la ultraestructura los gránulos del TCG aparecen como complejos lisosomiales, en forma de cuerpos densos, siendo este aspecto comprobado en nuestra observación a partir de material incluido en parafina. Mittal y True (19) sugieren que los gránulos se originan por un mecanismo de invaginación interna, sobre sí misma, de la membrana celular de forma similar al fenómeno que ocurre en el proceso de mielinización axonal, siendo autodigeridas las invaginaciones membranosas por fagolisosomas dando lugar a complejos lisosomiales y cuerpos mielínicos intracitoplásmicos. Esta ultraestructura explica la reactividad de los TCG frente al CD57 (HNK-1 o Leu-7), antígeno relacionado con una glicoproteína ligada a la mielina (5,14,18,20), así como frente al antígeno mielomonocítico CD68 (KP1) marcador de una glicoproteína lisosomial (13). Asimismo la falta de lámina basal rodeando individualizadamente a las células tumorales de los TCG explica la diferente reactividad de los TCG y los neurofibromas/schwannomas (15) frente a la laminina. Sin embargo es la presencia de complejos lisosomiales es el dato más característico y constante de los TCG, comprobándose (18) tanto en formas benignas como en las atípicas y malignas y en los cultivos celulares de TCG, sugiriendo realmente que se trata de una entidad tumoral y no un epifenómeno añadido a diversos tipos de tumores.
El diagnóstico diferencial de los TCG de mama plantea en primer lugar no confundir un TCG con un carcinoma de mama sobre todo en una punción o en biopsia extemporánea (21,22), donde puede simular un carcinoma de tipo histiocitoide o con cambios apocrinoides. De forma contraria Franzblau et al. (23) señalan como las metástasis cutáneas de un cáncer mamario pueden confundirse con un TCG. La detección de S-100, de CEA o incluso de VT pueden no resolver esta distinción por existir carcinomas mamarios S-100+ y CEA + e incluso con coexpresión de VT (24), si bien los TCG no expresan ningún marcador epitelial. El TCG mamario debe ser diferenciado asimismo de metástasis de tumores extramamarios, tales como carcinoma de células renales, melanomas, o tumores histiocíticos; neoplasias con las que pueden compartir apariencia morfológica y algunos datos inmunohistoquímicos comunes. Así los TCG al igual que las lesiones histiocíticas son CD68 + y en ocasiones también pueden ser positivos para a-1-QT (14); al igual que los melanomas los TCG expresan S-100 y VT, si bien resultan negativos para HMB-45 y MART-1 (14,16).
Los TGC mamarios o de otras localizaciones son negativos para RE/RPg (25), si bien pueden mostrar reactividad frente a otros factores endocrinos. Así recientemente Murakata y Ishak (3) han demostrado la expresión de a-inhibina en los TCG del tracto biliar, reactividad que nosotros hemos comprobado, de forma muy similar a la del CD-68, en nuestros dos TCG de piel mamaria y en otros TCG de localizaciones mucosas (datos no presentados). La a-inhibina es una hormona gonadal supresora de FSH, segregada por las células de la granulosa y de Sertoli/Leidig, si bien también se expresa en otros órganos productores de esteroides (capa reticular adrenal) y en tumores adrenocorticales productores de andrógenos, al igual que en el sincitiotrofoblasto y en la enfermedad trofoblástica gestacional. La aplicación diagnóstica de la a-inhibina se estableció en los tumores ováricos (26), siendo también útil en el panel diagnóstico de los tumores testiculares (27), adrenales (28), y de la enfermedad trofoblástica gestacional (29). La reactividad de la a-inhibina en los TCG constituye una ampliación de esta aplicabilidad diagnóstica que orienta a considerar una posible modulación endocrina en el origen de los TCG, que por otra parte podría explicar su mayor incidencia en ciertos grupos poblacionales.
Uno de los casos presentados correspondió a un TCG múltiple (aparición de dos o más lesiones benignas independientes) (30,31), formas que en algunas series son hasta el 29% de todos los TCG (30) sobre todo en pacientes de raza negra, sin que este carácter múltiple sea indicativo de malignidad. Al igual que nosotros, Rosso y et al. (32) han descrito un TCG en una cicatriz de mastectomía considerando que en realidad se trata de un neuroma traumático con cambios granulares. La morfología óptica de nuestro segundo caso parece apoyar esta hipótesis, si bien el perfil inmunohistoquímico, incluida la reactividad frente a a-inhibina, fue idéntico al del caso n.º 1 donde no existía ningún otro antecedente de interés.
La inmensa mayoría de los TCG van a tener un carácter de benignidad, estimándose que sólo 1-2% de los TCG son malignos. Así Jardines et al. (33) sólo recopilan 30 casos bien documentados de TCG malignos, la mayoría casos aislados, considerando como prueba inequívoca de malignidad la presencia de metástasis al señalar la dificultad existente en estos tumores en definir histológicamente el carácter de malignidad. Se han indicado (18) seis rasgos de importancia a la hora de definir la agresividad histológica de los TCG: necrosis, carácter fusiforme de las células tumorales, núcleos vesiculares con grandes nucléolos, índice divisional elevado (>2 mitosis/10 HPF —200x—), pleomorfismo nuclear y alta relación N/C. Los tumores que reúnen 3 o más criterios son clasificados como malignos, los que reúnen 1 ó 2 criterios son calificados como atípicos y si no presentan ningún criterio o solo muestran pleomorfismo nuclear focal son calificados como benignos. Otros datos indicativos de pronóstico desfavorable son reactividad de Ki-67 superior al 10%, positividad a p53, amplio tamaño tumoral y edad muy avanzada del paciente. En nuestras dos observaciones no se dio ninguno de estos datos, mostrando un índice de proliferación muy bajo (1-2% de células Ki-67+) que no permitía diferenciar la observación primera (TCG único) de la segunda (TCG múltiple en vecindad a cicatriz de mastectomía previa).
BIBLIOGRAFÍA
DeMay RM, Kay S. Granular cell tumor of the breast. Path Ann 1984; 19: 121-48.
Gordon AB, Fisher C, Palmer B, Greening WP. Granular cell tumor of the breast. Eur J Surg Oncol 1985; 11: 267-73.
Murakata LA, Ishak KG. Expression of inhibin-alfa by granular cell tumors of the gallbladder and extrahepatic bile ducts. Am J Surg Pathol 2001; 25: 1200-3.
Widehn S, Kindblom LG. A rapid and simple method for electron microscopy of paraffin-embedded tissue. Ultrastruct Pathol 1988; 12: 131-6.
Abenoza P, Sibley RK. Granular cell myoma and schwannoma: fine structural and immunohistochemical study. Ultrastruct Pathol 1987; 11: 19-28.
Val-Bernal JF, Mira C. Dermatofibroma with granular cells. J Cutan Pathol 1996; 23: 562-5.
Shimokama T, Watanabe T. Leiomyoma exhibiting a marked granular change: granular cell leiomyoma vs. granular cell schwannoma. Hum Pathol 1992; 23: 327-31.
Tanimura A, Nagayama K, Nagayama Y, Tanaka S, Tanaka T. Malignant fibrous histiocytoma with granular cells mimicking a granular cell tumor. Ligth, electron microscopic and immunohistochemical observation of a case. Acta Pathol Jpn 1985; 35: 1555-60.
Nistal M, Paniagua R, Picazo ML, Ceremeno de Giles F, Ramos J. Granular changes in a vascular leiomyosarcoma. Virchows Arch (Pathol Anat) 1980; 386: 239-48.
Rosai J, editor. Ackerman’s Surgical Pathology. St. Louis: Mosby-Yearbook; 1996. p. 2096-97.
Briffod M. Letter to the case. Path Res Pract 1992; 188: 1094-5.
Nakazato Y, Ishizeki J, Takahashi K, Yagamuchi H. Immunohistochemical localization of S-100 protein in granular cell myoblastoma. Cancer 1982; 49: 1624-8.
Kurtin PJ, Bonn DM. Immunohistochemical demonstration of the lysosome-associated glycoprotein CD68 (KP-1) in granular cell tumors and schawannomas. Hum Pathol 1994; 25: 1172-8.
Mazur MT, Shultz JJ, Myers JL. Granular cell tumor. Immunohistochemical analysis of 21 benign tumors and one malignant tumor. Arch Pathol Lab Med 1990; 114: 692-6.
Miettinen M, Lehtonen E, Lehtola H, Ekblom P, Lehto V, Virtanen I. Histogenesis of granular cell tumour. An immunohistochemical and ultrastructural study. J Pathol 1984; 142: 221-9.
Liu Z, Mira JL, Vu H. Diagnosis of malignant granular cell tumor by fine needle aspiration cytology. A case report. Acta Cytol 2001; 45: 1011-21.
Matthews JB, Mason GI. Granular cell myoblastoma: an immunoperoxidase study using a variety of antisera to human carcinoembryonic antigen. Histopathology 1983; 7: 77-82.
Fanburg-Smith JC, Meis-Kindblom JM, Fante R, Kindblomm LG. Malignant granular cell tumor of sotf tissue. Diagnostic criteria and clinicopathological correlation. Am J Surg Pathol 1998; 22: 779-94.
Mittal KR, True LD. Origin of granules in granular cell tumor. Intracellular myelin formation with autodigestion. Arch Pathol Lab Med 1988; 112; 302-3.
Smolle J, Konrad K, Kerl H. Granular cell tumors contain myelin associated glycoprotein. An immunohistochemical study using Leu-7 monoclonal antibody. Virchow Archiv A (Pathol Anat) 1985; 406: 1-5.
Azzopardi JG. Granular-cell «myoblastoma». En: Bennington JL, editor. Problems in Breast Pathology. Major Problems in Pathology. Vol 11. London: WB Saunders Co; 1979. p. 398-9.
Hahn HJ, Iglesias J, Flenker H. Kreuzer G. Granular cell tumor in differentiation diagnosis of tumors of the breast. Pathol Res Pract 1992; 188: 1091-109.
Franzblau MJ, Manwaring M, Plumhof C, Listrom MB, Burgdorf WH. Metastatic breast carcinoma mimicking granular cell tumor. J Cutan Pathol 1989; 16: 218-21.
Buley ID, Gatter KC, Kelly PMA, Heryet A, Millard PR. Granular cell tumor revisited. An immunohistochemical and ultrastructural study. Histopathology 1988; 12: 263-274.
Ingram DL, Mossler JA, Snowhite J, Leight GS, McCarty KS. Granular cell tumors of the breast. Steroid receptor analysis and localization of carcinoembryonic antigen, myoglobin, and S-100 protein. Arch Pathol Lab Med 1984; 108: 897-901.
McCluggage WG. Value of inhibin staining in gynecological pathology. Int J Gynecol Pathol 2001; 20: 79-85.
Kommoss F, Oliva E, Bittinger F, Kirkpatrick CJ, Amin MB, Bhan AK, Young RH, Scully RE. Inhibin-alpha, CD99, HEA125, PLAP, and chromogranin immunoreactivity in testicular neoplasms and the androgen inssensitivity syndrome. Hum Pathol 2000; 31: 1055-61.
Cho EY, Ahn GH. Immunoexpression of inhibin alpha-subunit in adrenal neoplasms. Appl Immunohistochem Mol Morphol 2001; 9: 222-8.
Shih IM, Kurman RJ. Immunohistochemical localization of inhibin-alpha in the placenta and gestational trophoblastic lesion. Int J Gynecol Pathol 1999; 18: 144-50.
Khansur T, Balducci L, Tavassoli M. Granular cell tumor. Clinical spectrum of the benign and malignant entity. Cancer 1987; 60: 220-2.
Moscovic EA, Azar HA. Multiple granular cell tumors: myoblastomas. Cancer 1967; 20: 2032-47.
Rosso R, Scelsi M, Carnevali L. Granular cell traumatic neuroma. A lesion occurring in mastectomy scars. Arch Pathol Lab Med 2000; 124; 709-11.
Jardines L, Cheung L, LiVolsi V, Hendrickson S, Brooks JJ. Malignant granular cell tumors; report of a case and review of the literature. Surgery 1994; 116: 49-54.