
Vol. 36, n.º 4, 2003
REVISTA
ESPAÑOLA DE
Vol. 36, n.º 4, 2003 |
Francisco Javier Ramos Pascual1, María Martino González2, Marta Mayorga Fernández2, Fidel Fernández Fernández2
1 Servicio de Oncología Médica y 2
Departamento de Anatomía Patológica (Patología) del Hospital Universitario
«Marqués de Valdecilla», Santander. apafff@humv.es
(*) Sesión clínico-patológica presentada en la
página web del Club de Autopsias http://eusalud.uninet.edu/cl_autopsias/sesiones.htm
DATOS CLÍNICOS
Dr. Ramos: Se trata de una mujer de 70 años, sin alergias conocidas ni hábitos tóxicos, con antecedentes patológicos de hipertensión arterial crónica, hipoacusia súbita de oído izquierdo e histerectomía por metrorragias secundarias a miomas uterinos.
Hace tres años comienza con disminución progresiva de la visión en ambos ojos, sin otra sintomatología asociada. Valorada en oftalmología, se detecta, en el examen del fondo de ojo, una tumoración subretiniana en ambos globos oculares (fig. 1).
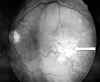
Fig. 1. Fondo de ojo. Tumoración
subretiniana (flecha).
El resto del examen físico es normal, y en las pruebas complementarias destaca:
Hemograma: normal.
Bioquímica: GGT: 93 U/L (normal hasta 40 U/L); fosfatasa alcalina: 144 U/L (normal hasta 100 U/L); resto, normal.
Marcadores tumorales: CA 15.3: 74,9 U/mL (normal hasta 30 U/mL); CA 19.9: 41,5 U/mL (normal hasta 37 U/mL); CEA 3,5 ng/mL (normal hasta 3,4 ng/mL).
Orina (elemental y sedimento): normal.
ECG: normal.
Mamografía bilateral: normal.
Ecografía ocular: masas tumorales en ambos globos oculares, vascularizadas, localizadas a nivel de polo posterior.
Resonancia nuclear magnética de órbitas: tumoración limitada a coroides posterior en ambos globos oculares, de 5 mm en el lado derecho y de 3 mm en el izquierdo (fig. 2).
Radiografía de tórax: engrosamiento hiliar izquierdo.
Tomografía axial computerizada tóraco-abdominal: masa pulmonar de 3 x 2 cm el LII (fig. 3).
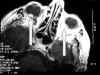
Fig. 2. Resonancia magnética
nuclear. Tumoración coroidea (flechas).
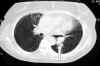
Fig. 3. TAC. Masa pulmonar
(flecha).
Ante la evidencia de una masa pulmonar única, y coroidea bilateral, se intenta realizar una broncofibroscopia para llegar a un diagnóstico histológico. Sin embargo, no es posible por dificultades técnicas. Se opta, entonces, por hacer una punción aspiración con aguja fina (PAAF) de la lesión pulmonar. El estudio citológico informa de células atípicas, redondas y con prolongaciones, mostrando, algunas, dudosa presencia de pigmento que pudiera corresponder a melanina.
En este contexto, se asume el diagnóstico de melanoma coroideo bilateral con una única metástasis pulmonar y, ante la progresiva pérdida de visión, se inicia radioterapia sobre ambos globos oculares. A lo largo del tratamiento aparecen dolores óseos generalizados que responden parcialmente a AINEs. Finalizada la radioterapia, se reevalúa mediante TAC tóraco-abdominal y gammagrafía ósea, constatando progresión tumoral a diversos niveles:
Aparición de nuevas lesiones pulmonares.
Focos hipercaptantes en el esqueleto óseo (fig. 4).
Lesiones ocupantes de espacio hepáticas.

Fig. 4. Gammagrafía ósea.
Múltiples metástasis óseas.
Ante el deterioro clínico, es seguida en su domicilio por la Unidad de Cuidados Paliativos, apareciendo más tarde dolor abdominal, cefalea y hemoptisis autolimitada. Exitus letalis tras cuadro de hemoptisis masiva.
En resumen, se trata de una paciente que comienza, hace un año, con pérdida progresiva de la visión binocular, detectándose, por las técnicas de imagen, una tumoración coroidea bilateral y, más tarde, una masa pulmonar. Dichas técnicas apuntan a un melanoma coroideo bilateral, y una PAAF de la lesión pulmonar sugiere metástasis. Se inicia radioterapia sobre ambos globos oculares, apareciendo dolores óseos generalizados y deterioro clínico progresivo. Una gammagrafía ósea detecta metástasis y por la TAC tóraco-abdominal se visualizan lesiones hepáticas ocupantes de espacio y nuevas lesiones pulmonares. El deterioro clínico impide el tratamiento sistémico, remitiendo a la paciente a la Unidad de Cuidados Paliativos. Finalmente, se añaden los cuadros de hemoptisis que conducen al exitus letalis.
DISCUSIÓN
Dra. de Juan (Oncólogo Médico): ¿Se pensó en otra posibilidad diagnóstica una vez obtenido el resultado de la citología de la PAAF pulmonar?
Dr. Ramos: Dado que las imágenes radiológicas de ambas coroides apuntaban la posibilidad de un melanoma y que el estudio citológico de la masa pulmonar sugería la presencia de células atípicas con pigmento (melanina), a pesar de la rareza del cuadro clínico, se llegó al diagnóstico ya conocido sin plantearse otra posibilidad.
Dra. López-Muñoz (Oncólogo Médico): ¿Si la situación clínica de la paciente lo hubiera permitido, cuál hubiera sido el tratamiento sistémico?
Dr. Ramos: El diagnóstico de melanoma metastásico entraña un pobre pronóstico. Hasta la fecha, ninguna combinación de quimioterapia ha mostrado superioridad al DTIC (dacarbazina) en monoterapia (respuestas: 19%; duración de la respuesta: 4 meses). A pesar del tratamiento, sólo viven <2% de los pacientes a los 6 años. Con la combinación de quimioterápicos se consiguen una mayor tasa de respuestas, pero sin ventajas en la supervivencia. En las dos últimas décadas se han desarrollado combinaciones de quimioterapia junto a IL-2 e IFNa (bioterapia), sin que hasta la fecha haya mejorado la supervivencia en estos pacientes. A día de hoy, las mejores opciones terapéuticas son la monoterapia con DTIC, IFNa y las altas dosis de IL-2.
Dra. López-Muñoz: ¿Qué órganos se ven afectados con mayor frecuencia por un melanoma coroideo?
Dr. Ramos: A diferencia del melanoma cutáneo, en el melanoma intraocular no hay afectación ganglionar al carecer éste de drenaje linfático. El hígado se ve afectado en la práctica totalidad de melanomas uveales metastásicos. Otros órganos que pueden afectarse son pulmón, corazón, tracto gastrointestinal, hueso, SNC, glándulas adrenales, páncreas, ...
DIAGNÓSTICO DIFERENCIAL CLÍNICO
Dr. Ramos: El diagnóstico diferencial fundamental de las tumoraciones coroideas consiste en dilucidar el origen, primario o secundario (metastásico) (tabla 1). La paciente presentaba dos tumoraciones coroideas bilaterales, que podían corresponder a un melanoma (tumor ocular primario más frecuente) o a una metástasis (causa más frecuente de las tumoraciones intraoculares). El carcinoma de mama y el pulmonar constituyen el 75% de neoplasias primarias que metastatizan en los globos oculares. Una mamografía normal descartó razonablemente la posibilidad de un carcinoma de mama. Por TAC torácica se detectó una masa pulmonar cuyo estudio citológico sugirió melanoma. Todo lo anterior, junto a las imágenes ecográficas y a la RNM de los globos oculares, aún inespecíficas, nos llevó al diagnóstico de un melanoma coroideo bilateral con metástasis pulmonar.

DATOS MORFOLÓGICOS
Dra. Martino: Como ya se comentó anteriormente, la PAAF de la lesión pulmonar, realizada un año antes del óbito, mostraba células atípicas, redondas y con prolongaciones, con dudosa presencia de pigmento que podría corresponder a melanina (no definitivo).
Macroscópicamente, en la autopsia encontramos, en ambos globos oculares, sendos nódulos blanquecinos de 0,5 cm (fig. 5). En la sección longitudinal del páncreas aparecen tres nódulos blancos, de contorno irregular y consistencia media, localizados en la cabeza, el cuerpo y la cola (fig. 6). El pulmón izquierdo presenta dos masas y varios nódulos blancos, de contorno irregular, en el lóbulo inferior, adenopatías peribronquiales y un área rojiza parenquimatosa de forma triangular y coincidente con sangre en la tráquea y bronquios (fig. 7). Nódulos tumorales de similares características se encuentran en la columna vertebral, la glándula suprarrenal y el hígado (fig. 8).
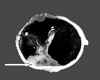
Fig. 5. Nódulo blanquecino en el
globo ocular (flecha).

Fig. 6. Nódulos blanquecinos en el
páncreas.

Fig. 7. Nódulos blanquecinos y un
área rojiza parenquimatosa en el pulmón izquierdo.
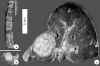
Fig. 8. Nódulos blanquecinos en
los cuerpos vertebrales (a), la suprarrenal (b) y el hígado (c).
Microscópicamente, se trata de una proliferación monomorfa y organoide, de células con citoplasma eosinófilo granular y núcleo redondo, con cromatina en grumos (fig. 9). Existen áreas de células fusiformes. La proteína S-100 y el HMB45 son negativos. En el páncreas se observa, además, una hiperplasia de los islotes de Langerhans (fig. 10) con áreas de atipia citológica. La cromogranina y la sinaptofisina son positivas (fig. 11). La serotonina, focalmente positiva, y la calcitonina, intensamente positiva (fig. 12). Otros marcadores inmunohistológicos, como la gastrina, la somatostatina, la insulina y el glucagón, son negativos. Los nódulos del pulmón, suprarrenal, cuerpos vertebrales, hipófisis e hígado presentan las mismas características histológicas que los del páncreas.
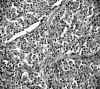
Fig. 9. Proliferación monomorfa y
organoide, de células con citoplasma eosinófilo granular y núcleo redondo.
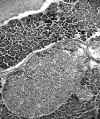
Fig. 10. Hiperplasia de islotes de
Langerhans en el páncreas.
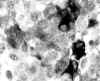
Fig. 11. Tumor pancreático,
sinaptofisina (+).
Fig. 12. Tumor pancreático,
calcitonina (+).
PRINCIPALES DIAGNÓSTICOS ANATOMOPATOLÓGICOS
— Carcinoma neuroendocrino de páncreas, multicéntrico, productor de calcitonina y serotonina, con metástasis en:
Globos oculares.
Pulmón izquierdo.
Ganglios supradiafragmáticos.
Cuerpos vertebrales.
Suprarrenal derecha.
Hipófisis.
Hígado.
Causa de muerte: Hemorragia pulmonar bilateral.
La correlación entre los principales diagnósticos clínicos y anatomopatológicos queda reflejada en la tabla 2.

DISCUSIÓN Y COMENTARIOS FINALES
Dra. López-Brea (Oncólogo Médico): ¿Es una práctica habitual la enucleación de los globos oculares?
Dra. Martino: En nuestro servicio no es una práctica de rutina, sólo se realiza cuando hay sospecha clínica de lesión ocular que es relevante para el diagnóstico final, como sucede en este caso.
Dra. de Juan: ¿Hubiera cambiado el tratamiento ante el diagnóstico de carcinoma neuroendocrino de páncreas avanzado?
Dr. Ramos: El primer problema que plantea el caso es la progresiva pérdida de visión. Independientemente del tipo de tumor, la radioterapia sobre los globos oculares hubiera sido una primera aproximación terapéutica. Por otro lado, el rápido deterioro clínico impidió un posterior tratamiento sistémico (que estaría basado en DTIC). Además, no existe un tratamiento estándar que mejore los resultados de los pacientes en el contexto de un carcinoma neuroendocrino metastásico no funcionante (como es el caso de nuestra paciente); en los funcionantes cabe la posibilidad de manejo con análogos de la somatostatina, para tratar los síndromes provocados por las hormonas secretadas en exceso, sin que ello repercuta en la supervivencia global alcanzada.
Dra. García-Castaño (Oncólogo Médico): ¿Por qué se pensó en un origen pancreático del carcinoma neuroendocrino?
Dra. Martino: Es una pregunta muy interesante, puesto que, al menos en teoría, casi cualquier órgano metastásico podría haber sido el origen del tumor primario. En este caso, el hecho de encontrar en el páncreas islotes hiperplásicos y displásicos, junto a carcinoma neuroendocrino, revela un espectro de cambios progresivos (hiperplasia-displasia-carcinoma) que identifican al páncreas como el sitio del tumor primario.
Dr. Fernández: ¿Cómo estaban los niveles séricos de calcio y fósforo?
Dr. Ramos: Los niveles eran normales, lo que concuerda con su característica de tumor no funcionante.
Dra. Mayorga: ¿Cómo eran las glándulas tiroides, y las paratiroides?
Dra. Martino: El estudio macro y microscópico de ambas glándulas no mostraban alteraciones.
Dr. Fernández: ¿A qué se atribuye la hemorragia pulmonar? ¿Fue ésta la causa inmediata o directa de la muerte?
Dr. Ramos: Creemos que la hemorragia se debió a metástasis en el pulmón y fue, en efecto, la causa inmediata o directa del exitus letalis.
BIBLIOGRAFÍA
Ring HG. Pancreatic carcinoma with metastasis to the optic nerve. Arch Ophthalmol 1967; 77: 798-800.
Solomon SM, Nickel JR. Pancreatic islet cell carcinoma metastatic to the eyes. Am J Ophthalmol 1974; 78: 806-10.
Barsky D. Unusual tumor of the iris: a rare initial clinical manifestation of metastatic adenocarcinoma of the tail of the pancreas. Ann Ophthalmol 1978; 10: 1539-43.
La Rosa S, Sessa F, Capella C, Riva C, Leone BE, Klersy C et al. Prognostic criteria in nonfunctioning pancreatic endocrine tumours. Virchows Arch 1996; 429: 323-33.
Fleury A, Flejou JF, Sauvanet A, Molas G, Vissuzaine C, Hammel P et al. Calcitonin-secreting tumors of the pancreas: about six cases. Pancreas 1998; 16: 545-50.
Weiss L. Analysis of the incidence of intraocular metastasis. Br J Ophthalmol 1993; 77: 149-51.
Shields JA. Metastatic tumors to the uvea. Int Ophthalmol Clin 1993; 33: 155-61.
Krzystolik Z, Jarema A, Roslawska A. Neoplasm metastasis to the eye-diagnosis and therapy. Klin Oczna 1998; 100: 95-100.