
Vol. 37, n.º 2, 2004
REVISTA
ESPAÑOLA DE
Vol. 37, n.º 2, 2004 |
Vicente Romagosa
Anatomía Patológica. Hospital Príncipes de España. C/ Seixa Llarga, s/n. 08907 L’Hospitalet de Llobregat, Barcelona.
RESUMEN
El linfoma cutáneo de células B es un proceso que se observa con relativa frecuencia en la práctica clínica. Es una entidad a menudo infradiagnosticada a causa de su perfil histológico frecuentemente polimorfo y de su baja agresividad. Ello es debido a que la mayor parte de estos procesos neoplásicos corresponden a la entidad que denominamos linfoma SALT, una proliferación linfoide clonal con muy baja capacidad de diseminación que, a menudo, se confunde con procesos inflamatorios, no neoplásicos.
Y, aunque observados con una frecuencia muy inferior, tendremos en cuenta una serie de linfomas cutáneos de célula B de alta agresividad con la intención de resumir ciertos datos del diagnóstico diferencial de estas entidades, sin olvidar la introducción de algunos comentarios acerca de la naturaleza de aquellos procesos realmente inflamatorios, no neoplásicos.
SUMMARY
Primary B-cell cutaneous lymphoma is a rather frequent finding in clinical practice, that is often underdiagnosed due to its somewhat polymorphic histological picture and its very low grade of malignancy. Since most of these neoplastic processes belong to the entity that we call SALT lymphomas (clonal lymphoid proliferations with very low potential of dissemination) they are frequently are mistaken for inflammatory, non-neoplastic processes.
Although seen much less frequently, several high grade, very aggressive B-cell cutaneous lymphomas are also described in our review of these neoplastic processes. We present some insights into the differential diagnosis of these proliferations and comment on the nature of the real non-neoplastic, reactive entities.
INTRODUCCIÓN
La afectación primaria de la piel por linfomas B es frecuente y, en general, suele implicar un pronóstico benigno, al tratarse de una enfermedad con escasa tendencia a la diseminación sistémica y fácilmente controlable con terapia local, cirugía y/o radioterapia. Si bien la mayoría de linfomas B primarios cutáneos muestran el citado comportamiento clínico, por contraste, existen neoplasias de células B de alta agresividad, difícilmente controlables con terapia sistémica. A estos dos extremos del espectro, cabe añadir la dificultad de diferenciar procesos reactivos, no neoplásicos y separar aquellas neoplasias linfoides sistémicas que, eventualmente, pueden debutar como una lesión cutánea.
Se considera como primario aquel tumor de origen cutáneo en el que el paciente no desarrolla afectación en otros territorios extracutáneos en los seis meses posteriores al diagnóstico. Creemos que esta definición merece, sin embargo, algunas acotaciones: ciertamente, debe considerarse como portador de un linfoma sistémico a aquel paciente que, en este lapso de tiempo, desarrolla enfermedad ganglionar. Pero, aunque muy infrecuentemente, hemos observado casos de linfoma SALT con afectación medular durante el proceso de estadiaje del paciente, sin que tal hallazgo, por sí sólo, haya modificado el comportamiento clínico del mismo (1).
CLASIFICACIONES
Es llamativo observar la persistencia de discrepancias considerables entre los distintos grupos de trabajo dedicados al estudio de linfomas cutáneos (2-8). Probablemente, la razón principal de tal discrepancia, radica en el manifiesto polimorfismo que suele adoptar el más frecuente de los linfomas cutáneos, el Linfoma de células de la zona marginal extranodal (SALT, por Skin Related Lymphoid Tissue). Tal como discutiremos a continuación, parte de los linfomas linfoplasmocitoides, los llamados plasmocitomas cutáneos y un buen número de linfomas foliculares, representan probablemente variantes histológicas diversas de los linfomas SALT (9-11).
Existen también entidades clínico-patológicas que parecen poseer una personalidad propia y que, de alguna manera, desafían los criterios puramente histológicos que solemos manejar los patólogos. Nos referimos especialmente a linfomas con predominio de células grandes: el llamado reticulohistiocitoma del dorso o linfoma de Crosti es una entidad de muy baja agresividad y un comportamiento clínico similar al de los linfomas SALT, mientras que el linfoma de células grandes de las piernas, muestra un comportamiento sumamente agresivo, con tendencia a la diseminación precoz.
Vamos a circunscribir este artículo a la descripción de las entidades citadas, sin olvidar un comentario acerca de los llamados Linfocitomas o Pseudo-linfomas y su eventual relación con lesiones neoplásicas.
LINFOMA DE CÉLULAS DE LA ZONA MARGINAL EXTRANODAL (SALT)
La presentación clínica mas frecuente es en forma de placas infiltradas, nódulos o tumores de coloración rojo oscuro o violáceo, localizados y asintomáticos, generalmente circunscritos al tronco o a las extremidades y, mas infrecuentemente, en cabeza y cuello. A menudo, las lesiones están rodeadas de un halo eritematoso con pequeñas pápulas en su superficie.
Histológicamente se observa un infiltrado nodular o difuso de predominio en dermis profundo, eventualmente alcanzando hipodermis (patrón «bottom heavy») (fig. 1) o bien mas denso en dermis superficial, dejando una zona libre subepidérmica (zona de Grenz) (patrón «top heavy»).
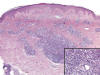
Fig 1: Infiltrado linfoide nodular con
tendencia a crecer en profundidad (bottom-heavy). Afectación de glándulas
ecrinas (inset).
El infiltrado está constituido por una mezcla de células linfoides pequeñas de citoplasma acuoso (centrocitoides o B-monocitoides) entremezcladas con células de aspecto transformado (células «blastoides») acompañadas de numerosos linfocitos pequeños de fenotipo T que, en algunos momentos llegan a oscurecer la población de células neoplásicas. Las células plasmáticas, muy numerosas en ciertas fases de la enfermedad, tienden a envolver a la población linfocitaria, formando capas compactas alrededor de la misma. A menudo puede demostrarse restricción de cadenas ligeras en estas células que coincide con la expresión en superficie de las células centrocitoides o B-monocitoides. La presencia de folículos linfoides, a menudo colonizados por la población neoplásica, es frecuente y se pone mejor de manifiesto mediante tinciones para células dendríticas. El CD10 tiñe a menudo los restos de centros germinales y no debe confundirse con la expresión por parte de células neoplásicas que, en nuestra experiencia, en ningún caso se ha puesto de manifiesto.
Se pueden formar complejos linfoepiteliales, mas frecuentemente en relación a glándulas ecrinas y, raramente, con el complejo pilo-sebáceo. Es muy característica la expresión de CD30 por parte de las células grandes «blastoides» de fenotipo B que interpretamos como signo de activación (fig. 2) (1).
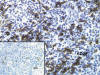
Fig 2: Las células neoplásicas con
expresión de CD-20 son relativamente escasas respecto a las célula T
acompañantes. Las células grandes expresan CD-30 (inset).
La proteina S100 muestra la presencia de una numerosa población de células presentadoras de antígeno (dendríticas interdigitantes y células de Langerhans) que probablemente juega un papel importante en la génesis de estos procesos. Se ha especulado con que la presencia de Borrelia burgdorferi puede jugar un papel similar al que, en el estómago, tiene la presencia de Helicobacter pylorii (12).
La sobreexpresión de bcl-2 es muy frecuente en estas proliferaciones, aunque la mezcla con células T-memoria acompañantes, a veces muy prominente, como se ha dicho, dificulta la lectura de esta tinción. En algunos casos se demuestra reordenación de bcl-2 mediante técnicas de PCR. Interpretamos este fenómeno por la marcada versatilidad de la célula B de la zona marginal. En ninguno de nuestros casos con expresión molecular de bcl-2, existe el menor rasgo que pueda sugerir un linfoma folicular y, en todos ellos, el CD10 ha sido negativo. Es cierto que otros grupos interpretan la alteración molecular como signo inequívoco del origen centro-folicular de la neoplasia (aún con ausencia de expresión de CD10), pero si ello es así, no cabe duda de que la «célula centrofolicular cutánea» tiene un comportamiento biológico muy distinto de la que prolifera en otros tejidos.
En una serie de nuestros casos publicada recientemente (1), sólo 14 de los 22 casos reportados mostraron reordenación para la cadena pesada de las inmunoglobulinas. Creemos que el comportamiento de tales estudios moleculares, como ocurre con el estudio de clonalidad mediante el marcaje de cadenas ligeras en estos casos, es variable con la evolución de la enfermedad y que la negatividad de alguno de los dos estudios, en presencia de hallazgos histológicos característicos, no debe descartar el diagnóstico.
Recientemente se han descrito variantes de la translocación t(14;18)(q32;q21), característica del linfoma folicular, en pacientes con linfoma MALT gástrico. Otras alteraciones citogenéticas observadas en estos linfomas, como la t(11;18)(q21;q21), que implican la sobreexpresión de bcl-10, a consecuencia de la activación de NF-kB se han correlacionado con mala respuesta al tratamiento antibiótico contra H. pylorii (13,14). En nuestro grupo de trabajo, se ha empezado a estudiar el comportamiento de bcl-10 en los casos de linfoma SALT y resulta llamativo el dato, todavía en fase de estudio, de que, sólo cinco pacientes mostraron positividad a bcl-10, pero tres de ellos fueron los únicos que tuvieron un comportamiento agresivo, falleciendo a consecuencia de la diseminación de su linfoma.
LINFOMA FOLICULAR PRIMARIO CUTÁNEO
Esta categoría está reconocida en la clasificación de la OMS como una variante del linfoma folicular sistémico y que diferiría del mismo por la falta frecuente de expresión de bcl-2 (15). No cabe duda de la existencia de este tipo histológico, de presentación clínica mas frecuente en cabeza y cuello y con expresión constante (que en nuestro grupo consideramos imprescindible) de CD-10. Algunos grupos consideran que este linfoma es el mas frecuente entre los linfomas primarios B cutáneos (2,6), mientras otros grupos, entre los que nos contamos, prefieren pensar que, a menudo, algunos linfomas SALT muestran un patrón de hiperplasia folicular reactiva en fase de colonización por las verdaderas células neoplásicas que rodearían a estos centros germinales. Dichos agregados celulares expresan fisiológicamente CD-10 y, naturalmente, son negativos a bcl-2, de donde podría surgir la discrepancia (figs. 3 y 4).
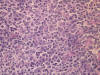
Fig 3: Linfoma folicular. La imagen a gran
aumento es indistinguible de la que puede observarse en un linfoma nodal.
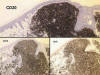
Fig 4: Coexpresión intensa de CD-20, CD-10
y bcl-2 en un linfoma folicular cutáneo.
Ya hemos comentado que la presencia de translocación t(14;18)(q32;q21) puede demostrarse en algunos casos de linfoma SALT, por lo que este dato no es de utilidad en el diagnóstico diferencial. Creemos que sólo aquellos casos que muestran un patrón folicular, sin evidencia de diferenciación plasmocitaria o B-monocitoide y con expresión intensa de CD-10, deben ser considerados como linfomas foliculares. La presencia de células activadas CD-30 positivas, creemos que no es un dato diferencial, ya que hemos tenido ocasión de observarlo en casos que, por otra parte, cumplían criterios de linfoma folicular.
LINFOMA DE CROSTI. RETICULOHISTIOCITOMA DEL
DORSOSe trata de una neoplasia autolimitada, de baja agresividad, que muestra un patrón histológico difuso con un predominio de células grandes de rasgos histiocitarios pero que expresan CD-20 y otros marcadores de línea B. La ausencia de epidermotropismo y la frecuente afectación de los anejos, así como su comportamiento clínico, hacen pensar en una neoplasia linfoide cercana al espectro de los linfomas de células de la zona marginal (fig. 5).
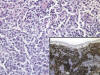
Fig 5: Linfoma de Crosti. Se observa el
predominio de células grandes de hábito histiocitoide. La expresión de CD-20 es
marcada en estas células (inset).
Si bien la localización en la espalda de la mayor parte de estas neoplasias parecería justificar el nombre de la entidad, hemos tenido oportunidad de ver algún caso en que, siendo los hallazgos clínicos e histológicos compatibles con el diagnóstico, la localización, en el tórax, parecían desafiar el diagnóstico. Ello refuerza nuestra creencia de que gran parte de estos casos corresponden a variantes citológicas de linfomas de células de la zona marginal que, una vez mas, demuestran su gran capacidad de mimetismo.
LINFOMA DE CÉLULA GRANDE DE LAS
PIERNASEl linfoma de célula grande, en cualquier localización, es una neoplasia de alta agresividad, curable con tratamientos agresivos. Cuando una neoplasia linfoide de tales características asienta en la piel, parece que la localización del primario en las piernas significa un comportamiento más agresivo que los de cualquier otra localización cutánea. El hecho de que la mera localización de una neoplasia pueda influir en el pronóstico de la misma, cuando se trata de territorios equivalentes desde un punto de vista anatómico, se enfrenta claramente con la concepción unitaria que, sobre los linfomas, ha venido desarrollando el Grupo Internacional de Linfomas a través, primero de la clasificación REAL y, posteriormente, de la de la OMS.
Pero la evidencia clínica parece apuntar a que aquellos linfomas primarios de célula grande que debutan en las extremidades inferiores son, a menudo, refractarios a la quimioterapia intensiva y que suelen diseminarse en un período de tiempo que oscila entre los 12 y los 24 meses, con afectación de territorios, por otra parte infrecuentes en linfomas de célula grande, como por ejemplo los testículos.
Se trata de linfomas que suelen expresar CD-20 y CD-79a y que, en la experiencia de nuestro grupo, no parecen mostrar una tendencia distinta a la de otros linfomas de célula grande no cutáneos en cuanto a la expresión de marcadores de pronóstico, como son bcl-2, bcl-6, Ki-67 o p-53. La serie es, sin embargo, muy pequeña como para sacar conclusiones respecto a la personalidad diferencial de este linfoma.
PSEUDOLINFOMA/LINFOCITOMA
Finalmente, queda una pregunta qué plantearse: ¿en qué situación quedan los procesos reactivos indistintamente denominados Linfocitoma cutis o Pseudolinfoma cutáneo o infiltración linfocitaria de Jessner? (16). Gran parte de los últimos probablemente corresponden a formas de lupus discoide. En cuanto a los primeros, creemos que se está repitiendo la historia que ocurrió con los pseudolinfomas gástricos y el linfoma MALT. Gran parte de aquellos procesos que se consideraban pseudotumorales y que, eventualmente, «evolucionaban a linfoma», eran en realidad procesos clonales de muy baja agresividad que, solamente con los medios diagnósticos que se han adquirido en los últimos 20 años, ha podido demostrarse su naturaleza neoplásica.
Pero existen procesos de naturaleza inflamatoria que simulan linfoma SALT. Ciertas picaduras de artrópodo en el huésped adecuado pueden simular linfoma. O algunos nevos melanocíticos en regresión pueden plantear dudas diagnósticas. Es por ello que el papel del dermatólogo experimentado en estos procesos es crucial para orientar, mediante una adecuada evaluación de los datos clínicos, la posible naturaleza neoplásica o reactiva de una lesión cutánea.
BIBLIOGRAFÍA
Servitje O, Gallardo F, Estrach Tet al ,Primary ccutaneous marginal zona B-cell lymphoma: a clinical, histopathological, immunophenotypic and molecular genetic study of 22 cases. Br J Dermatol 2002; 147: 1147-58.
Willemze R, Kerl H, Sterry W et al. EORTC classification for primary cutaneous lymphomas: a proposal from the Cutaneous Lymphoma Study Group of the European Organization for Research and Treatment of Cancer. Blood 1997; 90, 354-71.
Cerroni L, Signoretti S, Hofler G et al. Primary cutaneous marginal zone B-cell lymphoma: a recently described entity of low-grade malignant cutaneous B-cell lymphoma. Am J Surg Pathol 1997; 21: 1307-15.
De la Fouchardière A, Balme B, Chouvet B et al. Primary cutaneous margina zone B-cell lymphoma : a report of 9 cases. J Amer Acad Dermatol 1999; 41: 181-8.
Tomaszewsky MM, Abbondanzo SL, Lupton GP. Extranodal marginal zone B-cell lymphoma of the skin: a morphologic and immunophenotypic study of 11 cases. Am J Dermatopathol 2000; 22: 205-11.
Willemze R, Rijlaarsdam JU, Meijer CJ. Are most primary cutaneous B-cell lymphomas «marginal cell lymphomas»? Br J Dermatol 1995; 133: 950-2.
Slater DN. MALT and SALT: the clue to cutaneous B-cell lymphoprolipherative disease. Br J Dermatol 1994; 131: 557-61.
Slater DN. Primary cutaneous B-cell lymphomas.Arch Dermatol 1997; 133: 1604-5.
Santucci M, Pimpinelli N, Arganini L. Primary cutaneous B-cell lymphoma: a unique type of low-grade lymphoma. Clinicopathologic and immunologic study of 83 cases. Cancer 1991; 67: 2311-26.
Willemze R, Meijer CJ, Sentis HJ et al. Primary cutaneous large cell lymphomas of follicular center cell origin. A clinical follow-up study of nineteen patients. J Am Acad Dermatol 1987; 16: 518-26.
Rijlaarsdam JU, van der Putte SC, Berti E et al. Cutaneous immunocytomas: a clinicopathologic study of 26 cases. Histopathology 1993; 23: 117-25.
Stolte M, Bayerdörffer E, Morgner A et al. Helicobacter and gastric MALT lymphoma. Gut 2002; 50(Suppl III): S19-24.
Auer IA, Gascoyne RD, Connors JM et al. T(11 ;18)(q21 ;q21.1) is the most common translocation in MALT lymphomas. Ann Oncol 1997; 8: 979-85.
Ye H, Dogan A, Karran L et al. Bcl-10 expression in normal and neoplastic lymphoid tissue. Nuclear localization in MALT lymphoma. Am J Pathol 2000; 157: 1147-54.
Jaffe ES, Harris NL, Stein H, Vardiman JW. World Health Organization Classification of Tumours. Pathology and Genetics of Tumours of Hematopoyetic andLymphoid Tissues. Lyon: IRCC Press, 2001.
Schmid U, Eckert F, Griesser H et al. Cutaneous follicular lymphoid hyperplasia with monotypic plasma cells. A clinicopathologic study of 18 patients. Am J Surg Pathol 1995; 19: 12-20.