
Vol. 37, n.º 3, 2004
REVISTA
ESPAÑOLA DE
Vol. 37, n.º 3, 2004 |
J. Fernando González-Palacios Martínez
Servicio de Anatomía Patológica. Hospital Ramón y Cajal. Madrid. jglezpalacios.hrc@salud.madrid.org
RESUMEN
Recientemente se han propuesto (American Joint Committee on Cancer, AJCC) cambios de importancia en la clasificación TNM del cáncer mamario dirigidos a una más completa y significativa estratificación de las pacientes atendiendo a las nuevas técnicas diagnósticas y a la introducción de la biopsia del ganglio centinela. Los principales cambios se refieren a: distinción basada en el tamaño tumoral entre micrometástasis y células tumorales aisladas; empleo de identificadores de las nuevas técnicas, inmunohistoquímicas y moleculares, utilizadas; clasificación del estado ganglionar según el número de ganglios con metástasis y una nueva clasificación de las metástasis de ganglios infraclaviculares, de la cadena mamaria interna y supraclaviculares.
Palabras clave: Cáncer de mama, TNM.
SUMMARY
Three years ago a Breast Task Force was constituted to serve in an advisory role to the American Joint Committee on Cancer (AJCC) for the revision of the breast cancer chapter in the sixth edition of the Cancer Staging Manual. The major changes included the following: size based discrimination between micrometastases and isolated tumor cells; identifiers to indicate usage of innovative technical approaches, classification of lymph node status by number of involved axillary lymph nodes; a new classifications for metastasis to the infraclavicular, internal mammary, and supraclavicular lymph nodes. The current edition of the International Union Against Cancer (UICC) staging system corresponds exactly with that of the American Joint Committee on Cancer. This revised staging system is focused on stratifying patients into clinically meaningful prognostic subsets.
Key words: Breast cancer staging, TNM.
La clasificación TNM empleada para determinar la extensión anatómica de las neoplasias basada en apreciaciones clínicas (cTNM) o patológicas, anatomopatológicas, (pTNM) ideada por Pierre Denoix, en el Instituto Gustav Roussy, hace más de 50 años, se utiliza en el cáncer mamario desde hace 25 años. Los continuos cambios en el diagnóstico y tratamiento hacen que se introduzcan reiteradas modificaciones en esa clasificación (1,2). Recientemente se ha propuesto por la American Joint Committee on Cancer (AJCC) su revisión para incorporarla en la sexta edición del Cancer Staging Manual recomendádose a los registros de tumores su utilización a partir de enero de 2003. La nueva versión cuenta con la ventaja de que se corresponde exactamente con la edición actual del sistema de gradación de la International Union Against Cancer (UICC) lo que facilita el intercambio de información entre centros oncológicos.
Las modificaciones incorporadas a la edición anterior de 1997 (3), atienden a: 1). Los cambios surgidos por el uso generalizado de la mamografía de cribado; muchos de los cánceres se descubren cuando tienen pequeño tamaño, pero aún así el comportamiento de esos tumores pequeños es heterogéneo. 2) La incorporación de la técnica del ganglio centinela en el tratamiento estándar del carcinoma de mama temprano, con el uso de técnicas inmunohistoquímicas y moleculares para la detección de metástasis; éstas a veces son lesiones tan pequeñas que hace años no se hubieran detectado. 3) La experiencia acumulada, soportada por nuevos datos, que cuestiona la importancia clínica de algunas localizaciones metastásicas, como en ganglios del nivel III axilar (infraclaviculares) o fuera de la axila (ganglios supraclaviculares y de la cadena mamaria interna).
MICROMETÁSTASIS Y CÉLULAS TUMORALES AISLADAS
El empleo de técnicas inmunohistoquímicas y moleculares permite detectar grupos de células o aún células neoplásicas aisladas en los ganglios linfáticos. Siguiendo la 5.ª edición del AJCC Cancer Staging Manual estas metástasis deben considerarse micrometástasis, si no superan los 2,0 mm de tamaño y clasificarse como pN1. Sin embargo, su significación biológica es mal conocida, más aún teniendo en cuenta que no se ha evaluado específicamente, por lo que es conveniente su consideración particular. Así la 6.ª edición del AJCC Cancer Staging Manual asigna un tamaño inferior límite a las micrometástasis definiéndolas como metástasis mayores de 0,2 mm de diámetro e inferiores a 2,0 mm que se clasifican como pN1mi (fig. 1). Los depósitos de células menores se consideran células tumorales aisladas (CTA) y por el momento se clasifican como N0 (fig. 2).

Fig. 1. Metástasis ganglionar >0,2 mm, pero <2 mm: MICROMETÁSTASIS (pN1m)
(inmunohistoquímica con citoqueratina AE1/AE3).
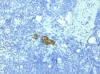
Fig. 2. Ganglio con cúmulo de células neoplásicas <0,2 mm: CÉLULAS
TUMORALES AISLADAS (CTM): pN0 (i+) (inmunohistoquímica con citoqueratina
AE1/AE3).
-Micrometástasis (N1 mi): <2 mm;
>0,2 mm (pN1mi)
CTA: <0,2 mm (pN0)
Las células tumorales aisladas generalmente no muestran respuesta tisular, estroma, ni actividad proliferativa y aunque pueden ser detectadas por técnica convencional con hematoxilina-eosina (HE), generalmente se evidencian con inmunohistoquímica (IHQ) o mediante técnicas moleculares. En la clasificación actual se añade el símbolo (i) o (mol), para los casos así detectados, que son negativos con HE. Por ejemplo, pN0(i+) indicaría un caso con un depósito de células neoplásicas inferior a 0,2 mm en su mayor dimensión, identificado por IHQ, negativo con HE o pN1mi (i+) indicaría una metástasis detectada con IHQ, negativa con HE, que tiene un diámetro mayor superior a 0,2 mm, pero inferior a 2 mm.
NÚMERO DE GANGLIOS CON METÁSTASIS
El número absoluto de ganglios positivos es uno de los factores pronóstico más importante y así se tiene en cuenta en la clasificación pN. Pacientes con uno a tres ganglios axilares positivos (con al menos un cúmulo neoplásico mayor de 2 mm y todos mayores de 0,2 mm) se clasifican como pN1a, pacientes con cuatro a nueve ganglios axilares positivos como pN2a y pacientes con diez o más ganglios axilares positivos, como pN3a. La decisión de dividir a los pacientes en estos tres grupos se basa en resultados de estudios previos (4,5).
METÁSTASIS EN GANGLIOS INFRACLAVICULARES
El estado de los ganglios supraclaviculares, ganglios del nivel III o internos al borde medial del músculo pectoral menor, en ediciones anteriores se agrupaban con el resto de los ganglios axilares. Debido a que su afectación implica un pronóstico muy desfavorable (6) se ha recomendado que se particularice en la clasificación como N3a.
METÁSTASIS EN GANGLIOS NO AXILARES
En ediciones anteriores la afectación de ganglios de la cadena mamaria interna (MI) se clasificaba como N3. Estudios recientes (7) demuestran que el impacto en la supervivencia de los ganglios MI positivos depende del estado de los ganglios axilares y también está asociado al tamaño de esos ganglios MI positivos. Así ganglios MI positivos detectados con la técnica del ganglio centinela, pero no clínicamente o por estudios de imagen (distintos a la linfoescintigrafía), se clasifican como pN1b en ausencia de ganglios axilares positivos, pN1c si se asocian a uno a tres ganglios axilares positivos y pN3b con cuatro o más ganglios axilares positivos. La existencia de ganglios MI positivos detectados por examen clínico o estudios de imagen (distintos a la linfoescintigrafía) se clasifica como N2b/pN2b en ausencia de ganglios axilares positivos y como N3b/pN3b si hay ganglios axilares positivos.
La existencia de metástasis en ganglios supraclaviculares tradicionalmente se ha asociado con mal pronóstico considerándose como metástasis a distancia (M1), lo que puede implicar disminuir el esfuerzo terapéutico, no justificado a la vista de recientes estudios (8). Por ello se reclasifican las metástasis en ganglios supraclaviculares como N3c/pN3c, con un nuevo estadio (IIIC) que incluye cualquier T y N3 (pN3a, pN3b, pN3c).
GANGLIO CENTINELA
Si la clasificación está basada solamente en el ganglio centinela, sin posterior disección axilar, se designa adicionalmente como (sn).
GRADO HISTOLÓGICO
En la revisión se valora muy favorablemente la utilización, como un importante dato pronóstico, del grado histológico combinado de Nottingham, propuesto por Elston y Ellis (9). No obstante se considera prematura su incorporación a la clasificación TNM.



BIBLIOGRAFÍA
Fleming ID, Cooper JS, Henson DE, et al (eds). AJCC Cancer Staging Manual 5.ª ed. Philadelphia, PA: Lippincott-Raven; 1997.
Greene FL, Page DL, Fleming ID, et al. AJCC Cancer Staging Manual, 6.ª ed. New York, NY: Springer-Verlag; 2002.
Singletary SE, Allred C, Ashley P, et al. Revision of the American Joint Committee on Cancer Staging System for breast cancer. J Clin Oncol 2002; 20: 3628-36.
Carter CL, Allen C, Henson DE. Relation of tumor size, lymph node status, and survival in 24 740 breast cancer cases. Cancer 1989; 63: 181-7.
Nemoto, Vana J, Bedwani RN, et al. Management and survival of female breast cancer: Results of a national survey by the American College of Surgeons. Cancer 1980; 45: 2917-24.
Newman LA, Kuerer HM, Fornage B, et al. Adverse prognostic significance of infraclavicular lymph nodes detected by ultrasonography in patients with locally advanced breast cancer. Am J Surg 2001; 181: 313-8.
Klauber-DeMore N, Bevilacqua JLB, Van Zee KJ, et al. Comprehensive review of the management of internal mammary lymph node metastases in breast cancer. J Am Coll Surg 2001; 193: 547-55.
Olivotto IA, Chua B, Allan SJ, et al. Long-term survival of patients with supraclavicular metastases at diagnosis of breast cancer. J Clin Oncol 2003; 21: 851-4.
Elston CW, Ellis IO. Pathological prognostic factors in breast cancer: I. The value of histologic grade in breast cancer-Experience from a large study with long -term follow-up. Histopathology 1991; 19: 403-10.