
Vol. 37, n.º 3, 2004
REVISTA
ESPAÑOLA DE
Vol. 37, n.º 3, 2004 |
Pablo Pérez-Alonso1, José Ignacio Blanco Álvarez2, Sonsoles Aso Manso3
Servicio de 1Anatomía Patológica y 2Cirugía General y Digestiva, Hospital Medina del Campo, Valladolid. 3Departamento de Anatomía Patológica, Hospital Universitario La Paz, Madrid. pperez@hmdc.sacyl.es
Sr. Director:
El tumor adenocarcinoide de apéndice ileocecal es una lesión poco frecuente, rara vez diagnosticado antes de la cirugía y con un pronóstico intermedio entre el carcinoide clásico y el adenocarcinoma. Presentamos un caso que, por los antecedentes personales del paciente, supuso una dificultad añadida al diagnóstico de esta entidad tan poco frecuente.
Varón de 67 años que acude a Urgencias por presentar dolor en fosa iliaca derecha. El único antecedente personal era una prostatectomía radical realizada en otro Centro dos años antes por adenocarcinoma de próstata moderadamente diferenciado. En la exploración presentaba signo de Blumberg positivo en fosa iliaca derecha. La analítica era normal a excepción de una ligera leucocitosis con desviación izquierda. La ecografía mostraba una imagen compatible con apendicitis aguda. Se realizó apendicectomía abierta urgente. Existían adherencias firmes entre apéndice, pared abdominal anterior y colon, que se liberaron digitalmente. El apéndice estaba inflamado, con signos de necrosis en la punta. Se efectuó apendicectomía reglada y cierre por planos.
El apéndice medía 7 x 1 cm, plegado sobre sí mismo, con fibrina en la serosa. No existían lesiones macroscópicas en la pared. Microscópicamente, el tumor presentaba un tamaño estimado de 8 x 8 mm, afectaba al tercio medio del apéndice y estaba constituido por una proliferación epitelial que formaba glándulas de pequeño tamaño que infiltraban toda la mucosa, submucosa y muscular propia apendicular sin destrucción tisular ni reacción desmoplásica del estroma, con afectación focal de la serosa y respetando el mesoapéndice y el borde quirúrgico (fig. 1). Existía escaso pleomorfismo nuclear, sin mitosis. La punta apendicular estaba necrosada, con abundante inflamación aguda. El tumor mostraba expresión citoplasmática y de membrana de cromogranina y sinaptofisina; no existía expresión de antígeno prostático específico ni fosfatasa ácida prostática. El diagnóstico fue tumor adenocarcinoide de apéndice ileocecal y apendicitis aguda gangrenosa.
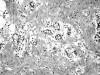
Fig. 1. Imagen representativa del tumor formado en su totalidad por
glándulas de pequeño tamaño, revestidas por células mucosas, algunas en anillo
de sello, entremezcladas con células cúbicas de pequeño tamaño y escaso
citoplasma, sin atipias, que infiltran la muscular propia apendicular.
El tumor adenocarcinoide apendicular (carcinoide de células caliciformes, carcinoide mucinoso, carcinoma de células de la cripta) es un tumor poco frecuente (2-5% de los tumores apendiculares) (1-5). Afecta por igual a ambos sexos y es más frecuente entre la sexta y la séptima década de vida (1,3). Probablemente deriva de una célula madre pluripotencial de las criptas que se diferencia hacia célula endocrina y célula mucosecretora (1,2,4,5). El diagnóstico preoperatorio es muy raro (2,4,5). La mayoría de los pacientes presentan sintomatología apendicular aguda o dolor en fosa iliaca derecha con o sin masa palpable (1,3,6). Algunos casos debutan con masas ováricas sugestivas de tumor primario ovárico o tumor de Krukenberg (4,6) ya que es típico de este tumor que metastatize en ovarios y se disemine difusamente en la cavidad peritoneal (1,6,7). Hasta un 20% se diagnostican de manera incidental en las piezas de apendicectomía (3). Macroscópicamente, el apéndice puede ser normal o mostrar una lesión localizada de tamaño variable, generalmente en la punta del apéndice, o presentar afectación apendicular difusa (3,6). Histológicamente está formado por glándulas compuestas por células con distintos grados de diferenciación mucinosa, incluso con células en anillo de sello. Las células endocrinas se entremezclan con las células mucosas; la proporción de células endocrinas es menor que en el carcinoide clásico. Las glándulas infiltran sin destruir las estructuras preexistentes ni provocar reacción desmoplásica del estroma. La escasez de pleomorfismo nuclear y actividad mitótica, la ausencia de áreas sólidas o cribiformes y de desmoplasia y el hecho de que las glándulas infiltren sin destrucción del tejido rodeadas por estroma o músculo liso, sirve para diferenciar el tumor adenocarcinoide del adenocarcinoma. El tumor expresa al menos uno de los marcadores de tumores endocrinos, tales como cromogranina, sinaptofisina, enolasa neuronal específica, etc. (1,5).
El diagnóstico diferencial incluye el adenocarcinoma mucinoso, el adenocarcinoma con células en anillo de sello y el tumor mixto carcinoide-adenocarcinoma. Dados los antecedentes personales del paciente tuvimos que descartar una metástasis por adenocarcinoma de próstata, ya que existen subtipos histológicos poco frecuentes de adenocarcinoma, que pueden presentar células en anillo de sello. La ausencia de las características nucleares y arquitecturales del adenocarcinoma de próstata junto con la ausencia de expresión de antígeno prostático específico y fosfatasa ácida prostática en el tumor, descartó dicha posibilidad.
El pronóstico es intermedio entre el carcinoide y el adenocarcinoma bien diferenciado, con una supervivencia a los 5 años que oscila entre el 60 y el 84% (1,3,6,7).
El tratamiento es controvertido. No está claro en qué situaciones hay que realizar apendicectomía simple o hemicolectomía derecha, ya que se trata de un tumor más agresivo que el carcinoide y con mayor riesgo de metástasis (4,7). La apendicectomía simple es curativa en muchos casos (1), pero es recomendable la hemicolectomía derecha cuando exista afectación de la base apendicular y/o ciego, márgenes de resección positivos, tamaño tumoral mayor de 2 cm, mucocele, atipia severa, o más de 2 mitosis por campo (1-3,7). La presencia de invasión linfática y perineural o el tamaño no son condicionantes para realizar hemicolectomía según algunos autores (4,6). La mayoría de los autores abogan por realizar una ooforectomía bilateral por la gran propensión a desarrollar metástasis ováricas (1,4,6). Incluso en los casos de tumor de Krukenberg de origen desconocido recomiendan realizar apendicectomía para despistar un posible adenocarcinoide apendicular (4,6). El papel de la quimioterapia no está claramente establecido (1,6). Hay que realizar seguimiento postcirugía para detectar recidiva local o metástasis a distancia (1,3).
BIBLIOGRAFÍA
Cerdán G, Artigas V, Llauradó JM, Rodríguez M, Sancho FJ, Moral A, et al. Adenocarcinoide apendicular: factores pronósticos y actitud terapéutica. Rev Esp Enferm Dig 2001; 93: 190-1.
Jiménez-Pérez FJ, Echarri A, Borda F. Colonocospic appearance of an adenocarcinoid of the vermiform appendix. Endoscopy 1996; 28: 270.
Torres-Melero J, García-Calvo M, Blanco S, Navarro MD, Sánchez-Pernaute A, Suárez B, et al. Tumor adenocarcinoide de apéndice vermiforme. Rev Esp Enferm Dig 1994; 86: 771-3.
Rutledge RH, Alexander JW. Primary appendiceal malignancies: rare but important. Surgery 1992; 111: 244-50.
Kanthan R, Saxena A, Kanthan SC. Goblet cell carcinoids of the appendix: immunophenotype and ultrastructural study. Arch Pathol Lab Med 2001; 125: 386-90.
Butler JA, Houshiar A, Lin F, Wilson SE. Goblet cell carcinoid of the appendix. Am J Surg 1994; 168: 685-7.
Gouzi JL, Laigneau P, Delalande JP, Flamant Y, Bloom E, Oberlin P, et al. Indications for right hemicolectomy in carcinoid tumors of the appendix. The French Associations for Surgical Research. Surg Gynecol Obstet 1993; 176: 543-7.