
Vol. 37, n.º 4, 2004
REVISTA
ESPAÑOLA DE
Vol. 37, n.º 4, 2004 |
Francisco Javier Torres Gómez, Encarnación Lag Asturiano, Francisco Javier Torres Olivera, José Luis Villar Rodríguez
Hospital Universitario Virgen Macarena. Avda. Dr. Fedriani, s/n. Sevilla. javiertorresgomez@yahoo.com
RESUMEN
El mioepitelioma de glándula salivar es una neoplasia benigna poco frecuente, que afecta principalmente a la parótida (40 %) y que muestra exclusivamente diferenciación mioepitelial. Histológicamente, exhibe variables patrones arquitecturales y diferentes tipos celulares, que pueden ser dominantes o entremezclarse en diferentes proporciones, lo que condiciona una marcada variabilidad morfológica en el material obtenido por PAAF y con frecuencia su incorrecta interpretación diagnóstica. Aportamos un caso de mioepitelioma parotídeo, diagnosticado inicialmente como maligno en la PAAF, con estudio histológico e inmunohistoquímico.
Palabras clave: mioepitelioma, PAAF, glándula salivar, parótida.
SUMMARY
Salivary gland myoepithelioma is a benign rare neoplasm whose main location is the parotid gland (40 %) and displays an exclusive myoepithelial differentation. Histologically it shows several and variable architectural patterns and cellular types that can be dominant or mixed in diverse proportions. This leads to a marked morphological variability in the material obtained by FNAB and not unfrequently to a wrong diagnostic interpretation.
We report the case of a parotid lump, initially diagnosed as a malignant neoplasm by FNAB. Later, the tumor ,was correctly diagnosed as myoepithelioma after histological and inmunohistochemical examination.
Key words: myoepithelioma, FNAB, salivary glands, differential diagnosis, cytohistological assesment.
INTRODUCCIÓN
El mioepitelioma salivar es una neoplasia benigna poco frecuente (1,5% de todos los tumores salivares), que afecta a cualquier glándula salivar, mayor o menor, más frecuentemente a la parótida (40% de los casos) y que muestra una diferenciación celular exclusivamente mioepitelial, sin formación de ductos ni estroma condromixoide (1). Algunos autores aceptan hasta un 10% del área tumoral con diferenciación ductal (2) y la presencia de estroma mucinoso (3). Para algunos es una entidad diferente al tumor mixto (4) con distinto comportamiento biológico (5). Para otros representa una expresión morfológica extrema del tumor mixto (6), en un espectro continuo, con un cuadro morfológico intermedio: el adenoma de células basales (1,7).
Histológicamente muestra variables patrones arquitecturales (sólido, mixoide y reticular) y diferentes tipos de células (fusiformes, epitelioides, plasmocitoides y claras), que pueden ser dominantes o entremezclarse en diferentes proporciones (2,7,8).
El estudio inmunohistoquímico demuestra positividad celular constante frente a la proteína S100 y frente a los anticuerpos vimentina y citoqueratina (8,9), con expresión variable de este último en los tumores fusocelulares (1). La inmunoreacción frente a la actina específica muscular es variable (8) y está determinada por el fenotipo celular: fuerte y generalizada en el fusiforme, esporádica en el epitelioide y generalmente negativa en el plasmocitoide y de células claras (1).
El estudio citogenético demuestra alteraciones cromosómicas específicas que afectan a 12q y que son compartidas por el tumor mixto (10).
Las descripciones de las características citológicas del material obtenido por PAAF de estas lesiones son muy escasas y dispares en la literatura y corresponden a casos aislados (11-13) que han sido interpretados erróneamente como falsos positivos (11,12).
Describimos las características citológicas del material de la PAAF obtenida de un tumor parotídeo catalogado inicialmente como maligno y que en el estudio histológico e inmunohistoquímico demostró ser un mioepitelioma.
DESCRIPCIÓN DEL CASO
Varón de 38 años con lesión palpable y firme en lóbulo superficial de parótida izquierda de varios meses de evolución, con crecimiento lento, no dolorosa. Se practica PAAF de la lesión, obteniéndose varias extensiones que se secan al aire y se tiñen con panóptico rápido.
Estudio citológico
Las extensiones muestran numerosas células de aspecto epitelial (fig. 1) que se disponen disociadas o en grupos y placas, en íntima relación con estructuras amorfas, lineales y ramificadas, que se tiñen de color violáceo o púrpura (fig. 2); asimismo, dicho material aparece condensado esféricamente o de forma irregular en la zona central de agrupamientos celulares (fig. 3). Las células exhiben citoplasmas amplios y densos, de bordes definidos y núcleos redondos u ovoides, excéntricos o centrales, con cromatina grumosa y bien distribuida, a veces con pseudoinclusiones y hendiduras. Escasas células son fusiformes o plasmocitoides. El diagnóstico citológico de malignidad determina la extirpación quirúrgica de la lesión.
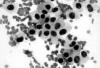
Fig. 1: Células tumorales de amplio
citoplasma y bordes definidos, de aspecto «epitelial». PAAF. Panóptico rápido
400X.
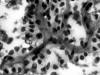
Fig. 2: Material amorfo de disposición
lineal y ramificada. PAAF. Panóptico rápido 400X.
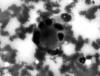
Fig. 3: Material amorfo globular rodeado
de células tumorales. PAAF. Panóptico rápido 400X.
Estudio anatomopatológico
Macroscópicamente, la lesión mide 2 cm de diámetro máximo, es ovoidea y blanquecina, de superficie lisa. Al corte es firme, blanquecina y homogénea y bien delimitada de los tejidos adyacentes (fig. 4). El tejido seleccionado para estudio microscópico se fijó en formol acuoso al 10% durante 24 horas y se incluyó en parafina. Se obtuvieron cortes histológicos de 3 micras de espesor que se tiñeron con H.E. Microscópicamente, se aprecia una lesión completamente encapsulada, constituida por una población celular homogénea de aspecto epitelioide, que se dispone en nidos sólidos y trabéculas, delimitados por tabiques de tejido conectivo hialinizado de grosor irregular (fig. 5). Las células tumorales exhiben citoplasmas amplios y eosinófilos y núcleos vesiculares, con nucleolo evidente y ocasionales mitosis. Focalmente se identifican escasas estructuras ductales. El estudio inmunohistoquímico realizado sobre cortes histológicos montados en portas cargados eléctricamente, en un sistema automátizado tipo Ventana, demuestra positividad fuerte y generalizada de las células tumorales frente a los anticuerpos citoqueratina, vimentina, actina específica muscular y proteína S100 (fig. 6). El índice de proliferación (Ki 67) es bajo (3% de las células tumorales).
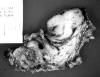
Fig. 4: Aspecto macroscópico de la lesión.

Fig. 5: Aspecto histológico de la lesión.
H.E. 400X.
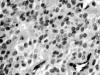
Fig. 6: Inmunopositividad frente a actina.
400X.
DISCUSIÓN
El mioepitelioma de glándulas salivares es un tumor controvertido en su definición morfológica (2), considerado actualmente como una variante monomórfica del tumor mixto, con diferenciación celular mioepitelial y ausencia de estructuras ductales (1,3). La existencia de alteraciones cromosómicas en 12q en ambas variantes apoya la singularidad de la lesión (10). Aunque se han descrito comportamientos agresivos de mioepiteliomas (5), la evidencia demuestra un comportamiento similar al del tumor mixto, incluso con una tasa menor de recidivas (14).
En nuestro caso, la benignidad de la lesión se ha fundamentado en su completa encapsulación, ausencia de atipia nuclear y bajo índice de proliferación celular. Las características morfológicas corresponden a un mioepitelioma epitelioide con escasa y focal formación de ductos. La inmunopositividad de las células tumorales frente a los anticuerpos citoqueratina, vimentina y actina muscular específica y proteína S100, demuestran claramente su diferenciación mioepitelial. La expresión de actina muscular específica en estas lesiones es muy variable y depende del grado de diferenciación celular (2,8). La expresión fuerte y generalizada en las células neoplásicas de nuestro caso contradice la escasa apetencia de este anticuerpo por las células epitelioides referida en la literatura (1,8). La rareza de esta lesión posiblemente justifique la escasez de artículos en los que se describen las características morfológicas del material obtenido por PAAF (11-13,15). La pluralidad de patrones de crecimiento, la variabilidad de tipos celulares, su mezcla en diferentes proporciones o su dominancia en el tumor, proporcionan cuadros citológicos poco uniformes (11-13,15), siendo la interpretación diagnóstica frecuentemente incorrecta (11,12). Estas características incluyen al mioepitelioma en el grupo de lesiones responsables de que la seguridad diagnóstica de la PAAF en tumores salivares sea del 77% (16-18).
La elevada celularidad, el aspecto epitelial de las células tumorales, la presencia de algunas pseudoinclusiones y hendiduras nucleares y la abundancia de material amorfo extracelular condicionaron nuestro diagnóstico inicial de malignidad. Aunque no existían criterios nucleares clásicos de malignidad, esto es frecuente en la mayoría de los carcinomas salivares (16-19) y por ello no es un criterio diferencial seguro. El diagnóstico citológico de mioepitelioma maligno está sustentado en criterios de malignidad nuclear, no siempre presentes en estos tumores (16,20) y en la existencia de pseudoinclusiones y hendiduras nucleares (20). La presencia de estas características en nuestro material demuestran su escaso valor diferencial.
La existencia de material amorfo globular y lineal en relación con las células neoplásicas sugiere varias lesiones cuyo diagnóstico diferencial es trascendente y difícil: adenoma de células basales con patrón trabecular, adenocarcinoma de células basales y carcinoma adenoide quístico (18,19,21). Como en el mioepitelioma maligno, el adenocarcinoma y el adenoma de células basales a veces sólo pueden diferenciarse por la existencia o no de infiltración tumoral de tejidos adyacentes. Por ello, esta distinción es frecuentemente imposible en material de PAAF (18,21). La distinción entre adenoma de células basales con patrón trabecular y carcinoma adenoide quístico, está fundamentada en material citológico en sutiles detalles nucleares y en la diferente apetencia tintorial y distribución del material amorfo extracelular y por ello es muy subjetiva (21,22). El diagnóstico diferencial se plantea asimismo con el carcinoma epitelial mioepitelial cuando en el material de PAAF predominan los agregados de células basófilas y las células claras son escasas o inexistentes (19,21).
La homogeneidad celular de nuestro caso descarta otros diagnóstico diferenciales de tumores primarios y metastásicos, obligados cuando las células tumorales son fusiformes, plasmocitoides o claras. Con la aportación de este nuevo caso de mioepitelioma queremos contribuir al mejor conocimiento de las características citológicas de esta rara lesión, enfatizando sus posibles diagnósticos diferenciales y facilitando con ello su difícil diagnóstico.
BIBLIOGRAFÍA
Ellis G, Anclair P. Benign Epithelial Neoplasms. En: Ellis G. and Anclair P. Editors. Tumors of the Salivary Glands. AFIP. 2002. p. 57-68.
Dardick I. Myoepitelioma: definitions and diagnostic criteria. Ultrastruct Pathol 1995; 19: 335-45.
Fletcher C. Tumors of the salivary glands. En: Fletcher C. editor. Diagnostic Histopathology of Tumours. Vol 1. Capit. 7, London. Churchill Livingstone. 2000. p. 231-311.
Batsakis J. Myoepithelioma. Ann. Otol. Rhinol Laringol 1985; 94: 523-4.
Seifert G. Broncheriou C, Cardesa A, et al. WHO International Histological Classification of Salivary Gland Tumours. Pathol.Res.Pract 1990; 186: 55-81.
Almela R, García-Hirschfeld J, Ramos B. Myoepithelioma of the parotid gland. An Otorrinolaringol Ibero Am 2002; 29: 5-9.
Simpson R, Jones H, Beasley P. Benig myoepithelioma of the salivary glands: a fine entity. Histopathology 1995; 27: 1-9.
Alos L, Cardesa A, Bombi J, et al. Myoepithelial tumors of salivary glands: a clinicopathologic, inmunohistochemical, ultrastructural and flow-cytometric study. Semin Diagn Pathol 1996; 13: 13-47.
Takai Y, Dardick I, Mackay A. et al. Diagnostic criteria for neoplastic myoepithelial cells in pleomorphic adenomas and myoepitheliomas. Inmunocytochemical detection of muscle-specific actin, citokeratin 14, vimentin, and glial fibrillary acidic protein. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1995; 79: 33-41.
El Naggar A, Lovell M, Callender D. et al. Cytogenetic analysis of a primary salivary gland myoepithelioma. Cancer Genet Cytogenet 1999; 113: 9–53.
Dodd, L, Caraway N, Luna M. et al. Myoepithelioma of the parotid: Report of a case initially examined by Fine Needle Aspiration Biopsy. Acta Cytol 1994; 38: 417-21.
Kawashima Y, Kobayashi D, Ishikawa N. et al. A case of myoepithelioma arising in an accessory parotid gland. J Laryngol Otol 2002; 116: 474-6.
De las Casas L, Hoerl H, Oberley T. et al. Myoepithelioma presenting as a midline cystic tongue lesion: cytology, histology, ancillary studies, and differential diagnosis. Diagn Cytopathol 2001; 24: 403-7.
Sciubba J, Brannon R. Myoepithelioma of salivary glands: report of 23 cases. Cancer 1982; 49: 562-72.
Ramakrishnan R, Krishnamurthy S. Fine needle aspiration appearance of clear cell myoepithelioma of the salivary gland. Acta Cytol 2001; 45: 89-7.
Chieng D, Paulino A: Cytology of the myoepithelial carcinoma of the salivary gland. Cancer 2002; 96: 36-42.
Chan M, McGuire LL, King W. et al.: Cytodiagnosis of 112 Salivary Gland Lesions. Correlation with Histologic and Frozen Section Diagnosis. Acta Cytol. 1992; 36: 353-63.
Ellis G. and Anclair P. Fine – needle aspiration biopsy of salivary glands. En: Ellis G. and Anclair P. editors. Tumors of the Salivary Glands. AFIP. 2002. p. 441-62.
Carrillo R, Poblet E, Rocamora A, et al. Epithelial – Myoepithelial Carcinoma of the Salivary Gland. Acta Cytol 1990; 34: 243-7.
Di Palma S, Alasio L, Pilotti S. Fine needle aspiration (FNA) appearances of malignant myoepithelioma of the parotid gland. Cytopathology 1996; 7: 357-65.
Hood I, Qizilbasch A, Salama S, et al. Basal – cell adenoma of parotid: Difficulty of differentiation from adenoid cystic carcinoma on aspiration biopsy. Acta Cytol 1983; 515-20.
Hillel A, Fee W. Evaluation of frozen section in parotid gland surgery. Arch Otolaryngol 1983; 109: 230-2.