
Vol. 38, n.º 1, 2005
REVISTA
ESPAÑOLA DE
Vol. 38, n.º 1, 2005 |
ORIGINALES
Ángel Lax Pérez1, Vicente Vicente Ortega2, Luis Meseguer1, Miguel Alcaraz Baños3, Pilar Sepúlveda1, Manuel Clavel-Nolla Sanz1
Facultad de Medicina. Universidad de Murcia.
1 Laboratorio de Cirugía Ortopédica experimental.
2 Cátedra de Anatomía Patológica.
3 Cátedra de Radiología y Medicina Física.
vvortega@um.es
RESUMEN
Objetivos: Realizamos el estudio experimental de la respuesta ósea al implante de un nuevo biomaterial, «espuma de hidroxiapatita» 09, en conejos.
Material y Métodos: Para ello colocamos en ambas tibias posteriores implantes de la espuma HA-09. Los animales fueron sacrificados a la semana, al mes, cinco y ocho meses pos-implante realizándose el estudio radiológico y morfológico (microscopía óptica y electrónica de barrido).
Resultados: Observamos crecimiento óseo en el interior de los poros y alrededor de los implantes, en todos los períodos del estudio. El material provocó una reacción inflamatoria precoz y poco relevante. Durante el tiempo de implantación observamos una reabsorción parcial del material.
Conclusiones: La espuma de hidroxiapatita 09 puede ser considerada como un nuevo material: biocompatible, bioreabsorbible y osteoconductor, y por tanto posible sustituto óseo.
Palabras clave: Hidroxiapatita; Espuma de Hidroxiapatita; Cerámica porosa; Biomaterial; Vectores Biodegradables; injerto de hueso.
SUMMARY
Objectives: An experimental study of the osseous response to a new biomaterial, hydroxyapatite foam (HA-09) in rabbits was carried out.
Material and Methods: Implants of HA-09 were made in both hind tibia of rabbits, which were sacrificed one week, one month, five months and eight months post-implant for radiological and morphological study (optical and electron microscopy).
Results: Bone growth was observed within the pores and around the implants at all post-implant times. The material implants provoked an early inflammatory response of little consequence. Partial re-absorption of the material was found during the observation period.
Conclusions: HA-09 can be considered for use as a possible bone substitute. It is biocompatible, bioreabsorbable and bone-generating material.
Key words: hydroxyapatite, gel-cast foam, porous ceramics, biomaterials, biodegradable carriers, bone implants.
INTRODUCCIÓN
En las últimas décadas se ha incrementado de forma exponencial la utilización de tejido óseo en la práctica habitual de la cirugía ortopédica. No obstante, las complicaciones vinculadas a la toma de injertos autólogos: la limitada cantidad de hueso a extraer y la morbilidad en el lugar de extracción, (dolor, infección, hematoma, hernias abdominales, sd femoro-cutáneo, etc.), por una parte, y los potenciales riesgos de carácter infeccioso e inmunológico (hepatitis [VIH], priones, etc.) en relación con los alo y heteroinjeros, por otra, han impulsado la búsqueda de alternativas a los injertos óseos. Los sustitutos óseos constituyen una alternativa y deben ser biocompatibles, osteoconductores y permitir la formación progresiva de hueso a través de un proceso de resorción lento (1).
La utilización progresiva de los materiales de fosfato cálcico como implantes óseos (englobados en el concepto de biomateriales cerámicos, propuesto por la Sociedad Europa de Biomateriales [S.E.B.]), a lo largo de las dos últimas décadas ha permitido el estudio sistematizado de los mecanismos de la respuesta biológica que suscitan (2). En este sentido, las cerámicas de hidroxipatita porosa han demostrado clínica y experimentalmente propiedades osteoconductivas, por lo que el uso de un compuesto basado en una cerámica de hidroxiapatita ha de tener una respuesta biológica del hueso muy favorable y ser por tanto un firme candidato a su utilización como sustituto de los injertos óseos (3,4).
En este trabajo realizamos el estudio experimental de la respuesta ósea a los implantes de «espuma» de hidroxiapatita (HA-09) de elevada porosidad, obtenida por el método de «gelcasting» (5-7) comprobando si dicha espuma cumple los requisitos de biocompatibilidad y biofuncionalidad, y por tanto, su idoneidad como sustituto de los injertos óseos.
MATERIAL Y MÉTODOS
Hemos utilizado 12 conejos albinos Nueva Zelanda de 3.900-4.500 g, de 30-35 semanas de edad. La colocación del implante se realizó en la zona proximal metafisaria de las tibias traseras, utilizando 24 implantes cilíndricos de 4 mm ´ 3,5 mm de espuma de HA, con porosidad abierta, obtenida a través de una técnica novedosa denominada «Gelcasting» (5-7) con un rango de porosidad de 72 al 90%, y poros esféricos de 50 µm de tamaño, interconectados a través de pequeñas ventanas (10 µm), comprobado a través de la porosimetría de mercurio.

Bajo anestesia general con clorhidrato de Ketamina (50 mg/kg/im.) (Merial®), Clorpromacina (10 mg/kg/im.) y Atropina (0,3 mg/kg/im.) y previa profilaxis antibiótica mediante Amoxicilina (Clamoxyl* LA® laboratorios Pfizer) 0,1 ml/kg peso im, realizamos el abordaje interno en la zona metáfiso-diafisario proximal de la tibia, a varios milíletros por debajo de la tuberosidad tibial anterior, donde realizamos un defecto óseo utilizando una broca quirúrgica de 4,5 mm de diámetro, rellenándolo con un bloque cilíndrico de la espuma de HA. Los 3 conejos de cada grupo fueron sacrificados con una sobredosis de Thiopental intracardiaco: a 1 semana (Grupo I), 1 mes (Grupo II), 5 meses (Grupo III) y 8 meses (Grupo IV) después de la implantación.
Estudio radiológico: Se realizaron las dos proyecciones radiografícas habituales (anteroposterior y lateral), de las piezas óseas que contenían los implantes. Para ello, utilizamos la técnica mamográfica tipo MAMMODIAGNOST UC (Philips, Madrid) con película Min-R Screen (Kodak®, Madrid), realizándose radiografías óseas iniciales con 32 Kv, 40 mA, foco grueso y exposimetría automática, para proceder posteriormente a la obtención de imágenes magnificadas 1: 1,7 con 20 Kv, 16 mA, foco fino y expositometría automática sín rejilla antidiafragma.
Estudio microscopíco óptico: Posteriormente, las muestras extraidas (tíbias) se fijaron en formol neutro tamponado al 10º y fueron decalcicadas utilizando dos métodos: 1.º) el tradicional de decalcificación con formol nítrico al 10º y 2.º) Mediante la técnica de TBD-1 (Termo-Shandon SA, Pittsburg,USA) durante 2 horas (Ácido hidroclórico 14% y polyvinylpyrrolidone), y con el TBD-II (Ácido fórmico 26% + Citrato sódico 8,5% + polyvinypyrrolidone) durante 17 días, realizando un cambio de líquido cada 24 horas. A continuación se incluyeron en parafina por el método habitual, obteniéndose secciones de 5 µm que fueron teñidas con las técnicas de Hematoxilina-Eosina, Tricrómico de Masson, y Gordon-Sweet para fibras de reticulina.
Estudio con microscopía electrónica de barrido (MEB): Las muestras utilizadas para MEB fueron fijadas según método tradicional y posteriormente se realizó el recubrimiento con oro con un metalizador BIO-RAD POLARON DMSION (200 Amstrong), y la observación de las muestras se realizó en Microscopio Electrónico de Barrido Jeol JSM-6.100, con una aceleración de 15 a 20 Kv. Las imágenes se obtuvieron sobre película Kodak Plus-X Pan 5-PXP 120 ó digitalizados mediante un programa (LINK ISIS).
Microanálisis: Se realizó por el sistema de dispersión de energía (EDS), comparando el espectro que originaba el biomaterial antes y después de su implantación en cada uno de los períodos del estudio.
RESULTADOS
A) Estudio radiológico
GRUPO I: Las características radiológicas del material implantado correspondían con la imagen de un elemento cilíndrico de tamaño 4 mm ´ 3,5 mm de diámetro con elevada densidad radiológica superior a la del hueso esponjoso adyacente (fig. 1a).
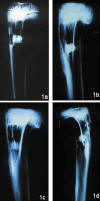
Fig. 1: Radiología.
1A: Radiografía A-P de tibia: Observamos la laguna ósea artificial
realizada para la colocación del implante. 1B: Radiografía lateral de
tibia: Implante cuyos bordes son más redondeado y crecimiento óseo alrededor.
1C: Radiografía lateral de tibia: Reparación de la cortical interna.
Trabéculas óseas que contactan con la superficie inferior y superior del
implante.
1D:
Radiografía lateral de tibia: Implante con disminución de volumen y con aspecto
redondeado que parece incorporarse a la formación trabecular del hueso
adyacente.
GRUPO II: El defecto óseo de la cortical externa presentaba menor tamaño que en el grupo anterior, con densidad calcio menor que la de la cortical adyacente. El material implantado presentaba un aumento de densidad ósea alrededor y en el interior no pudiéndose definir perfectamente los límites del cilindro implantado (fig. 2b).
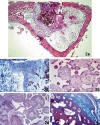
Fig. 2: Microscopía Óptica. 2A:
Sección Panorámica: Implante en la porción superior central, solución de
continuidad de la cortical con costra fibrinohemática y neoformación ósea
rodeándolo (HE-25x). 2B: Detalle de la costra fibrinohemática ocupando la
cortical perforada (Gordon Sweet, 125x). 2C: Detalle del tejido de
granulación que ocupa los poros del implante y espacios en blanco
correspondientes a la espuma disuelta por el procesado. (HE-312,5x). 2D:
Detalle de la reparación ósea en el seno del tejido de granulación que rodea al
implante, extendiéndose a los poros de la espuma (HE-312,5x). 2E: Detalle
de la zona de reparación de la cortical (T. Masson, 312,5x).
GRUPO III: Destacaba la disminución importante de la densidad ósea tanto en la periferia como en el interior del material, que mostraba forma ovalada y menor volumen, con límites poco definidos. A nivel cortical se observaba la reparación completa de la cortical externa con densidad igual al hueso adyacente. Sólo se delataba en el orificio de entrada la presencia de un engrosamiento en la cara interna de la cortical (fig. 1c).
GRUPO IV: Como características distintivas del periodo anterior observamos a nivel del implante una densidad menor, que en algunas radiografías parecía realizar una canalización medular. La imagen del implante no guardaba una estructura geométrica definida.. No se observaban alteraciones óseas residuales atribuibles a la presencia del implante (fig. 1d).
B) Estudio microscopico óptico y electrónico de barrido
GRUPO I: Las secciones histológicas demostraban, a nivel de la zona del implante y el área del defecto óseo creado en la cortical, la sustitución del hueso por tejido de granulación que se extendía hacia la zona del implante introduciéndose en los poros del material implantado, a los que rellenaba parcialmente (fig. 2a). Estaba constituido por numerosas yemas endoteliales y vasos sanguíneos de calibre capilar así como abundantes células mesenquimales de morfología irregular con citoplasmas amplios y numerosos fibroblastos dispuestos al azar en el seno de abundante sustancia fundamental, fibras colágenas, macrófagos y linfocitos de distribución dispersa. Con la técnica de Gordon-Sweett (fig. 2b) destacaba el entramado reticulínico a nivel de la costra fibrino-hemática del orificio cortical y las interconexiones entre los poros por el tejido de granulación, así como frecuentes depósitos de osteoide y trabéculas neoformadas que desde el borde del defecto óseo periférico se extendían por la periferia del implante rodeándolo casi en su totalidad y ocasionalmente también en el interior de los poros como se observaba de forma más detallada en las secciones teñidas con Tricrómico de Masson, entre los que se observan espacios vacíos correspondientes a la espuma que ha sido disuelta en el proceso de decalcificación. (fig. 2c).
Las imágenes de microscopía electrónica de barrido (MEB) concuerdan con lo descrito anteriormente, destacando en la cortical perforada para introducir el material, la costra fibrino-hemática descrita con anterioridad, así como abundante tejido de granulación rodeando al implante (con abundantes fibras y celularidad entre ellos, macrófagos, linfocitos, hematíes,…) y ocupando parcialmente los poros (fig. 3a).
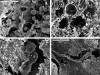
Fig. 3: Microscopía electrónica
de barrido: 3A: Costra fibrinohemática
con filamentos de fibrina y células sanguíneas (1000x). 3B: Poros de la
espuma HA-09 tapizados por abundante celularidad (750x). 3C: Detalle de
las células de estirpe osteoblástica en la superficie del implante (1100x).
3D: Detalle de la intercomunicación de los poros de la espuma implantada
(850x).
GRUPO II: Destacaba la reparación ósea casi completa de la cortical perforada para la implantación del cilindro, a expensas de tejido óseo neoformado o inmaduro. Asímismo, la sustitución de aproximadamente el 50% del volumen del cilindro implantado a expensas de trabéculas óseas que eran más extensas y de mayor espesor que las observadas en el período anterior, que confieren un aspecto reticular a la zona del implante. No observamos respuesta inflamatoria marcada (fig. 2d).
Con el MEB destacaba respecto al grupo anterior, la mayor abundancia de tejido óseo alrededor del implante (fig. 3b) así como en el interior de los poros, como también se observaba en las muestras estudiadas con microscopía óptica.
GRUPO III: Destacaba la reparación ósea completa de la cortical a nivel del orificio del implante, a expensas de hueso trabecular bien ordenado a nivel de la cortical con aumento de los fenómenos de la remodelación ósea (fig. 2e). También observamos menor formación de trabéculas óseas y el aumento marcado de la médula ósea hematopoyética y adiposa en la zona central, que sustituyen parcialmente al tejido de granulación.
Con MEB destacaba la mayor presencia de médula ósea que en el grupo anterior (fig. 3c).
GRUPO IV: Este periodo se caracterizaba por la presencia de hueso óseo maduro en la cortical de la zona de entrada del implante, de modo que no podía diferenciarse de la cortical adyacente. También observamos remodelación ósea con reordenación de trabéculas óseas alrededor del implante, fenómenos que eran más destacadas en las proximidades de la cortical. Los implantes en este periodo han disminuido de volumen de forma apreciable, persistiendo en la porción central el tejido de granulación, parcialmente sustituido por médula ósea. Asímismo, destacaba la reordenación del conducto medular caracterizada por la orientación en laminillas bien diferenciadas de las fibras de colágena del hueso cortical.
Con MEB las imágenes eran totalmente superponibles a las descritas (fig. 3d).
C) Estudio microanalítico
El microanálisis realizado por el sistema de dispersión de energía (EDS) en la espuma HA 09 en los cuatro períodos del estudio mostraba un espectro idéntico al del producto original antes de su implantación (gráficas 1 y 2). Destacaba la disminución de la concentración de cálcio (Ca) y fósforo (P).en la segunda gráfica respecto a la gráfica primera.

Gráficas 1 y 2: Espectro
obtenido por EDR de las muestras pre-implantación HA-09 (1) y Post-implantación
(2).
DISCUSIÓN
Tradicionalmente se ha utilizado el formol nítrico como técnica de decalcificación ósea; recientemente se están introduciendo la utilización de dos soluciones comerciales denominadas TBD-I® que contienen acido hipoclorídrico 14% y polyvinylpyrrolidone, y TBD-II® (Ácido fórmico 26% + Citrato sódico 8,5% + polyvinypyrrolidone) que son de uso habitual desde hace unos años en la práctica clínica de diversos hospitales. En nuestro trabajo hemos utilizado ambos métodos, mostrando la técnica del TBD características morfológicas de mayor calidad. Por ello, y a pesar que son escasas las referencias existentes en la bibliografía sobre estudios con las soluciones TBD-I y II (8), consideramos que el TBD, constituye un método que presenta mejores resultados que el del formol nítrico en los estudios del tejido óseo.
Nuestro grupo ha demostrado en diversos experimentos previos la eficacia de las cerámicas de fosfato cálcico como potenciales sustitutos de los injertos óseos, tanto como matrices osteoconductoras, como para el crecimiento de células de estirpe osteoblástico (9,4,10). Los materiales osteoconductores son capaces de proporcionar el andamiaje que facilita el crecimiento del tejido óseo en su interior. Uno de los principales factores que influyen en la osteoconducción es la porosidad del material (el tamaño de poro, el volumen total de poros e interconexión entre los poros). En este sentido, recientemente hemos desarrollado un biomaterial denominado «espuma de hidroxiapatita», mediante un procedimiento denominado «gel-casting», que emplea la formación de espuma en suspensión antes de producirse la polimerización de los monómeros orgánicos contenidos en su composición, (6,7), que presenta una elevadísima porosidad (próximas al 90%), muy superiores a todas las desarrolladas en los últimos años, que no llegaban al 70% (11-14), y además con propiedades mecánicas importantes caracterizadas por una gran resistencia a las fuerzas de compresión con valores de 1,93±0,43. Además, esta resistencia aumenta de forma exponencial tras la implantación (15).
La espuma de HA utilizada en nuestro trabajo presenta poros esféricos con tamaño de 50 µm e interconexión entre los poros a través de pequeñas ventanas que favorecen el crecimiento óseo en su interior., como demuestra nuestro estudio y que coinciden con las requisitos propuestos en los estudios clásicos de (16). Según estos autores los implantes porosos de fosfato cálcico debían presentar poros interconectados para poder favorecer el crecimiento óseo en su interior.
Nuestro experimento ha confirmado la biocompatibilidad de la espuma HA-09 puesto que sólo observamos la existencia de una respuesta inflamatoria poco relevante y en los primeros períodos del estudio, que al mes del implante estaba representada exclusivamente por escasos macrófagos dispuestos de forma aislada, sin constituir granulomas, y por linfocitos dispersos.
Tampoco hemos observado fibrosis en el límite entre la cerámica y el hueso huésped lo que junto al hecho de observar crecimiento óseo tanto en la periferia como en el interior de los implantes, confirma la capacidad de osteointegración de la espuma HA-09. La biocompatibilidad y capacidad de osteointegración de otras formas de hidroxiapatita ya había sido definida previamente, en estudios sucesivos por distintos autores clásicos (17-23).
En nuestro experimento también hemos podido demostrar la capacidad osteoconductora de las espumas de HA, que ha actuado de andamiaje para las células óseas y además con poros de diámetro 50 µm. De esta forma confirmamos lo que había sido descrito previamente por otros autores como por Klawitter (24), Eggli (25) y más recientemente por Galois (26) quienes afirmaban que el crecimiento óseo era posible en cerámicas con poros por debajo de 100 µm de diámetro e incluso del orden de 40 µm.
También hemos confirmado los resultados obtenidos por Klawitter y Hulbert (16) y Schepers (27) quienes consideraban que la existencia de interporo facilita el crecimiento óseo en su interior. Este hecho lo hemos podido constatar en nuestro experimento, al observado crecimiento óseo no solo en los poros de la superficie sino en los poros del interior del implante, hechos comprobados en la HA, tanto con microscopía óptica como con MEB y que también han sido descritos recientemente (15).
Las imágenes radiológicas indicativas en los dos últimos períodos, 5 y 8 meses, de una disminución apreciable del volumen del material, junto a las descripciones realizadas con microscopía óptica que indicaban sustitución de tejido osteoide por médula ósea adiposa y hematopoyética, demuestran la existencia de un fenómeno de reabsorción parcial y progresiva de la espuma que se hacía más patente a partir del quinto mes después de su implantación. Esta característica había sido descrito en la hidroxiapatita, con anterioridad por otros autores (28-31,2,4).
El microanálisis de la espuma de HA utilizando el sistema de dispersión de energía (EDS) en las distintas fases del estudio, demostró un espectro superponible al del producto original antes de su implantación; la disminución del nivel de calcio (Ca) y fósforo (P) observada es debida al intercambio iónico que se realiza en superficie cuando entra en contacto con los fluidos orgánicos, proceso característico de los materiales bioactivos, y previo a la colonización por tejidos reparadores. Estos resultados confirman el proceso de reabsorción de la espuma y donde no se originan productos intermedios de degradación. Dicho proceso de reabsorción se realiza mediante un mecanismo de fagocitosis por macrófagos localizados en la periferia del implante.
CONCLUSIÓN
La espuma de hidroxiapatita HA-09 se ha comportado en nuestro estudio como un material: biocompatible al provocar exclusivamente una respuesta inflamatoria leve y precoz; osteoconductor al permitir la rápida formación de tejido de granulación que es sustituido por tejido óseo trabecular, tanto en la periferia como en el interior del implante, y también bioreabsorbible, por lo que puede considerándose como sustituto del tejido óseo.
AGRADECIMIENTOS
La colaboración técnica de D. Victor Bolarín Lucas, técnico en Anatomía Patológica.
BIBLIOGRAFÍA