
Vol. 38, n.º 2, 2005
REVISTA
ESPAÑOLA DE
Vol. 38, n.º 2, 2005 |
ORIGINALES
Héctor Hugo Vitalone†1, Georgina Torres de Mercau1, Susi Davolio1, Guillermo Mercau1, Juan Carlos Valdez1, Sergio Gómez1, Diego Abdala1, Adriana Elías2
Universidad Nacional de Tucumán. Argentina.
1 Cátedra de Histología. Departamento Biomédico, Facultad
de Medicina.
2 Cátedra de Estadística. Facultad de Bioquímica, Química
y Farmacia.
RESUMEN
Antecedentes: Los factores de crecimiento son sustancias claves en el crecimiento de tumores y su bloqueo un objetivo potencial como terapia adyuvante. Diversos polisacáridos como la carragenina bloquean los factores de crecimiento y pueden influir sobre las células cebadas (CC), de controversial participación en el desarrollo tumoral. Consecuentemente nuestro objetivo fue evaluar la acción de carragenina e indometacina en el desarrollo de un fibrosarcoma experimental y su acción sobre las CC. Métodos: En 4 lotes de ratones Balb C se indujo un fibrosarcoma con Metilcolantreno; posteriormente se administró al grupo 1 Carragenina (C) 50 µg, al grupo 2 Indometacina (I) 100 µg, al grupo 3 Carragenina + Indometacina (CI) y el grupo 4 como testigo; Se evaluó el volumen tumoral y conteo de CC a los 3, 6 y 9 días de desarrollo. Resultados: El volumen tumoral en los grupos tratamiento fue significativamente menor que el grupo testigo a 6 y 9 días, mientras que los grupo C y CI mostraron un volumen significativamente menor en relación con el grupo I a los 9 días de tratamiento. El conteo de CC fue significativamente menor en los grupos C y CI a los 3 y 6 días de tratamiento, con una tasa de variación relativa decreciente para ambos grupos en relación con testigo e I. Conclusiones: La carragenina produce una disminución en el crecimiento y volumen tumoral, así como en el número de células cebadas, en un modelo experimental de fibrosarcoma.
Palabras clave: fibrosarcoma, carragenina, indometacina, células cebadas.
SUMMARY
Introduction: Growth Factors (GF) are important substances involved in the development of tumors. GF blockade is an attractive strategy as coadjuvant therapy in neoplasia treatment. Carrageenan acts by blocking GF and may influence mast cells, having a controversial role in tumour growth. We tried to analyze the effect of carrageenan and indomethacin in the development of a murine fibrosarcoma and its potential influence on mast cells population. Material and Methods: 4 lots of Balb C mice with methylcholanthrene induced fibrosarcoma received separately carrageenan (C) 50 microg., Indomethacin (I) 100 microg, Carrageenan-Indomethacin (CI), and saline solution. Tumour volume and number of mast cells were evaluated at 3, 6 and 9 days of its development. Results: Tumour volumes in treated groups were significantly smaller than those of the witness group at 6 and 9 days of treatment, while C and CI groups showed a significantly smaller volume than I group at 9 days. Mast cells count was significantly lower in C and CI groups after 3 and 6 days of treatment, showing a relative decrease variation rate (RVR) when compared to indomethacin and witness groups. Conclusions: Carrageenan causes a reduction in the development and volume of a murine fibrosarcoma, and reduces mast cell population in this type of experimental tumour.
Key words: fibrosarcoma, carrageenan, indomethacin, mast cells.
INTRODUCCIÓN
El crecimiento de diversos tumores experimentales depende de una amplia variedad de factores (irrigación, angiogénesis, estimulación por factores de crecimiento, etc.), sobre los que se puede actuar en un intento de inhibir o limitar la progresión tumoral. El bloqueo de factores de crecimiento es, en este contexto, un objetivo atractivo de estudio que podría aplicarse como método adyuvante en la terapia oncológica. Diversas sustancias han demostrado capacidad de antagonizar dichos factores, entre ellas los polisacáridos polisulfatados, que incluyen sustancias tales como la heparina, el suramin y la carragenina (1,2), esta última un polisacárido de alto peso molecular extraído de algas rojas y utilizado ampliamente como aditivo alimentario en su función de espesante, estabilizador y texturizador.
En un estudio previo (3) reportamos la disminución del crecimiento y volumen tumoral de un fibrosarcoma murino por acción de la carragenina, cuya principal propiedad biológica es la de competir con diversos factores de crecimiento por sus receptores celulares.
Asimismo, es probable la activa participación de las células cebadas en la regulación del crecimiento tumoral. El aumento del número de CC asociada a tumores es controversial. Algunos estudios demostraron un incremento del número de CC en tumores humanos, tanto espontáneos (4) como experimentales (5), mientras que otros evidenciaron una falta de aumento del número de dichas células (6) o simplemente no encontraron correlación. Por otra parte, en ratones deficientes de CC que recibieron Metilcolantreno como inductor tumoral, se registró una incidencia de tumores significativamente mayor que en ratones normales (7). Estos resultados avalan la hipótesis de que las CC podrían estar involucradas en la supresión de la génesis tumoral, pero no en la regulación del crecimiento de tumores desarrollados. Ya que las CC producen fundamentalmente heparina, un polisacárido polisulfatado (8-10), histamina, promotor de la microvasculatura en neoplasias (11) y proteasas, enzimas facilitadoras de la invasión tumoral (12), su participación en el desarrollo tumoral no sólo es factible, sino que además la convierten en potencial blanco de acción para sustancias como la carragenina.
Es conocido, asimismo, el efecto inflamatorio de la carragenina (13), lo que estimula la producción de prostaglandinas, las cuales promueven los procesos inflamatorios, inmunológicos y angiogénicos en el crecimiento tumoral. El bloqueo de la síntesis de prostaglandinas con antiinflamatorios no esteroides tales como la indometacina podría potenciar la acción anticancerígena de la carragenina administradas en conjunto o, al menos, posibilitar el estudio de la acción de la carragenina sin el componente inflamatorio (14).
Consecuentemente el objetivo del presente estudio fue evaluar la acción de la carragenina e indometacina sobre el crecimiento tumoral y la población de células cebadas en un fibrosarcoma murino experimental.
MATERIAL Y MÉTODOS
Animales: Se emplearon 120 ratones cepa Balb/C (machos y hembras) de 25 gramos de peso cada uno, los que fueron mantenidos a 24º C y 50% de humedad, con 12 hs. de luz y 12 hs. de oscuridad, alimentados con dieta balanceada (NUTRIC, Córdoba, Argentina) y agua ad libitum.
Inducción del tumor y obtención de células tumorales: La inducción del fibrosarcoma se realizó mediante la inoculación subcutánea de cristales de metilcolantreno en el flanco abdominal derecho y luego mantenido por pasajes seriados in vivo de una suspensión de 5 x 105 células viables del tumor. La viabilidad de las mismas se determinó por el método de Azul Tripán. La suspensión de las células tumorales fue obtenida por digestión enzimática del tumor con solución salina balanceada de Hank (HBSS) con 0,05% de proteasa tipo XXV y 0,001% de deoxirribonucleasa tipo I (Laboratorios SIGMA).
Medición del volumen tumoral: El volumen del tumor fue calculado tomando en cuenta sus diámetros mayor y menor (incluyendo piel) y se calculó según la fórmula: V= 0,4 x d2 x D.
donde: V: Volumen tumoral; d: Diámetro menor; D: Diámetro mayor del tumor.
Tratamiento con Indometacina y Carragenina: Cuando los tumores alcanzaron un volumen de 0,05 cm3 los ratones fueron separados en cuatro grupos de 30 animales cada uno. Los ratones del grupo 1 fueron inyectados cada uno con 100 µg de indometacina (IM 75 Laboratorio Montpellier); el grupo 2 recibió 50 µg de carragenina lambda tipo IV (Laboratorio SIGMA); al grupo 3 se le administró 100 µg de indometacina y 50 µg de carragenina lambda. El grupo 4 definido como testigo recibió 0,1 ml de solución salina balanceada.
Todas las inoculaciones se realizaron diariamente durante 20 días en un volumen de 0,1 ml de solución salina balanceada más la droga correspondiente.
Conteo de células cebadas: Diez ratones de cada grupo fueron sacrificados al 3.er, 6.º y 9.º día de iniciado el tratamiento y se resecó el tumor junto al tejido peritumoral, el cual fue fijado en formol al 10% durante 24 hs. y procesado con técnica histológica convencional de inclusión en parafina. Se realizaron cortes de 5 µ que fueron teñidos con técnica de azul de Toluidina para identificación de células cebadas (Mc Manus and Mowry, 1968).
Se contabilizaron las células cebadas de dos cortes histológicos de cada tumor y por cada ratón en estudio. Los cortes fueron examinados por microscopio de luz (LEITZ) a un aumento de 40 x. El conteo de las células cebadas se realizó interponiendo una grilla con áreas de 4 mm en las que se evaluó la presencia de células cebadas desde 2 mm del tejido peritumoral y hasta una profundidad de 2 mm de tejido tumoral.
Análisis estadístico: Los resultados se expresaron en media (±DS). Las variables fueron examinadas con Test de normalidad y análisis de varianza (ANOVA), con posterior aplicación del Test de comparación múltiple para muestras pareadas (Test de Tuckey). Un valor de p<0,05 fue considerado estadísticamente significativo.
RESULTADOS
Volumen Tumoral: La variación del volumen tumoral en los diferentes grupos al 3.er, 6.º y 9.º día se representa en la tabla 1.
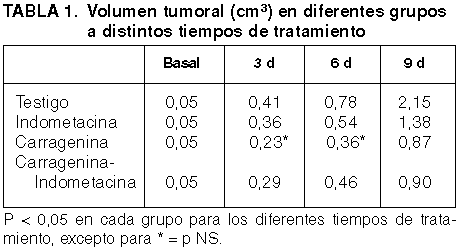
El volumen tumoral en los ratones testigo (T) aumentó en forma significativa desde el 3.er al 9.º día de desarrollo. Igualmente el volumen tumoral en los grupos tratados aumentó en general en forma significativa del 3.er al 9.º día (excepto para Carragenina C3->6D). El análisis de la tasa de crecimiento tumoral (fig. 1) de los grupos tratados en relación con el grupo testigo evidenció menor volumen tumoral, en cualquier grupo, a los 6 y 9 días de tratamiento, en forma significativa, mientras que no se observaron diferencias con el grupo testigo en el 3.er día (excepto para C3 <-> T3 = p<0,05 ). Al comparar los volúmenes tumorales de los grupos tratados entre sí, no se observaron diferencias al 3.er y 6.º día (excepto para I6 <-> C6 = p<0,05), mientras que el análisis del 9.º día mostró un volumen significativamente menor en los grupos C9 y CI9 en relación con I9 y sin diferencias significativas entre C9 <-> CI9 (p = NS).

Fig. 1: Tasa
de variación relativa de volumen tumoral a distintos días de tratamiento.
Es de destacar que el grupo Carragenina presentó los menores volúmenes tumorales para cualquier día de crecimiento analizado, con diferencias significativas en general en relación con el resto de los grupos.
El análisis de la velocidad de crecimiento tumoral (fig. 2) evidenció en general valores estables al 3.er y 6.º día en el grupo testigo con un significativo incremento al 9.º día. Los grupos tratamiento experimentaron en general una leve disminución de la velocidad de crecimiento al 3er y 6.o día con posterior aumento de dicha velocidad al 9.º día, aunque menor que el grupo testigo, correspondiendo al grupo CI y C los valores más bajos en términos de velocidad de crecimiento tumoral.
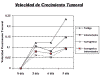
Fig. 2: Velocidad
de Crecimiento tumoral a distintos días de tratamiento.
Células Cebadas: El conteo de CC (tabla 2, fig. 3) en el grupo testigo (con relación al 3.er día) reveló un aumento significativo al 9.º día, y sin diferencias al 6.º día de análisis.

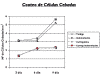
Fig. 3: Conteo
de células cebadas a distintos días de tratamiento.
El número de CC en los grupos tratados igualmente aumentó significativamente entre el 3.er, 6.º y 9.º día de desarrollo, (excepto para C6D->C9D y CI6D->CI9D) pero en forma significativamente menor que el grupo testigo, con excepción del grupo Indometacina.
La comparación de los recuentos celulares entre los diferentes grupos al 3.er y 6.º día evidenció diferencias significativas entre dos pares de grupos bien definidos: Testigo e Indometacina por un lado vs. Carragenina y Carragenina-Indometacina por otro, con menor cantidad de CC en los grupos Carragenina y Carragenina-Indometacina en relación con Testigo e Indometacina y sin diferencias en cada grupo par, lo que evidencia el efecto de la carragenina en la disminución del número de CC. Finalmente el análisis al 9.º día mostró diferencias significativas entre todos los grupos entre sí (excepto para C9<->CI9), correspondiendo los valores más bajos a los grupos C y CI.
El análisis de la tasa de variación relativa (fig. 4) mostró un patrón decreciente para los grupos C y CI, con un patrón a tasa creciente para los grupos testigo e Indometacina.
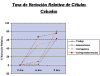
Fig. 4: Tasa
de variación relativa de células cebadas a distintos días de tratamiento.
Finalmente el análisis comparativo no permitió demostrar alguna correlación entre la disminución del volumen tumoral y la cantidad de células cebadas por tumor.
DISCUSIÓN
El presente estudio demuestra que la carragenina produce una disminución en el crecimiento y volumen tumoral, así como en el número de células cebadas, en un modelo experimental de fibrosarcoma.
El volumen tumoral alcanzado en todos los grupos de tratamiento fue significativamente menor que el volumen tumoral del grupo testigo, lo que evidencia un claro efecto del tratamiento sobre el crecimiento del fibrosarcoma. El tratamiento con carragenina fue el que mostró la mayor disminución de volumen tumoral en relación con el grupo testigo, en forma significativa aún en el análisis al 3.er día de desarrollo, donde fue el único grupo con volumen tumoral significativamente menor que el testigo.
El análisis entre grupos de tratamiento mostró que la carragenina produjo una mayor disminución del volumen tumoral en relación con indometacina evidenciable recién a los 9 días de tratamiento, ya que el análisis más precoz (3.er y 6.º día) no arrojó en general diferencias entre los distintos grupos.
Asimismo, el tratamiento del tumor evidenció un retardo en la velocidad de crecimiento tumoral en todos los grupos en relación con testigo, pero con mayor retardo en los grupos tratados con carragenina. Esta disminución de velocidad fue más evidente a los 9 días de tratamiento.
Si bien ha sido demostrado el efecto protumorigénico local de la carragenina en modelos de inflamación experimental (15) experimentos con células tumorales en cultivo han mostrado la inhibición por la carragenina de la proliferación celular así como el incremento de la apoptosis, por lo que sus efectos protumorales in vivo no parecen depender de una estimulación directa de la células neoplásicas sino de una inducción de la respuesta humoral-celular que genera niveles aumentados de prostanoides y citoquinas pro-inflamatorias, las cuales acelerarían el crecimiento tumoral. En este contexto, ya ha sido demostrado in vivo e in vitro la supresión del crecimiento de fibrosarcomas experimentales por acción de drogas antiinflamatorias (16). Es de destacar que nuestro modelo no provoca una inflamación en el sitio de crecimiento tumoral, sino una disminución del crecimiento de los tumores por acción directa de la carragenina sobre las células tumorales, en concentraciones micromolares (0,002 µgr carragenina/mg de ratón).
La disminución del crecimiento tumoral provocada por la carragenina probablemente sea debida a la inhibición de la unión de diversos factores de crecimiento con sus receptores (17), tal como el Factor de crecimiento Fibroblástico básico (FGFb), Factor de Crecimiento derivado de las plaquetas (PDGF), Factor de crecimiento transformante beta (TGF-b1), Factor de crecimiento Insulínico –1 (IGF-1) y Factor de crecimiento transformante alfa (TGF-a). Todos estos factores estimulan la mitosis (18) y la migración de células endoteliales y tumorales (19), con el consiguiente incremento del volumen tumoral.
Por otra parte, el análisis del conteo de células cebadas mostró que el tratamiento con carragenina (sola o asociada a Indometacina) disminuye la población total de dichas células, mientras que el tratamiento con Indometacina produjo resultados similares al grupo testigo, lo que evidencia un efecto inhibitorio de la carragenina sobre la población total de células cebadas. Es de destacar que esta acción fue evidenciable desde los primeros días de tratamiento.
El mecanismo por el cual la carragenina altera la población de células cebadas en el fibrosarcoma es desconocido. Se postula una probable inhibición de la Interleukina 3 (IL-3), sustancia que estimula la proliferación de CC (20) y del c-Kit ligando, que estimula su maduración (21).
La disminución del número de CC en tumores llevaría, en este contexto, a una disminución de la secreción de histamina y heparina por estas células. Ya que la heparina fija y protege factores de crecimiento (22) su menor producción podría llevar a una inhibición del crecimiento tumoral; de igual forma la disminución de la secreción de histamina podría alterar la angiogénesis (23,24) y contribuir igualmente a la inhibición del crecimiento tumoral. De todas formas, y en concordancia con estudios anteriores, no queda claro si las CC contribuyen a la inhibición del crecimiento tumoral o, por el contrario, tienen algún rol adyuvante en la progresión tumoral (25).
Por otra parte, la indometacina, al igual que estudios previos (26-28), demostró un efecto inhibitorio sobre el crecimiento tumoral, aunque de menor magnitud que la carragenina. El conocido bloqueo sobre las prostaglandinas (29) sería el responsable de su efecto antitumoral, ya que las prostaglandinas han sido reconocidas como inductoras del crecimiento tumoral (12,30-38). No obstante, en nuestro estudio la asociación de Carragenina con Indometacina no produjo un efecto aditivo ó sinérgico en la inhibición del crecimiento tumoral o en el número de CC.
En base a los resultados obtenidos, si bien la carragenina ha demostrado su efecto antitumoral experimental, son necesarios más estudios para definir el rol de las células cebadas en el crecimiento de tumores.
BIBLIOGRAFÍA
Hoffman R, Sykes D. Inhibition of binding of basic fibroblast growth factor to low and high affinity receptors by carrageenans. Biochem Pharmacol 1993; 45, 2348-2351.
Hoffman, R. Carrageenans inhibit growth-factor binding. Biochem J 1993; 289 (Pt 2), 331-334.
Vitalone HH, Torres Nieto de Mercau G, Valdez JC, Davolio S, Mercau G. Efecto de la carragenina e indometacina sobre el crecimiento de un fibrosarcoma murino. Medicina (Buenos Aires) 2000; 60: 225-228
Cawley EP, Hoch-Ligeti C. Association of tissue mast cells and skin tumors. Arch Dermatol 1961; 83: 146-150.
Fisher ER, Fisher B. Role of mast cell in tumor growth. Arch Pathol 1965; 79, 185-191.
Lascano EF. Mast cells in human tumors. Cancer 1958, 11: 1110-1114.
Tanooka H, Kitamura Y, Sado T, Tanaka K, Nagase M, Kondo S. Evidence for involvement of mast cells in tumor suppression in mice. J Natl Cancer Inst 1982; 69: 1305-1309.
Barzu T, Van Rijn JL, Petitou M, Molho P, Tobelem G, Caen JP. Endothelial binding sites for heparin. Specificity and role in heparin neutralization. Biochem J 1986; 238: 847-854.
Kurokawa M, Doctrow SR, Klagsbrun M.. Neutralizing antibodies inhibit the binding of basic fibroblast growth factor to its receptor but not to heparin. J Biol Chem 1989; 264: 7686-7691.
Denekamp J. Review article: angiogenesis, neovascular proliferation and vascular pathophysiology as targets for cancer therapy. Br J Radiol 1993; 66: 181-196.
Sörbo J, Norrby K. Mast-cell histamine expands the microvasculature spatially. Agents and Actions 1992; 387-389.
Birkedal-Hansen H, Cobb CM, Taylor RE, Fullmer HM. Activation of fibroblast procollagenase by mast cell proteases. Biochim Biophys Acta 1976; 438: 273-286.
Hambleton P, Miller P. Studies on carrageenan air pouch inflammation in the rat. Br J Exp Pathol 1989; 70: 425-433.
Tsuru Fuji, Sato H, Min KR, Ohuchi K. Difference in the anti-inflammatory effect of indomethacin between acute and chronic stages of carrageenan-induced inflammation. J Pharm 1978; 1: 814-817.
Raz A, Levine G, Khomiak Y. Acute local inflammation potentates tumor growth in mice. Cancer Letters 2000; 148: 115-20.
Hoferova Z, Fedorocko P, Hofmanova J et al. The effect of nonsteroidal antiinflammatory drugs ibuprofen, flurbiprofen, and diclofenac on in vitro growth of mouse fibrosarcoma. Cancer Invest 2002; 20(4): 490-8.
Hoffman R. Carrageenan inhibits growth factor binding. Biochem J 1993; 289: 331-334.
Kandel J, Bossy-Wetzel E, Radvanyi F, Klagsbrun M, Folkman J, Hanahan D. Neovascularization is associated with a switch to the export of bFGF in the multistep development of fibrosarcoma. Cell. 1991 Sep 20; 66(6): 1095-104.
Mueller SN, Thomas KA, Di Salvo J, Levine EM. Stabilization by heparin of acidic fibroblast growth factor mitogenicity for human endothelial cells in vitro. J Cell Physiol 1989; 140: 439-48.
Ihle JN, Keller J, Oroszlan Set al. Biologic properties of homogeneous interleukin 3. I. Demonstration of WEHI-3 growth factor activity, mast cell growth factor activity, p cell-stimulating factor activity, colony-stimulating factor activity, and histamine-producing cell-stimulating factor activity. J Immunol 1983; 131: 282-7.
Anderson DM, Lyman SD, Baird A et al. Molecular cloning of mast cell growth factor, a hematopoietin that is active in both membrane bound and soluble forms. [published erratum appears in Cell 1990 Nov 30; 63(5): following 1112]. Cell 1990; 63: 235-43.
Gospodarowicz D, Cheng J. Heparin protects basic and acidic FGF from inactivation. J Cell Physiol. 1986 Sep; 128(3): 475-84.
Norrby K, Jakobsson A, Sorbo J. On mast-cell-mediated angiogenesis in the rat mesenteric-window assay. Agents Actions 1990 Apr; 30(1-2): 231-3.
Norrby K, Sorbo J. Heparin enhances angiogenesis by a systemic mode of action. Int J Exp Pathol. 1992 Apr; 73(2): 147-55
Terlikowski SJ, Nowak HF, Famulski W, Sulkowska M. Effect of the cytokine rhTNF-alpha on the population of mast cells in the growth of MethA fibrosarcoma-a TEM study. Folia Histochem Cytobiol. 2001; 39 Suppl 2: 199-200.
Fulton AM. In vivo effects of indomethacin on the growth of murine mammary tumors. Cancer Res 1984; 44: 2416-20.
Klein WA, Miller HH, Anderson M, De Cosse JJ. The use of indomethacin, sulindac, and tamoxifen for the treatment of desmoid tumors associated with familial polyposis. Cancer 1987, 60; 2863-68.
Rubio CA Antitumoral activity of indomethacin on experimental esophageal tumors. J Natl Cancer Inst 1984; 72: 705-7.
Peterson HI. Effects of prostaglandin synthesis inhibitors on tumor growth and vascularization. Experimental studies in the rat. Invasion Metastasis 1983; 3: 151-9.
Okada F, Hosokawa M, Hasegawa J et al. Enhancement of in vitro prostaglandin E2 production by mouse fibrosarcoma cells after co-culture with various anti-tumour effector cells. Br J Cancer 1994; 70: 233-8.
Huang CC. Prostaglandin E2, collagenase, and protease levels in culture of rat tumor. Otolaryngol Head Neck Surg 1981; 89: 564-8.
Kunkel SL, Chensue SW, Phan SH. Prostaglandins as endogenous mediators of interleukin 1 production. J Immunol 1986; 136: 186-92.
Otterness IG, Bliven ML, Eskra JD, Reinke M, Hanson DC. The pharmacologic regulation of interleukin-1 production: the role of prostaglandins. Cell Immunol 1988; 114: 385-97.
Rappaport R, Dodge GR. Prostaglandin E inhibits the production of human interleukin 2. J Exp Med 1982; 155: 943-8.
Schultz RM. Autoregulation of macrophages cytotoxic activity by interferon and prostaglandins. Advances in immunopharmacology 2. 161-166. 1983. Hadden JW et all.
Young MR, Hoover CS. Inhibition of spleen cell cytotoxic capacity toward tumor by elevated prostaglandin E2 levels in mice bearing Lewis lung carcinoma. J Natl Cancer Inst 1986; 77: 425-9.
Parhar RS, Lala PK. Prostaglandin E2-mediated inactivation of various killer lineage cells by tumor-bearing host macrophages. J Leukoc Biol 1988; 44: 474-84.
McBride WH. Phenotype and functions of intratumoral macrophages. Biochim Biophys Acta 1986; 865: 27-41.
En el tiempo que este trabajo estaba en proceso
de impresión uno de sus autores ha fallecido,
el Dr. Héctor Hugo Vitalone