
Vol. 38, n.º 4, 2005
REVISTA
ESPAÑOLA DE
Vol. 38, n.º 4, 2005 |
ORIGINALES
Adriana López-Márquez1, Avissai Alcántara-Vázquez2, Carlos Ortiz-Hidalgo1,3
1 Departamento de
Patología, The American British Cowdray Medical Center, Ciudad de México.
2 Unidad de Patología
General de México, Ciudad de México.
3 Departamento de
Histología, Universidad Panamericana, Ciudad de México.
cortiz@abchospital.com
RESUMEN
Antecentes: El Linfoma T Angioinmunoblástico es un linfoma T periférico que representa solo el 1-2% de los Linfomas no Hodgkin. Este linfoma tiene características clínicas y patológicas particulares que lo sitúan dentro del grupo de linfomas agresivos y de mal pronóstico. Estudios recientes han demostrado diversos hallazgos inmunofenotípicos y genéticos que pueden ser de utilidad en el diagnóstico de esta entidad. El objetivo de este estudio es investigar si la expresión de CD10, BCL-6 y la expansión de las células dendríticas es constante y por consecuencia útil en el diagnóstico de LTA. Material y métodos: Se estudiaron siete casos de Linfoma T Angioinmunoblástico, obtenidos del departamento de Patología del American British Cowdray Medical Center en la Ciudad de México. Se realizaron tinciones con H&E y tinción retículo de Gordon-Sweet e inmunohistoquímica con CD20, CD3, CD10, Bcl-6, Desmina y queratina de amplio espectro. Resultados: Todos los casos mostraron expresión aberrante de CD10 y Bcl-6, así como también la expansión de la red de células dendríticas foliculares y en tres casos además aumento de células reticulares fibroblásticas desmina/citoqueratina positivas. Conclusiones: La proliferación de las células dendríticas foliculares y de células reticulares fibroblásticas desmina/citoqueratina positivas, así como la expresión aberrante de CD10 y Bcl-6 son características constantes en el Linfoma T Angioinmunoblástico. Estos hallazgos inmunohistoquímicos son útiles en al diagnóstico de LTA.
Palabras clave: angioinmunoblástico, CD10, Bcl-6, células dendríticas.
SUMMARY
Introduction: Angioimmunoblastic T-cell lymphoma (ATL) is a peripheral T-cell lymphoma representing only 1-2% of non-Hodgkin’s lymphomas. Clinical course of ATL is aggressive and its prognosis is poor. Recent studies have identified useful immunohistochemical and genetic features in the diagnosis of this entity. The aim of this study was to investigate the expression of CD10, BCL-6 and dendritic cells expansion in ATL. Patients and methods: Seven cases of ATL retrieved form the files of the Department of Pathology of the American British Cowdray Medical Center in Mexico City were studied. Sections were stained with H&E and Gordon-Sweet for reticular fibers. Immunohistochemistry for CD20, CD3, CD10, BCL-6, desmin and wide spectrum cytokeratins was done. Results: All cases showed aberrant expression for CD10 and BCl-6. In all cases expansion of follicular dendritic cells was found. An increase in number of desmin/cytokeratin positive reticulum cells was also found in three patients. Conclusions: Dendritic follicular cells and desmin positive/cytokeratin positive reticular cells proliferation, as well as aberrant expression of CD10 and BCl-6 are constant characteristics of ATL. These findings are useful immunophenotypical features in the diagnosis of ALT.
Key words: angioimmunoblastic lymphoma, CD10, Bcl-6, dendritic cells.
INTRODUCCIÓN
El linfoma T angioinmunoblástico (LTA), descrito en 1976 por Frizzera y col. como «Linfadenopatía angioinmunoblástica con disgammaglobulinemia» (1), es actualmente considerado por la Organización Mundial de la Salud una variante de linfoma T periférico. El LTA afecta principalmente a personas mayores de 60 años y se presenta con crecimiento ganglionar generalizado, acompañado de algunos síntomas sistémicos como fiebre, pérdida de peso, sudoración nocturna, escalofríos y anorexia (2). Además frecuentemente hay evidencia clínica de afectación extraganglionar al momento del diagnóstico que incluye: hepatoesplenomegalia en 50-70%, rash cutáneo en 50%, afección pleuropulmonar en 40% y a la médula ósea en 60 a 80% de los pacientes (3,4).
Histológicamente los ganglios afectados presentan pérdida parcial o total de la arquitectura normal por infiltrado polimorfo compuesto por linfocitos, células plasmáticas y eosinófilos, así como proliferación prominente de vénulas de endotelio alto ramificadas y expansión de la red de células dendríticas foliculares. Existen en forma constante, grupos de células con citoplasma claro o pálido, distribuidas principalmente alrededor de las vénulas ramificadas. Las células neoplásicas expresan marcadores T (con pérdida de uno o más de estos marcadores T), y son generalmente CD4 positivas, con una mezcla de células reactivas CD8+. Hay además inmunoblastos B, CD20+ que pueden en ocasiones semejar células de Reed-Sternberg.
El análisis molecular de estos linfomas ha demostrado proliferación monoclonal u oligoclonal de células T, y en una minoría de casos se ha demostrado población clonal de células B (2,5).
El diagnostico histopatológico del LTA puede ser frecuentemente difícil y ha sido referido que puede haber diagnóstico erróneo de inicio, hasta en 50% de los casos, particularmente en las etapas tempranas de la enfermedad cuando hay afección parcial del ganglio linfático y poca expansión de células dendríticas foliculares (3,6).
Estudios recientes han demostrado que las células T neoplásicas pueden ser identificadas por la expresión aberrante de CD10 hasta en el 90% de los casos; un dato ausente en proliferaciones linfoides reactivas y otros linfomas T periféricos (5,7). Además varios grupos de investigadores han encontrado un incremento de las células Bcl-6+ en la región interfolicular de ganglios con LTA, que corresponden a células T neoplásicas, evidenciado por la coexpresión de CD3 u otros marcadores T (7-9). Además atendiendo al importante componente estromal que presenta el linfoma angioinmunoblástico Jones y col. demostraron que la expansión de células reticulares fibroblásticas desmina positivas y de las células dendrítico foliculares CD21+ es de gran utilidad diagnóstica por presentarse con mayor frecuencia que en otras linfadenopatías reactivas y neoplásicas, además de que parecen tener un papel importante en la patogenia de este linfoma (10).
Presentamos en este estudio, el análisis inmunohistoquímico de 7 casos de Linfoma T Angioinmunoblástico haciendo especial énfasis en la presencia de linfocitos T neoplásicos que coexpresan CD10 y Bcl-6, y en la proliferación de las células dendríticas foliculares y las células reticulares desmina positiva.
MATERIAL Y METODOS
Presentamos en este estudio 7 casos de Linfoma T tipo Angioinmunoblástico, seis de ellos del American British Cowdray Medical Center y el séptimo del Hospital General de México, de la ciudad de México.
Tanto la información clínica como los bloques de parafina de ganglios linfáticos estuvieron disponibles para los 7 casos. Se realizaron cortes para tinción con Hematoxilina-Eosina, PAS, y Gordon y Sweet para fibras reticulares. Además se realizó inmunohistoquímica (Dako Autostainer®) por el método de peroxidasa utilizando anticuerpos para CD3 (DAKO/dilución 1:500/incubación 2 h/recuperación con Trilogy), CD5 (Cell Marque/ dilución 1:50/incubación 2 h/recuperación con Trilogy), CD43 (Biogenex/dilución 1:100/incubación 30 a 40’/recuperación con Trilogy). CD45RO (DAKO/ dilución 1:100/ incubación 30 a 40’/recuperación con Declere), CD31 (DAKO/ dilución 1:400/incubación 30 a 40’/recuperación con Trilogy), Desmina (DAKO/dilución 1:100/incubación 30 a 40’/recuperación con Declere), CD21 (DAKO/dilución 1:50/incubación 2 h/recuperación con pepsina-tripsina), CD23 (Cell Marque/dilución 1:100/incubación 2 h/recuperación con trilogy), CD35 (DAKO/dilución 1:25/incubación 2 h/recuperación con Trilogy), CKAE1/3 (Cell Marque/dilución 1:100/incubación 30 a 40’/recuperación con Declere), LMP-1 (DAKO/ dilución 1:100/incubación 30 a 40’/recuperación con Trilogy), Bcl-6 (Neo Markers/ dilución 1:10/incubación 48 h a 4°C/ recuperación con Trilogy), CD10 (Cell Marque/dilución 1:50 incubación 2 h/recuperación con Trilogy), CD20 (DAKO/dilución 1:40/ incubación 30 a 40’/recuperación con Declere) y CD79a (DAKO/ dilución 1:50/incubación 2 h/recuperación con Trilogy), Oscar (Pan-queratina, cortesía de Pheno Path Laboboratoires, Seatle Wa. Allen Gowen, dilución 1:100).
RESULTADOS
Datos clínicos
De los siete casos 4 fueron mujeres y 3 hombres, entre los 37 y los 82 años. (42 años promedio). Sólo en dos de los casos se encontraron datos clínicos sistémicos, como fiebre y perdida de peso, rash cutáneo y ataque al estado general (casos 3 y 4), seis de los siete (casos 1 y 3, 4, 5, 6 y 7) presentaba linfadenopatía generalizada Los detalles del cuadro clínico se muestran en la tabla 1.

Hallazgos histopatológicos
De todos los casos se estudiaron biopsias de ganglio linfático y el diagnóstico definitivo se realizó en todos después de valorar la citoarquitectura ganglionar y los resultados de inmunofenotipo.
Todos los casos presentaron alteración de la arquitectura caracterizada por infiltración celular polimorfa, difusa, compuesta predominantemente por linfocitos de tamaños variables, con algunos inmunoblastos. Además había linfocitos con citoplasma claro de disposición predominantemente perivascular en forma multifocal que predominó en 3 de los 6 casos (fig. 1). Además había en todos, numerosos macrófagos, células plasmáticas y eosinófilos; infiltrado que rebasaba la cápsula de los ganglios. Hubo proliferación acentuada de vénulas de endotelio alto ramificadas (arborescentes), rodeadas por linfocitos, predominantemente con citoplasma claro, y por medio de la tinción con Ácido Periódico de Schiff (PAS), se resalto en dos casos, la presencia de material amorfo acelular alrededor de estas vénulas. En esta zona con la tinción de Gordon-Sweet para fibras reticulares, se encontró aumento de fibras alrededor de estas vénulas de endotelio alto. Dos de los casos (casos 1 y 6) presentaron focalmente algunos folículos residuales atróficos. Además todos presentaban obliteración variable de los sinusoides.
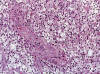
Fig. 1: Linfoma
T angioinmunblástico. Vénulas de endotelio alto rodeada de células claras.
Inmunohistoquímica
Los siete casos presentaron entre el 70 y 90% de linfocitos con intensa positividad para los anticuerpos para células T (CD3, CD5, CD45RO Y CD43), además en un caso (caso 4) se realizó inmunomarcación para células T cooperadores (CD4) y linfocitos T citotóxicos/supresores (CD8) predominando los primeros en proporción 7:1 (fig. 2). Con el CD31 se hizo más evidente la proliferación de vénulas de endotelio alto.

Fig. 2: Linfoma
T Angioinmunoblástico. Izquierda inmunomarcación con CD8, derecha
Inmunomarcación con CD4.
En todos los casos había linfocitos B CD20+, en mucho menor proporción que los linfocitos T neoplásicos (proporción T:B, 9:1) (fig. 3). Había distribuidas en forma irregular, células CD10 positivas que representaron entre el 20 y 40% de la población celular. Estas células CD10 positivas estaban preferentemente localizadas en zonas «T» y en las células del centro germinal de los folículos residuales atróficos, resaltando además el contorno irregular de estos folículos. Focalmente las células CD10 positivas marcaron en citoplasma de las células con condensación paranuclear (Punto paranuclear) Se realizó doble inmunomarcación para CD10/CD20, y las células neoplásicas CD10+ no expresaron el marcador CD20. En la doble inmunomarcación para CD10/CD3, se demostró que las células neoplásicas fueron positivas para CD3 y coexpresaron en aproximadamente 50% el CD10 (fig. 4).

Fig. 3: Linfoma
T Angioinmunoblástico. Izquierda Inmunomarcación con CD20. derecha
Inmunomaración con CD3.
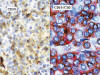
Fig. 4: Linfoma
T Angioinmunoblástico. Izquierdo, inmunomarcación con CD10.Nótese la positividad
citoplámica con acentuación paranuclear (punto paranuclear). Derecha, doble
inmunomarcación con CD10 y CD3, demostrando que los linfocitos T coexpresan
CD10.
El anticuerpo para Bcl-6 fue positivo en los núcleos de las células de los centros germinales residuales y entre el 15 y 20% de los núcleos de las células neoplásicas (Fig. 5), lo cual se verificó en la doble inmunomarcación con CD3/Bcl-6.
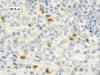
Fig. 5: Linfoma
T angioinmunoblástico. Inmunomarcación con Bcl-6.
Las células dendríticas foliculares se hicieron evidentes por medio de los anticuerpos contra CD21, CD23 y CD35. Estas células estaban localizadas en los centros germinales atróficos residuales así como en grupos de CDF rodeando vénulas de endotelio alto y en zonas de la región paracortical (fig. 6). La desmina fue positiva en las células reticulares fibroblásticas hiperplásicas (fig. 7), dispuestas predominantemente alrededor de las vénulas de endotelio alto.

Fig. 6: Linfoma
T angioinmuoblástico. Inmunomarcación con CD21 que demuestra la proliferación de
células dendríticas foliculares.
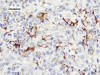
Fig. 7: Inmunomarcación
con desmina. Hay proliferación de células reticulares.
En cuatro de los seis casos se identificaron células B CD20 positivas, con morfología de inmunoblastos positivas a la proteína latente de membrana del virus de Epstein-Barr (LMP-1) (casos 2, 3, 4 y 5). En la tabla 2 se muestran los resultados de la inmunohistoquímica para cada caso.
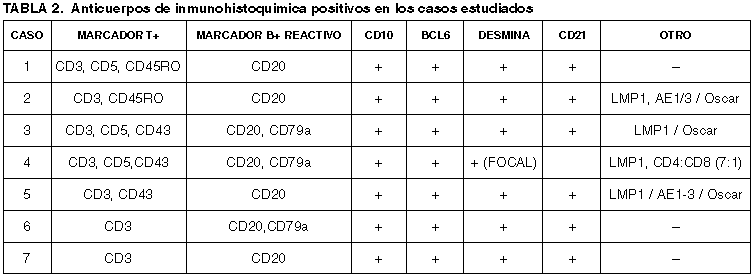
Se realizó inmunomarcación con queratina AE1/3, queratina 8, 18, 19 y queratina «Oscar» (Pheno Path /Allen Gown), para búsqueda de células intersticiales reticulares citoqueratina positivas (CIRC) y en tres casos (casos 2, 3 y 5) hubo hiperplasia de estas células distribuidas principalmente en la zona de la paracorteza (fig. 8). La inmunomarcación de estas células reticulares fue muchos más intenso son el anticuerpo Oscar.
Fig. 8: Inmunomarcación
con citoqueratinas. Izquierda AE1-3 y derecha «Oscar» (Phenopath Allen Gown).
Nótese la proliferación de células intersticiales citoqueratina positivas. Este
hallazgo fue focal en tres de los casos. La inmunomarcación con Oscar fue más
intensa.
DISCUSIÓN
El Linfoma T Angioinmunoblástico representa aproximadamente el 1,2% de todos los Linfomas no Hodgkin y entre el 15-20% de los T periféricos. Se presenta en personas de edad media o avanzada, siendo la mayoría de los pacientes mayores de 60 años. En nuestro estudio 83,33% de los pacientes fueron menores de 50 años. Al igual que lo informado en la literatura, nuestros siete casos presentaron linfadenopatía generalizada, y alteración al estado general caracterizada por fiebre, sudoración nocturna, pérdida de peso y rash cutáneo (2,11,12).
Al momento del diagnóstico aproximadamente en 70% de los casos de LTA, hay infiltración hepática, esplénica y hasta en 50% también afectación cutánea (3). La médula ósea puede estar afectada hasta en 80% de los casos; en 40% hay enfermedad pleuro-pulmonar y raramente hay afección al aparato gastrointestinal (2,3,12). La mayoría de los pacientes se presentan en estadio III o IV, y el pronóstico es pobre, con una sobrevida media de menos de 3 años (2).
Debido a la disfunción de células T secundaria al linfoma, los pacientes pueden estar inmunodeprimidos, por lo que quienes no responden al tratamiento o recaen, sucumben al linfoma o con frecuencia a sepsis. Los factores clínicos con impacto pronóstico no se conocen con precisión pues varían entre los pocos estudios disponibles, pero parecen ser en paciente con edad mayor de 60 años, cuadro clínico complejo y linfopenia (2).
La Organización Mundial de la Salud, clasifica al LTA dentro de las neoplasias de células T maduras y representa uno de los tres linfomas T de presentación primariamente ganglionar (junto con el Linfoma T periférico y el linfoma anaplásico de células grandes). En el diagnóstico morfológico del LTA se encuentra alteración de la arquitectura ganglionar con infiltración linfoide polimorfa y prominencia de vénulas de endotelio alto. Puede haber células de citoplasma claro agrupadas alrededor de los vasos pero no son un hallazgo constante (2,11,12). Los folículos linfoides pueden estar ausentes, pueden ser pequeños en regresión (burnt-out) y raramente puede haber folículos hiperplásicos (6,8). El diagnóstico diferencial con este cuadro histológico es variado y puede incluir procesos reactivos atípicos, Linfoma de Hodgkin, linfomas B y otros linfomas T periféricos (2,9). Por lo anterior se han estudiado patrones de reacción inmunohistoquímica que puede ayudar al diagnóstico preciso de LTA.
Por inmunohistoquímica se encuentra disminución de la población de linfocitos B, y predominio de linfocitos T con expresión variable de los marcadores T, con pérdida de algunos de estos antígenos principalmente CD5, CD43 y CD7. La mayoría de estos linfocitos neoplásicos son CD4+. Este patrón inmunohistoquímico es común a otros linfomas T por lo que no hace precisa la distinción entre el LTA de otros linfomas T. Recientemente algunos investigadores han encontrado la expresión de los marcadores B, CD10 y Bcl-6 en las células T neoplásicas (2,3,7). Además se ha informado que la expansión de la red de células dendríticas foliculares y células fibroblástica desmina positivas es característica del LTA y pueden ser de gran valor en el diagnóstico diferencial (2,5).
Attygalle y col demostraron que las células T con coexpresión de CD10+, pueden encontrarse hasta en 90% de los LTA, y se encuentran concentradas predominantemente en la periferia de los centros germinales (residuales) y que representan solo entre el 5 y el 30% de los linfocitos CD3+ (5,13). Existen varias evidencias de que las células CD10 positivas son las células neoplásicas en el LTA (5). Primero las células T neoplásicas pueden expresar inmunofenotipos aberrantes, aunque en general este se manifiesta como pérdida de antígenos como el CD5. Segundo las células con citoplasma claro que se observan en la mayoría de los casos de LTA, han sido constantemente CD10 positivas, como lo fueron en nuestros casos. Y la evidencia más contundente es que estas células CD10 positivas, han demostrado reordenamiento clonal del gen TCR (5).
En el estudio que aquí presentamos, hubo positividad en todos los casos para marcadores T (CD3, CD5, CD43 y CD45RO), en las células neoplásicas, con ligera disminución de CD3 en un caso y CD43 en otro, probablemente como manifestación de la pérdida de antígenos T. El CD10 se expresó en todos los casos, entre el 20 y el 40% de los linfocitos T neoplásicos, lo cual fue demostrado con CD3 y CD20 en marcaciones separadas así como por medio de doble inmunomarcaje con CD3/CD10 y CD20/CD10, donde los linfocitos neoplásicos fueron positivos simultáneamente al CD3 y al CD10 (fig. 4). Además los linfocitos CD10+ de áreas T mostraron negatividad al CD20. Solo focalmente los linfocitos B residuales fueron positivos a este anticuerpo.
La molécula CD10 (CALLA) es una proteína transmembrana con actividad de endopeptidasa neutra que se expresa en las células B centro foliculares (3,13). Sin embargo el CD10 puede estar presente en diversas líneas celulares hematopoyéticas, epiteliales y mesenquimatosas (13). Puede también expresarse en linfocitos T y B en estadios tempranos de maduración (linfoblastos), en células B del centro germinal, en un subtipo de timocitos inmaduros, en granulocitos y en células B neoplásicas en el Linfoma Folicular, Linfoma linfoblástico, linfoma de Burkitt y en algunos linfomas B difusos de células grandes. Generalmente el CD10 esta ausente en células T maduras así como en otros linfomas T periféricos. Cutrona informó la presencia de células T apoptóticas CD10+ en ganglios linfáticos con linfadenitis asociada a VIH (3,5), Estos investigadores ha propuesto que el CD10 regule la apoptosis interfiriendo con señales extracelulares (14). Se ha postulado que la expresión aberrante del CD10 en los linfocitos T en el LTA, pueda ser una indicador de alguna alteración en la muerte celular por apoptosis (14,15).
También, encontramos en todos nuestros casos aproximadamente 20% de linfocitos T neoplasicos con positividad nuclear para Bcl-6. Este anticuerpo es producto del gene Bcl-6, que es una fosfoproteína nuclear, que se expresa independientemente de los reordenamientos del gene Bcl-6 (8). La marcación inmunohistoquímica en tejido linfoide reactivo esta restringida a los núcleos de las células B del centro germinal incluyendo centroblastos, centrocitos y entre el 10 y el 15% de las células T CD4+/CD3+ dentro de los centros germinales normales (2,6). El Bcl-6 en casos de LTA puede ser identificado en las células centrofoliculares de los centros germinales residuales y en algunas de las células T interfoliculares. Por medio de doble inmunmarcación se ha demostrado que estas células Bcl-6+, expresan CD3 y son negativas a CD20. Esta expresión aberrante se ha interpretado como una subpoblación de células neoplásicas que están presente en menor porcentaje que las CD10+/CD3+. Se ha sugerido que la presencia de células T / Bcl-6+ en el LTA, son la contraparte neoplásica de las células CD4+, CD10+ Bcl-6+, que normalmente pueden encontrarse en el folículo, y que han migrado hacia el compartimiento interfolicular (14) Células Bcl-6+ /CD10- han sido encontradas en algunos casos de Linfomas T periféricos sin otra especificación (NOS), y en la linfadenitis asociada a VIH (2,7,8).
La proliferación extrafolicular de las células dendríticas foliculares y reticulares fibroblásticas desmina positivas, en el LTA es posiblemente un dato clave diagnóstico importante (7) Estas células dendríticas foliculares se hace evidentes por medio de inmunomarcación con CD21, CD35 y CD23 y se encuentran distribuidas irregularmente en el tejido afectado, particularmente asociadas a vénulas de endotelio alto. Este hallazgo puede ser de ayuda en el diagnóstico diferencial con procesos reactivos, linfoma de Hodgkin, linfoma B rico en células T e histiocitos y otros linfomas T, pues todos estos no están asociados a proliferación de células CD21+ /CD35+ (14). La proliferación de CDF puede ser muy sutil en estadios tempranos del LTA (6). En todos nuestros casos encontramos extensa expansión de la red de CDF que fue demostrado con los anticuerpos anti CD21, anti CD23 y anti CD35. Este desordenamiento de las CDF ha sido también observado en diversas lesiones linfoproliferativas con manifestaciones clínicas similares a los enfermedades autoinmunes como en la linfadenopatia asociada a enfermedad autoinmune o la Enfermedad de Castleman multicéntrico (9,10).
Cuatro de nuestros casos presentaron numerosas células CD 20 positivas con características de inmunoblastos, con positividad al anticuerpo para la proteína latente de membrana (LMP-1) del virus de Epstein Barr (VEB). Esto ha sido informado en más del 97% de los casos de LTA (16). Se han realizado estudios sobre la relación del VEB y el LTA, mostrando que el VEB se encuentra principalmente en linfocitos B y que en los casos en que hay una población monoclonal u oligoclonal de linfocitos B en el fondo de un LTA, estas células B no necesariamente son VEB+ (16). Además los pacientes con LTA raramente desarrollan linfomas difusos de células B lo que pone en consideración el papel real que juega el VEB (17). En mucha menor frecuencia, se ha detectado positivdad para VEB en las células T (2).
Otras células del sistema dendríticos que pueden estar aumentadas en número son las células reticulares desmina positivas (2). Todos nuestros 7 casos presentaron número variable de células dendríticas fibroblásticas desmina positivas, dispersas en forma irregular en el tejido neoplásico. Este hallazgo puede ser dato importante para el diagnóstico diferencial, pues, como afirma Jones y col, esta hiperplasia de las células reticulares desmina+, es constante e intensa en el LTA (10). La hiperplasia de células reticulares desmina+, ha sido descrita en afecciones inflamatorias del ganglio linfático, en carcinomas metastáticos, en linfomas como el difuso de células grandes B, el B rico en T y en linfoma de Hodgkin predominio linfocitico (10).
Por último, es interesante que tres de nuestros casos presentaron expansión de las células intersticiales citoquetarina positivas (CIRC) utilizando los anticuerpos AE1-2 y Oscar (Panqueratina del laboratorio Pheno Path Laboratories/cortesía de Allen Gown) (19), Esta nueva anti-quertaina llamada «Oscar» identifica a las queratinas 7, 8, 18, 19, y experimentalmente ha demostrado ser de mayor intensidad que la queratina AE1-3, particularmente en el inmunomarcaje de células con expresión baja de queratinas, como en las CIRC (19). Este grupo de células intersticiales (CIRC) del ganglio parece ser una subpoblación de CRF que expresan queratina y han sido encontradas predominantemente en procesos reactivos, especialmente en los asociados con activación de linfocitos T (18). No se ha informado que la presencia de CIRC sea constante en linfomas o que su proliferación participe en la fisiopatología del LTA (18).
En conclusión, presentamos el estudio de siete casos de LTA caracterizados por la expresión aberrante de CD10 y Bcl-6 en las células T neoplásicas, lo que le confiere a este linfoma un inmunofenotipo particular único (2). A lo anterior hay que agregar la expansión característica de células dendríticas foliculares CD21+/CD35+ y de células fibroblásticas desmina+, que pueden ser utilizadas como herramienta diagnóstica para esta variante de Linfoma T periférico, que en muchas ocasiones puede causar dificultad diagnóstica.
BIBLIOGRAFÍA
Frizzera G, Moral EM, Rappaport H. Angioimmunoblastic lymphadenopathy with dysproteinaemia. Lancet 1974; 303: 1070-3.
Ferry JA. Angioimmunoblastic T-cell Lymphoma. Adv Anat Path 2002; 9: 273-9.
Attygalle AD, Diss TC, Munson Ph, Isaacson P, Du MQ, Dogan A. CD10 Expression in Extranodal Dissemination of Angioimmunoblastic T-cell Lymphoma. Am J Surg Pathol 2004; 28: 54-61.
Murakami T, Ohtsuki M, Nakagawa H. Angioimmunoblastic lymphadenopathy-type peripheral T-cell lymphoma with cutaneous infiltration: report of a case and its expresion profile. Br J Dermatol 2001; 144: 878-84.
Attygalle A, Al Jehani R, Diss TC, et al. Neoplastic T cells in angioimmunoblastic T-cell lymphoma express CD10. Blood. 2002; 99: 627-33.
Ree HJ, Kadin ME, Kikuchi M, et al. Angioimmunoblastic lymphoma (AILD-Type Lymphoma With Hyperplastic Germinal Centers. Am J Surg Pathol 1998; 22: 643-55.
Yuan CM, Vergilio JA, Harris NL, Bagg A. Angioimmunoblastic T-Cell Lymphoma: A Neoplasm of Intrafollicular CD10+, BCL-6+, CD4+ Memory T- Cells? Mod Pathol 2002; 15: 271A.
Ree HJ, Kadin ME, Ko YH, Chamey D, Go JH. BCL-6+/CD3+ Interfollicular T Cells Are Increased in AILD-type T cell Lymphoma with Follicular Hyperplasia. Lab Invest 1997; 76: 132.
Kojima M, Nakamura Sh, Itoh H, Moroory T, Sugihara Sh, Shinkai h, et al. Angioimmunoblastic T-cell lymphoma with hyperplastic germinal centers: a clinicopathological an immunohistochemical study of 10 cases. APMIS 2001; 109: 699-706.
Jones D, Jofrgensen JL. Shahsafaei A, Dorfman DM. Characteristic Proliferations of Reticular an Dendritic Cells in Angioimmunoblastic Lymphoma. Am J Surg Pathol 1998; 22: 956-64.
Arber AD. Angioimmunoblastic Lymphadenpathy With Disproteinemia and Angioimmunoblastic T-Cell Lymphoma. Pathology Case Reviews 2002; 7: 105-9.
Gil-Suk Y, sung-Eun Ch, Huyng-Hoon K, Jee-Ho Ch, Kyoung-Jeh S, Kee-Chan M. Cutaneous relapse of angioimmunoblastic lymphadenopathy type peripheral T-cell lymphoma mimicking an exanthematous drug eruption. Int J Dermatol 2003; 42: 816-8.
Cook RJ, Craig E F, Swerdlow HS. Benign CD-10-Positive T Cells in Reactive Lymphoid Proliferations and B-Cell lymphomas. Mod Pathol 2003; 16: 879-85.
Cutrona G, Leanza N, Ulivi M, et al. Expression of CD10 by Human T Cells That Undergo Apoptosis Both In Vitro and In Vivo. Blood 1999; 94: 3067-76.
Yamaguchi S, Kitagawa m, Inoue M, Tomizawa N, Kamiyama T, Hirokawa k. Cell dynamics and expression of tumor necrosis factor (TNF)-alfa, interleukin-6 and TNF receptors in angioimmunoblastic lymphadenpathy-type T-cell lymphoma. Exp Mol Pathol 2000; 68: 85-94
Settl A, Seung-Sok L, Rüdiger T, et. al. Epstein-Barr Virus-Associated B-Cell lymphoproliferative Disorders in Angioimmunoblastic T-Cell Lymphoma and Peripheral T-Cell Lymphoma, Unspecified. Am J Clin Pathol 2002; 117: 368-79.
Matsue K, Itoh M, Kokubo K, Hirose Y. Development of Epstein Barr virus associated B-cell lymphoma after intensive treatment of patients with angioimmunoblastic lymphadenopathy with dysproteinemia. Int J Hematol 1998; 67: 319-29.
Sada Mier y Teran AM, Domínguez-Rosado I, Ortiz-Hidalgo C. Células Intersticiales Reticulares Citoqueratina Positivas. Estudio inmunohistoquímico en ganglios linfáticos normales, reactivos y neoplásicos y amígdalas y adenoides normales. Patología (Revista latinoamericana) 2004; 42: 97-104.
Gown AM, Yaziji H, Barry TS, Hwang HC. OSCAR, a novel broad anti-cytokeratin monoclonal antibody optimized for diagnostic immunohistochemistry. Mod Pathol 2003; 16: 322A.