
Vol. 40, n.º 1, 2007
REVISTA
ESPAÑOLA DE
Vol. 40, n.º 1, 2007 |
ORIGINALES
Pilar Soriano Sarrió, Miguel Martínez-Rodríguez, Diego Soriano, Antonio Llombart-Bosch, Samuel Navarro
Departamento de Anatomía Patológica, Hospital
Clínico Universitario de Valencia.
pilarsoriano10@yahoo.es
RESUMEN
Introducción: El sarcoma de estroma endometrial uterino es un tumor muy poco frecuente con una incidencia de 0,4 -3,4 por 100.000 mujeres, comprende menos del 1% de tumores malignos ginecológicos y el 2-5% de tumores malignos uterinos, siendo el tercer sarcoma en frecuencia después del carcinosarcoma y el leiomiosarcoma. Material y métodos: Presentamos cinco casos de sarcoma de estroma endometrial diagnosticados en un periodo de siete años con la evolución clínica de las pacientes. Resultados: Immunohistoquímicamente, estos tumores expresaban vimentina, receptores hormonales, CD10 y p53 (sarcomas de alto grado), siendo los marcadores musculares, la CK, el c-kit y ALK negativos. De estos cinco sarcomas dos de ellos eran de alto grado y tres de bajo grado (uno con diferenciación miogénica y otro combinado con áreas tipo «cordones sexuales», áreas miogénicas y áreas estromales puras). Discusión: Asimismo se plantean una serie de diagnósticos diferenciales con metodología práctica para poder caracterizar estos tumores.
Palabras clave: Sarcoma de estroma endometrial, CD10, diagnóstico diferencial, inmunohistoquímica.
SUMMARY
Introduction: Endometrial stromal sarcoma (ESS) is an infrequent neoplasm with an incidence of 0,4-3,4 cases/100.000 woman. This tumor represents less than 1% of the gynecologic malignancies as well as the 2,5% of the uterine malignant tumors being the third malignancy after carcinosarcoma and leiomyosarcoma. Patients and methods: We present five cases of endometrial sarcoma, diagnosed in a period of seven years. This study includes a complete immunohistochemical analysis as well as the follow-up of the patients. Results: Immunohistochemically, these tumors expressed vimentin, hormone receptors, CD10 and p53 (high grade sarcomas), whereas muscle markers, CK, c-Kit and ALK resulted negative. Two of the ESS were high grade tumors whereas the other three were considered low grade tumors (one with myogenic differentiation and the other combining sex cord areas, myogenic foci and pure stromal areas). Discussion: We discuss their differential diagnosis with other uterine malignant tumors.
Key words: Endometrial stromal sarcoma, CD10, differential diagnosis, immunohistochemistry.
INTRODUCCIÓN
El sarcoma de estroma endometrial uterino es una entidad poco frecuente con una incidencia de 0,4 -3,4 por 100.000 mujeres (1), comprende menos del 1% de los tumores malignos ginecológicos y el 2-5% de los tumores malignos uterinos (2). El sarcoma de estroma endometrial, afecta a mujeres entre 42-53 años, la mitad de ellas premenopáusicas aunque puede afectar a niñas (3). Suele debutar como hemorragia vaginal anormal o dolor abdominal bajo. Entre los factores de riesgo establecidos están la radioterapia previa (generalmente muchos años antes), la raza (un poco más frecuente en raza negra) y factores hormonales aun no bien establecidos.
Dentro de los sarcomas uterinos es el tercero en frecuencia (10%) después del carcinosarcoma y el leiomiosarcoma.
El sarcoma de bajo grado viene definido como aquella neoplasia no miogénica con escasa atipia y un índice mitótico bajo (<10/10HPF). La presencia de marcado carácter invasor, atipia citológica y alto índice mitótico define a los sarcomas de estroma endometrial de alto grado. El sarcoma de estroma endometrial de bajo grado supone el 0,2% de todas las neoplasias malignas del tracto genital, afecta a mujeres entre 42-58 años (generalmente se diagnostica en gente más joven que otras neoplasias uterinas), el 10-25% de ellas son premenopáusicas y un tercio de ellas presentan extensión extrauterina en el momento del diagnostico. En cuanto al pronóstico estos tumores son de crecimiento lento con una recurrencia de hasta el 50%, generalmente pélvica muchos años después. Puede dar metástasis pulmonares (9-43% de los tumores recurrentes e incluso el 10% de los tumores en estadio I). La supervivencia a los 5 años es del 67-100% con una supervivencia media de 11 años.
Los sarcomas de alto grado presentan una progresión rápida con recurrencias frecuentes generalmente pélvicas antes de los 2 años del diagnóstico inicial. La mayor parte de las pacientes con metástasis o recidiva pélvica, tiene metástasis abdominales o pulmonares.
Se puede afirmar que el estadio tumoral de la pieza quirúrgica predice tanto la supervivencia como la recurrencia (1,4). En el presente trabajo realizamos un estudio de 5 casos de sarcoma de estroma endometrial haciendo énfasis en las características anatomoclínicas e inmunofenotípicas diferenciales entre los tumores de bajo y alto grado y con otras neoplasias de características similares.
HISTORIAS CLÍNICAS
Caso 1: mujer de 78 años con antecedentes de HTA crónica, diabetes tipo II e ictus cerebral hace 12 años que acude a urgencias por metrorragias. Por ecografía se observa endometrio engrosado. Con sospecha clínica de carcinoma se decide practicar legrado sin éxito por lo que se reprograma para anexohisterectomía bilateral. La paciente muere a los 2 días de la intervención por complicaciones quirúrgicas. Caso 2: mujer de 68 años, con tratamiento hormonal sustitutivo hace 2 años, que acude a urgencias por metrorragia. Por ecografía se detecta nódulo de 26,6 mm a nivel de cara posterior endometrial compatible con pólipo, mioma o carcinoma de endometrio. Se realiza anexohisterectomía bilateral. Por RNM de control no se detecta recidiva pélvica ni metástasis a distancia tras tres meses de la intervención. Caso 3: mujer de 30 años que acude a urgencias por metrorragias profusas que precisa transfusión sanguínea. Por ecografía se detecta tumoración en cavidad endometrial de 6 cm compatible con leiomioma submucoso. Se decide realizar miomectomía con posterior anexohisterectomía bilateral. Actualmente la paciente esta bien sin recidiva local ni metástasis a distancia (3 meses posthisterectomía). Caso 4: mujer de 25 años de edad con metrorragias que por ecografía se diagnostican dos masas endometriales de 41 x 40 mm y 43 x 50 mm. Con la sospecha clínica de leiomiomas se trata con análogos hormonales durante 6 meses con persistencia de las tumoraciones. Se realiza tumorectomía con posterior histerectomía simple, no observándose recidiva pélvica ni metástasis a distancia hasta 4 años después del diagnóstico inicial apreciándose entonces una recidiva pélvica con múltiples implantes entre 7 mm y 4 cm. Se realiza laparotomía reductora y se inicia tratamiento hormonal con tamoxifeno (40 mg/día). A los 6 años por RNM se observan pequeños implantes peritoneales entre 7 mm y 1 cm que desaparecen en un posterior control por RNM (a los 7 años del diagnóstico). Actualmente esta bien sin recidivas evidenciables. Caso 5: Mujer de 37 años sin antecedentes con hipermenorrea. Tras estudio ecográfico se detecta útero polimiomatoso sin signos de degeneración. Se recomienda pauta expectante con controles periódicos. A los 3 años refiere acentuación de la hipermenorrea. En el control ecográfico se observa nuevamente un útero polimiomatoso con un mioma dominante de 6,7 x 8,6 x 5,2 cm realizándose histerectomía simple. Actualmente la mujer no presenta recidivas ni metástasis a distancia tras 1 año de la cirugía.
ESTUDIO ANATOMOPATOLÓGICO
Las piezas quirúrgicas se fijaron con solución de formaldehído al 10% y se incluyeron en parafina obteniéndose cortes de 4 micras que se tiñeron con HE y reticulina de Gomori.
El estudio inmunohistoquímico se realizó por método avidina-biotina-peroxidasa (ABC), empleando anticuerpos monoclonales o policlonales contra actina especifica de músculo liso, desmina, caldesmon, citoqueratina AE1-AE3, antígeno de membrana epitelial vimentina, proteína S-100, p53, CD10, c-kit, ALK, receptores de estrógenos, receptores de progesterona y Ki67 (tabla 1).
ESTUDIO MACROSCÓPICO
En las piezas de anexohisterectomías se observaba en el caso 1 una neoplasia endometrial de 8 x 9,5 x 5,5 cm que infiltraba tercio interno miometrial. En el caso 2 se trataba de una tumoración endometrial polipoide de 8,2 x 4,4 x 3,8 cm que infiltraba miometrio hasta su mitad externa. El caso 3 presentaba una tumoración nodular endometrial uterina de 6 x 5 x 4 cm. En el caso 4 la tumoración era nodular intramural miometrial y aparentemente bien delimitada midiendo 3 x 2,5 x 2 cm. El caso 5 presentaba una lesión similar, multinodular de 8 cm que comprimía y desplazaba el endometrio. Todos los tumores mostraban una coloración blanco-rosácea y consistencia en carne de pescado y no infiltraban ni istmo ni serosa uterina.
ESTUDIO MICROSCÓPICO
En el caso 1 se observaba una tumoración estromal endometrial fusocelular de predominio celular monomorfo con focos de pleomorfismo y gigantismo celular apreciándose más de 20 mitosis por 10 campos de gran aumento (cga) que infiltra 1/3 interno miometrial (fig. 1). En el caso 2 la imagen histológica fue similar, observándose zonas más celulares pleomórficas con un índice mitótico de 16 mitosis por 10 cga junto a otras zonas menos celulares con escasa atipia celular aunque este último componente embolizaba tanto vasos como linfáticos. Ambos casos se diagnosticaron de sarcoma de estroma endometrial de alto grado.
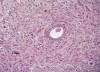
Fig. 1:
Sarcoma de estroma endometrial de alto grado (HE 20x).
En el caso 3 se observó una neoplasia maligna fusocelular estromal uterina de aspecto bastante homogéneo y con escasa atipia citológica que infiltraba el miometrio presentando algún émbolo linfático aunque no vascular sanguíneo. El índice mitótico mínimo no superó las 9 mitosis por 10 cga (fig. 2). Se apreciaba una rica trama vascular con focos aislados de hialinización vascular. El caso 4 y 5 fueron similares al anterior mostrando el caso 4 un bajo índice mitótico (1 mitosis por 10 cga) y el caso 5, áreas histológicas con imagen de cordones sexuales y áreas mas estromales, con escasa atipia celular e índice proliferativo bajo. Estos tres últimos casos se diagnosticaron de sarcoma de estroma endometrial de bajo grado mostrando el caso 4 focal diferenciación miogénica y el cinco un patrón combinado con áreas tipo «cordones sexuales», áreas miogénicas y áreas estromales puras. En ninguna de las pacientes se observó infiltración neoplásica de istmo, parametrios, ovarios o serosa.
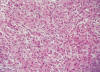
Fig. 2:
Sarcoma de estroma endometrial de bajo grado (HE 20x).
ESTUDIO INMUNOHISTOQUÍMICO
Los resultados están esquematizados en la tabla 2. Destacamos la presencia de marcadores miogénicos en los sarcomas de bajo grado así como la expresión alta de p53 e índice proliferativo alto en los sarcomas de alto grado (fig. 4) así como destacar que la expresión tanto de receptores hormonales como de CD10, fue más frecuente en los sarcomas de bajo grado (fig. 3).
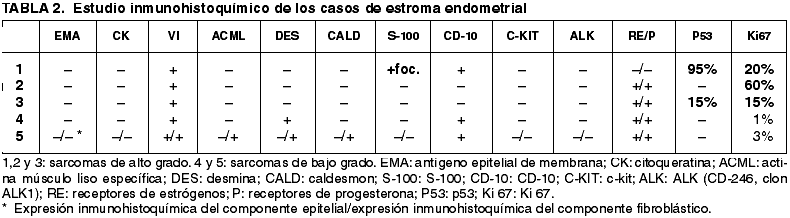

Fig. 3:
Intensa inmunotinción membranosa y citoplasmática frente al CD10 en un sarcoma
de estroma endometrial de alto grado (ABC peroxidasa 20x).

Fig. 4:
Intensa expresión nuclear de p53 en un sarcoma de estroma endometrial de alto
grado (ABC peroxidasa 20x).
DISCUSIÓN
Los sarcomas de estroma endometrial son tumores poco frecuentes siendo importante diferenciar el sarcoma de alto o bajo grado dado que la evolución clínica es distinta, así como precisar correctamente el estadio tumoral en la pieza quirúrgica ya que este es un factor que predice tanto de la recurrencia como un indicador de la supervivencia global (1,3). Así, en cuanto al sarcoma de estroma endometrial de bajo grado, suele ser de crecimiento lento con recurrencia frecuente (50%) generalmente años después (hasta 26 años) (1,5). Pueden existir metástasis generalmente pulmonares (9-43% en tumores recurrentes). A pesar de la aparente progresión neoplásica se ha descrito un caso de regresión espontánea de las metástasis pulmonares en una paciente de 56 años (6).
El sarcoma de bajo grado viene definido como aquella neoplasia no miogénica con escasa atipia y un índice mitótico bajo (<10/10HPF). La presencia de marcado carácter invasor, atipia citológica y alto índice mitótico define a los sarcomas de estroma endometrial de alto grado.
Se debe establecer un diagnóstico diferencial con una serie de entidades como el nódulo de estroma endometrial que presentaría menos de 3 mitosis por 10 cga y bordes no infiltrativos, a diferencia del sarcoma de estroma endometrial. El leiomioma celular y el leiomiosarcoma que aparte de la imagen histológica, presentarían inmunohistoquímicamente marcadores musculares y positividad frente al Fli-1, a diferencia de los sarcomas de estroma endometrial que suelen ser negativos, como lo demuestran Shutter y cols. (7); siendo el CD10 generalmente negativo (tabla 3). El tumor mixto mülleriano que presentaría un componente epitelial maligno con expresión de marcadores epiteliales aunque hay un caso descrito por McCluggage y cols (8) de sarcoma estromal con diferenciación muscular y glandular; el carcinoma pobremente diferenciado de endometrio que presentaría marcadores epiteliales y negatividad tanto para CD10 como para marcadores musculares, el tumor miofibroblástico inflamatorio que es una entidad muy rara ( hasta la actualidad hay 11 casos publicados ) (9). Histológicamente el estroma del tumor miofibroblástico seria más mixoide y con infiltrado linfoplasmocitario acompañante y aunque es una entidad benigna, se han descrito metástasis en 2 pacientes pediátricos (10) y además presenta recurrencia local frecuente. Esta última entidad mostrará positividad difusa frente ALK y focal para la actina o desmina (no presente en los sarcomas de estroma endometrial). El diagnóstico diferencial immunohistoquímico de estas entidades esta esquematizado en la tabla 3.
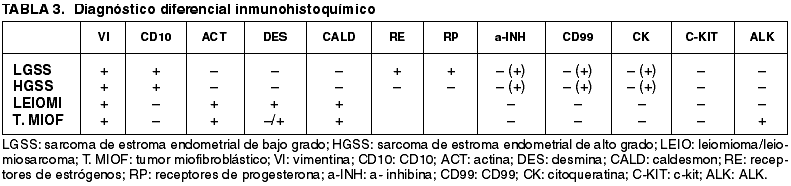
En cuanto a la expresión de CD10 en estos tumores en la literatura hay varios trabajos publicados. Toki y cols (11) afirman que el CD10 es un marcador de células estromales normales y neoplásicas. Así en el año 2000, Chu y cols (12) estudiaron 5 casos de sarcoma de estroma endometrial todos ellos expresando CD10, estos mismos autores (13) publicaron en 2001, 16 casos de sarcoma endometrial, todas ellos con expresión de CD10; también en 2001 McCluggage (14) de 13 sarcomas de bajo grado, todos ellos mostraron positividad y 4/6 sarcomas de alto grado fueron positivos. Zhu y cols en el 2004 estudiaron 26 sarcomas de estroma endometrial, 22 de ellos expresaban CD10. En el 2002 Yilmaz y cols (15) estudiaron 24 tumores primarios o metastáticos concluyendo que la presencia de diferenciación estromal endometrial en lesiones mesenquimales con un patrón predominante fenotipo mixoide y/o fibroblástico y de músculo liso de bajo grado deberían ser considerados sarcomas de estroma endometrial. También Baker y cols en 2005 (16) publicaron dos casos de sarcoma de estroma endometrial con características morfológicas inusuales como son la metaplasia grasa, metaplasia muscular lisa o estriada (como en uno de nuestros casos), núcleos bizarros con focos de diferenciación muscular y cambios fibrosos. Desde el punto de vista genético han sido descritos anomalías cromosómicas por Gil y cols (17) en dos sarcomas de estroma endometrial. Malpica y cols en 2005 (18) describieron 15 casos de sarcoma de estroma endometrial con asociación sincrónica o metacrónica a sarcomas de alto grado, hecho que se correlaciona con un comportamiento agresivo lo cual afecta tanto al pronóstico como a la terapéutica. En nuestros casos las mujeres no presentaban un segundo sarcoma.
El tratamiento establecido del sarcoma de estroma endometrial es la anexohisterectomía bilateral con terapia prolongada progesterónica (ya que es frecuente en estos tumores tanto la recurrencia (50%) como la expresión de receptores tanto de estrógenos (RE) como de progesterona (RP). Asi Katz y col en 1987 (19) ya estudiaron la expresión de RE y RP en 11 casos de sarcoma de estroma endometrial. Reich y col (20) en el año 2000 publicaron 21 casos de sarcoma de estroma endometrial de bajo grado, 15 casos (71%) con expresión de receptores de estrógenos y 20 casos (95%) con expresión de receptores de progesterona. Zhu y cols en el 2004 (21) publicaron 26 casos de sarcoma de estroma endometrial, 12 de ellos con expresión de receptores de estrógenos y 14 casos con expresión de receptores de progesterona. Bhargara y cols., en 2005, estudiaron 17 casos de sarcoma de estroma endometrial, todos ellos con positividad frente a receptores de estrógenos y 15 con positividad frente a receptores de progesterona (22).
Asimismo Ologun y cols en un estudio reciente de 17 sarcomas de estroma endometrial (11 de alto grado y 5 de bajo grado) demostraron que el 75% de ellos mostraron mutación PTEN (gen supresor tumoral), siendo el fenotipo PTEN null mas común en los de alto grado comparado con los de bajo grado (81% al 60%) (23). Además el fenotipo PTEN null es mas frecuente en los sarcomas (75%) que en las lesiones precancerosas o en los carcinomas (66%). Nosotros no hemos realizado estudio citogenético ni de microscopía electrónica en nuestros casos.
Liokumovich y col. estudiaron la expresión de metaloproteinasas (MMP) en los sarcomas de estroma endometrial realizando un estudio immunohistoquímico usando análisis de imagen. Las metaloproteinasas son un grupo de enzimas proteolíticos con papel principal en la invasión y degradación de la matriz extracelular en sarcomas de estroma endometrial. Estudiaron las MMP-2, MMP3, MMP-9 en 11 sarcomas, 4 de bajo grado y 7 de alto grado. Concluyeron en que no hay una aparente correlación entre la tinción por algunos de estos enzimas y la supervivencia (24).
Por último señalar que ni la quimioterapia adyuvante, ni la radioterapia son efectivos en el tratamiento de los sarcomas de estroma endometrial, aunque hay algún estudio en el que los pacientes se benefician con el tratamiento con terapia adyuvante con cisplatino y adriamicina (25,26), ifosfamida (27) o doxorrubicina (28). Asimismo hay otros estudios en los que se demuestra que el tratamiento radioterápico disminuye la recurrencia en la zona irradiada pero no altera la supervivencia (29,30). Tampoco los inhibidores de la tirosin kinasa son efectivos en estos tumores ya que los tumores de estroma endometrial suelen ser negativos para la expresión como lo refleja Klein y cols (31) en un estudio de la expresión de c-kit en 38 tumores mesenquimales entre ellos 2 sarcomas de estroma endometrial de alto grado los cuales no mostraron expresión y 10 sarcomas de estroma endometrial, de bajo grado también negativos menos uno que presentaba <5% de las células positivas. Por el contrario recientemente se han descrito la expresión de PDGFR-alfa en sarcomas de estroma endometrial, postulando y abriendo una nueva vía para el tratamiento con ST1571 (32).
BIBLIOGRAFÍA
Collins YC, Odunsi K, Driscoll D, Lele S. Risk factors for recurrence and survival in endometrial stromal sarcoma: a thirty year experience at Roswell Park Cancer Institute. Gynecologic cancer 2002 ASCO Annual Meeting. Proc Am Soc Clin Oncol 21: 2002 (abstr 2513).
Major FJ, Blessing JA, Silverberg SG, et al. Prognostic factors in early-stage uterine sarcoma: a Gynecologic Oncology Group study. Cancer 1993; 71: 1702-9.
Nair R. P, Sebastian P. Endometrial stromal Sarcoma Presenting as puberty menorrhagia. Online J Health Allied Scs 2005; 1: 7-10.
Forney JP, Buschbaum Hj. Classifying, staging, treating uterine sarcomas. Contemporary Ob/Gyn 1981; 18: 47, 50, 55-6, 61-2, 64, 69.
Yokosuka K, Kumagai M, Aiba S. Low- Grade Endometrial Sarcoma Recurring After 9 Year. South Med J 2002; 95: 1196-200.
Ota S, Shinagawa K, Ueoka H , et al. Spontaneous regression of metastatic endometrial stromal sarcoma. Japanese J Clinical Oncol 2002; 32: 71-4.
Shutter J, van Sant CL, Wick MR, Atkins KA. Fli-1 in uterine mesenchymal neoplasms. 95th Annual meeting International Academy of Pathology. Lab Invest 2006; 86 suppl 1 (abstr 909).
McCluggage WC, Cromie AJ, Bryson C, Traub AI. Uterine endometrial sarcoma with smooth muscle and glandular diferentiation. J Clin Pathol 2001; 54: 481-3.
Rabban J T, Zaloudek CH J, Shekitka K M, Tavassoli F A. Inflamatory Myofibroblastic tumor of the uterus. A clinicopathologic study of 6 cases emphasizing distinction from aggresive mesemchymal tumors. Am J Surg Pathol 2005; 29: 1348-55.
Biselli R, Boldrini R,Ferlini C, et al. Inflammatory myofibroblastic tumor (inflamatory pseudotumor ): DNA cytometric analysis of nine pediatric cases. Cancer 1996; 77: 778-84.
Toki T, Shimizi M,Takagi Y, Ashida T, Konishi I.CD10 is a marker for normal and neoplastic endometrial stromal cells.Int J Gynecol Pathol 2002; 21: 41-7.
Chu P, Arber DA. Paraffin-section detection of CD10 in 505 nonhematopoietic neoplasms. Frequent expression in renal cell carcinoma and endometrial stromal sarcoma. Am J Clin Pathol 2000; 113: 374-82.
Chu PG, Arber DA, Weiss LM, Chang KL. Utility of CD10 in distinguishing between endometrial stromal sarcoma and uterine smooth muscle tumors: an immunohistochemical comparison of 34 cases. Mod Pathol 2001; 14: 465-71.
McCluggage WG, Sumathi VP, Maxwell. CD10 is a sensitive and diagnostically useful immunohistochemical marker of normal endometrial stroma and of endometrial stromal neoplasms. Histopathology 2001; 39: 273-8.
Yilmaz A, Rush D, Soslow R. Endometrial stromal sarcoma with unusual histologic features: a report of 24 primary and metastatic tumors emphasizing fibroblastic and smooth muscle differentiation. Am J Surg Pathol 2002; 26: 1142-50.
Baker PA, Moch H, Oliva E. Unusual morphologic features of endometrial stromal tumors. Am J Surg 2005; Pathol 29: 1394-8.
Gil-Benso R, López-Gines, Navarro S, Carda C, Llombart-Bosch A. Endometrial stromal sarcomas: immunohistochemical, electron microscopical and cytogenetic findings in two cases. Virchow Arch 1999; 434: 307-14.
Ologun B, Quddus MR, Sung CJ, Steinhoff MM, Bai H, Kasznica JM, Lawrence WD. PTEN Mutation in endometrial stromal sarcomas. 95th Annual meeting International Academy of Pathology. Lab Invest 2006 ; 86 suppl 1 (abstr 885).
Katz L, Merino MJ, Sakamoto H. Endometrial stromal sarcoma: a clinicopathologic study of 11 cases with determination of estrogen and progestin receptor levels in three tumors. Gynecol Oncol 1987; 26: 87.
Reich O, Regauer S, Urdl W , et al. Expression of oestrogen and progesterone receptors in low-grade endometrial stromal sarcomas. Br J Cancer 2000; 82: 1030-4.
Zhu XP, Shi YF, Cheng XD, Zhao CL, Wu YZ. Immunohistochemical markers in differential diagnosis of endomerial stromal sarcoma and cellular leiomyoma.Gynecol Oncol 2004; 92: 71-9.
Bhargara R, Shia J, Hummer AJ, Thaler HT, Tornos C, Soslow. Distinction of endometrial stromal sarcomas from «hemangiopericytomatous »tumors using a panel of immunohistochemical stains. Mod Pathol 2005; 18: 40-7.
Peters WA, Rivkin SE, Smith MR, et al. Cisplatin and Adriamycin combination chemoterapy for stromal sarcomas and mixed mesodermal tumors. Gynecol Oncol 1989; 34: 323-7.
Liokumovich P, Goldberg I, Davidson B, et al. Expression of metalloproteinases endometrial sarcoma: immunohistochemical study using image analysis. J Clinical Pathol 1999; 52: 198-202.
Omura GA, Blessing JA, Major F, et al. A randomized clinical trial of adjuvant Adriamycin in uterine sarcomas: a Gynecologic Oncology Group study. J Clin Oncol 1985; 3: 1240-5.
Sutton G, Brunetto VL, Kilgore L, et al. A phase III trial of ifosfamide with or without cisplatin in carcinosarcoma of the uterus: a Gynecologic Oncology Group study. Gynecol Oncol 2000; 79: 147-53.
Muss HB, Bundy B, DiSaia PJ, et al. Treatment of recurrent or advanced uterine sarcoma. A randomized trial of doxorubicin versus doxorubicin and cyclophosphamide (a phase III trial of the Gynecologic Oncology Group). Cancer 1985; 55: 1648-53.
Hornback NB, Omura G, Major FJ. Observations on the use of adjuvant radiation therapy in patiens with stage I and II uterine sarcoma. Int J of Rad Oncol, Biol, Physics 1986; 12: 2127-30.
Pecorelli SL, EORTC Gynecological Cancer Group. Phase III randomized study of adjuvant pelvic radiotherapy versus observation alone in patients with completely resected, stage I or II, high-grade uterine sarcoma (summary Last Modified 12/2001), EORT-55874, clinical trial, closed, 08/10/2001.
Klein W, Kurman R. Lack of expression of c-kit protein in mesenchymal tumors of the uterus and ovary. Int J Gynecol Pathol 2003; 22: 181-4.
Liegl B, Reich O, Nogales FF. Regauer S. PDGFRa and PDGFRb are expressed in endometrial stromal sarcoma: a potential therapeutic target for tyrosine kinase inhibitors. Histopathology 2006; 49: 545-6.
Malpica A, Deavers MT, Silva EG. High-grade sarcoma in endometrial stromal sarcoma: dedifferentiated endometrial stromal sarcoma. 95th Annual meeting International Academy of Pathology. Lab Invest 2006; 86 suppl 1 (abstr 872).