
Vol. 40, n.º 2, 2007
REVISTA
ESPAÑOLA DE
Vol. 40, n.º 2, 2007 |
ORIGINALES
Marta Piqueras Franco, Rosa Noguera Salvá, Julia Cruz Mojarrieta, Manish Mani Subramaniam, Victoria Castel Sánchez1, Antonio Llombart-Bosch, Samuel Navarro Fos
Departamento de Patología, Facultad de Medicina y
Odontología, Universidad de Valencia. Blasco Ibáñez, 15. Valencia. 46010.
Valencia. España.
1 Oncología Pediátrica, Hosp. Universitario La Fe, València.
moguera@uv.es
RESUMEN
Antecedentes: Los tumores neuroblásticos son de los tumores pediátricos más frecuentes. A pesar de su gran variedad genética, clínica e histopatológica, la amplificación del gen MYCN es siempre un indicador de mal pronóstico. Este oncogen codifica una proteína nuclear que se une al ADN y activa la transcripción de sus genes diana. Un aumento en el número de copias del gen no se corresponde siempre con sobreexpresión de su proteína. El valor pronóstico de la detección de la proteína es controvertido. Métodos: Se han analizado 220 muestras de NB. Mediante la técnica de FISH se ha establecido el estado del gen, mientras que la inmunohistoquímica ha permitido el estudio de la expresión de la proteína en secciones de parafina. Resultados: Los 15 casos con ganancia y 140 de los 141 casos sin amplificación del gen MYCN no expresan la proteína. En el grupo de los 55 casos amplificados, el 76,4% han sido positivos y 23,6% negativos. Conclusiones: Los niveles de expresión génica no siempre corresponden con el número de copias del gen, ya que intervienen muchos mecanismos moleculares. La mayoría de los casos positivos para este anticuerpo presentan amplificación, así que el estudio inmunohistoquímico de su expresión podría utilizarse para aproximar el estado del gen MYCN en aquellos laboratorios de diagnóstico donde las técnicas moleculares no estén disponibles.
Palabras clave: Neuroblastoma, proteína mycN, gen MYCN.
SUMMARY
Introduction: Neuroblastic tumors are one of the most frequent pediatric tumor. Despite their genetic, clinic and histopathologic variety, MYCN gene amplification is always considered as an adverse prognosis factor. MYCN gene encodes a nuclear protein which binds DNA and activates target genes transcription. An increase of gene copies number not always involves a protein overexpression. The prognostic value of the determination of mycN protein is controversial. Materials and methods: 220 NB samples were analyzed. We established the gene status by FISH and we studied the protein expression in paraffin sections by immunohistochemistry. Results: 15 gain samples and 140 from 141 non-amplified samples don’t express MYCN protein. From 55 amplified cases, 76.4% were positive and 23.6% were negative. Conclusions: Gene expression levels do not always match with gene copies number due to different molecular mechanisms. Most of positive cases to mycN protein are amplified samples. This antibody could be used to approach gene status in those laboratories without available molecular techniques.
Key words: Neuroblastoma, mycN protein, MYCN gene.
INTRODUCCIÓN
Los tumores neuroblásticos se encuentran entre los tumores sólidos pediátricos más frecuentes. Son tumores que se presentan con una gran heterogeneidad clínica, genética e histopatológica. Hay diferentes tipos (clínicos, histológicos y genéticos) porque hay diversos factores extracelulares y celulares implicados que pueden generar esa situación. La edad media de diagnóstico son 2 años, aunque casi la mitad de los casos se diagnostican en niños menores de 1 año, con diferentes manifestaciones clínicas y de evolución muy variable (1). Los neuroblastos son células migratorias de la cresta neural que formarán, entre otras estructuras, las cadenas ganglionares simpáticas, la médula suprarrenal y los paraganglios. En condiciones normales, la mayor parte de ellos muere por apoptosis entre la 26.ª y 40.ª semana de gestación; el resto sufre un proceso de diferenciación dando lugar a neuronas post-ganglionares y/o células neuroendocrinas (1). Pero si los neuroblastos no se diferencian completamente ni tampoco mueren, entonces se puede desarrollar un neuroblastoma.
El factor biológico pronóstico por excelencia es el estado del gen MYCN. Brodeur y Seeger (2) establecieron la relación entre la amplificación del gen (alto número de copias) y un pronóstico desfavorable. Desde entonces, su análisis mediante diversas técnicas como Southern Blot (SB), Polymerase Chain Reaction (PCR), Flurescence In Situ Hybridization (FISH), es un criterio, junto con edad, estadio e histopatología, para decidir el tratamiento más eficaz. Desde un punto de vista molecular, el aumento en el número de copias de un gen provoca un aumento de su transcripción y, por tanto, de los niveles de ARNm; mayor cantidad de ARNm implica más traducción y un aumento de la proteína codificada por ese gen; y el aumento de esta proteína podría explicar algunos efectos de la amplificación del gen. El gen MYCN codifica 2 proteínas inestables y nucleares. En realidad son 2 isoformas que tienen puntos de inicio de la traducción diferentes. Son fosforiladas por el enzima CKII y acaban pesando entre 58 y 64 kDa (3). El extremo C terminal presenta 3 zonas diferenciadas: BR (zona de unión al ADN), HLH (zona de interacción con otras proteínas mediante la conformación hélice-vuelta-hélice) y Zip (zona con residuos de leucina). El extremo N terminal presenta una zona de unión al ADN para activar la transcripción. Se ha demostrado que las mutaciones, cambios o deleciones en el extremo C terminal (zonas de unión a proteínas como Max) reducen el potencial oncogénico de la proteína (4,5) ya que necesita formar heterodímeros con Max para poder unirse al ADN (6,7) e inducir la proliferación celular, la transformación tumoral y la activación de la transcripción de los genes diana de MYCN (8). Los niveles elevados de proteína mycN no son suficientes para provocar cambios, pero sí son necesarios.
Si un aumento en el número de copias del gen implica pronóstico desfavorable, ¿la cantidad de proteína presente en las células tumorales podría ser un factor pronóstico? El objetivo de este estudio es comparar el estado del gen MYCN, analizado mediante FISH, con la proteína mycN, detectada mediante estudio inmunohistoquímico, en 220 muestras de neuroblastoma para establecer el posible valor pronóstico de los niveles de proteína.
Este estudio inmunohistoquímico incluye el anticuerpo Ki-67: un marcador nuclear de proliferación celular, que se relaciona con el grado de diferenciación del tumor.
MATERIAL Y MÉTODOS
Se han estudiado 220 de las más de 500 muestras de tumores neuroblásticos recogidas por el Centro Español de Referencia para estudios biológicos y anatomopatológicos de Neuroblastoma de la SEOP (Sociedad Española de Oncología Pediátrica), desde enero de 1999 hasta diciembre de 2005. Han sido analizadas histopatológicamente siguiendo los criterios de INPC (International Neuroblastoma Pathology Classification) para diagnosticarlos mediante tinción con hematoxilina-eosina y anticuerpos específicos, como NB84, en secciones de parafina. La clasificación final de las muestras es la siguiente: 33 NB indiferenciados (NB i), 117 NB pobremente diferenciados (NB pd), 15 NB en diferenciación (NB ed), 26 «Not Otherwise Specified» (NOS), 18 ganglioneuroblastomas (GNB), 7 ganglioneuromas (GN), 3 metástasis y 1 NB in situ.
La mayoría de las muestras presentaban porcentajes de células tumorales por encima del 50%.
El estado del gen MYCN se ha analizado mediante FISH con la sonda 2p24 (MYCN) red/ a-sat. 2 (D2Z) green de QBIOgene (KREATECH Biotechnology BV, Amsterdam, Holanda), estudiando el número de copias presentes en, al menos, 200 núcleos de cada muestra.
El protocolo para las muestras parafinadas (20) comienza con la desparafinado con xilol y la rehidratación con alcoholes decrecientes. Las muestras reciben un pretratamiento con olla a presión con tampón citrato al 1:10 y después son digeridas con proteinasa K a 37ºC. Se lavan con tampón 2xSSC y se fijan con formalina tamponada al 10%. Las muestras lavadas y secas son codesnaturalizadas junto con la sonda a 90ºC y se dejan hibridando toda la noche a 37ºC. El segundo día son lavadas con 0,3% NP-40/tampón 2xSSC a temperatura ambiente y a 73ºC. Se realiza la contratinción con DAPI antifade de QBIOgene (KREATECH Biotechnology BV, Amsterdam, Holanda).
Las muestras no parafinadas (220) son fijadas con paraformaldehido al 4% a 4ºC. Después se lavan con tampón PBS y son digeridas con pepsina a 37ºC. Se lavan de nuevo con tampón PBS y son deshidratadas y se dejan secar. Se codesnaturalizan con la sonda a 78ºC y se dejan hibridando toda la noche a 37ºC. Al día siguiente son lavadas con formamida /2xSSC al 50% y pH=7 a 43ºC, fijadas con paraformaldehido al 4% a 4ºC y lavadas con PBS. Después de ser deshidratadas y secas, se hace la contratinción con DAPI antifade.
La interpretación del FISH se hizo siguiendo los criterios del ENQUA (European Neuroblastoma Quality Assessment group), siendo AMPLIFICADOS (MNA) aquellos con más de 4 veces el número de señales de MYCN en relación con el número de señales del centrómero del cromosoma 2. El grupo de GANANCIAS (MNG) se define como aquellos casos entre 1 y 4 veces más el número de señales de MYCN en relación con el número del centrómero del cromosoma 2. Las muestras NO AMPLIFICADAS (MNNA) son aquellas con el mismo número de señales de MYCN que del centrómero del cromosoma 2 (fig. 1).
El estudio inmunohistoquímico en secciones de parafina se realiza con el anticuerpo primario purificado de ratón anti-mycN humano clon B8.4.B de BD Pharmingen Technical (Heidelberg, Alemania) con una dilución 1:100 y el kit de visualización ENVISION (DAKO DIAGNOSTICS, Dinamarca).
La técnica inmunohistoquímica utilizada comienza con la desparafinado de las secciones con xilol y la hidratación con alcoholes decrecientes. Se hace un desenmascaramiento antigénico con tampón citrato al 1:10 en una olla a presión. Con las muestras frías y lavadas, se hace la inhibición de la peroxidasa endógena con 0,3% H2O2/metanol. Después de lavar las muestras con agua, se bloquea el colágeno con suero bovino fetal al 20%. Sin lavar se incuban las muestras en el anticuerpo primario una hora. Se utiliza el sistema ENVISION para la visualización y se revela en oscuridad con di-amino benzidina (DAB) disuelta en 0,5% H2O2/tampón Tris 0,2N y pH=7. El DAB se bloquea con lejía y las muestras se lavan con agua. Se contrastan los núcleos con hematoxilina y se montan con entellán.
La interpretación de la inmunohistoquímica la realizaron 2 patólogos de manera independiente y se codificó según el porcentaje de células que presentaban tinción nuclear. Se consideraron muestras POSITIVAS aquellas con más de un 5% de núcleos marcados, mientras que las muestras NEGATIVAS fueron aquellas con menos del 5%. Se valora el patrón de tinción, considerando FOCAL cuando existe un foco positivo dentro de la zona tumoral, HETEROGÉNEO si hay múltiples focos positivos incluidos y HOMOGÉNEO cuando la tinción es uniforme en la muestra tumoral (fig. 1). También se analizan la intensidad de tinción y el porcentaje de células teñidas. El estudio inmunohistoquímico se completa con el marcador Ki-67 (en nuestro caso clon MIB-1 de DAKO, Dinamarca), que tiñe células en cualquier fase del ciclo celular excepto G0.
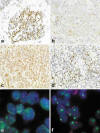
Fig 1:
Microfotografías de los diferentes patrones e intensidades de tinción del
anticuerpo anti-mycN. a: patrón focal e intenso; b: patrón homogéneo y débil; c:
patrón homogéneo y moderado; d: patrón heterogéneo e intenso. Imágenes de FISH
mostrando la amplificación del gen MYCN (señales verdes) respecto al centrómero
del cromosoma 2 (señales rojas). e: dobles minutos (dmins); f: zonas
homogéneamente teñidas (HSRs).
RESULTADOS
Las 220 muestras analizadas se han dividido en dos grupos, según el resultado de la técnica inmunohistoquímica (tabla 1 y tabla 2). De todas las muestras analizadas, tan sólo 9 han sido no valorables debido al estado del material.
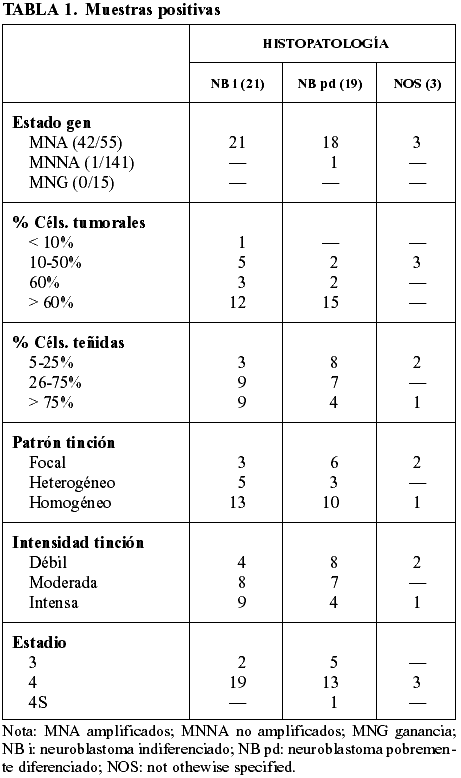

Todos los casos de ganancia (MNG) presentan resultado negativo para la proteína, igual que casi todos los casos no amplificados (MNNA). En el grupo de las muestras amplificadas (MNA) para el gen MYCN encontramos que el 76,4% son positivas mientras el 23,6% son negativas. De los casos positivos, hay muestras donde el porcentaje de núcleos teñidos es muy bajo frente a otras donde la mayor parte de las células son positivas. Para el único caso de MYCN no amplificado pero positivo para la proteína, el estado del gen ha sido analizado por FISH y confirmado también por PCR en nuestro departamento. Además, se pidió el análisis externo del plasma sanguíneo para detectar la presencia de copias del gen MYCN y resultó no amplificado (9).
Además, todos los NB i analizados con Ki-67 han sido positivos, mientras que los tumores con índice de proliferación más baja corresponden a los tumores más diferenciados, como GNB, NB ed y algunos NB pd; los NB que presentan porcentajes más altos de células teñidas con Ki-67 son los NB i y NB pd, tanto amplificados como no amplificados, además de NOS (todos MNNA). En el caso de las muestras negativas para este marcador, sólo 2 de las 23 correspondían a tumores amplificados.
DISCUSIÓN
El análisis del número de copias del gen MYCN es un factor pronóstico bien establecido en tumores neuroblásticos. Hay muchas técnicas que permiten el análisis del estado del gen de una manera más o menos cuantitativa. Se puede utilizar el Southern Blot, que es cuantitativa pero no individual, del mismo modo que la PCR. Es decir, informan en general de la dosis génica de una muestra. El problema es que las muestras contienen células tumorales, pero también células no tumorales en porcentajes variables. En el caso de muestras con gen ganado o porcentajes muy bajos de células tumorales es una limitación que hay que tener en cuenta (10,11). Frente a estas técnicas encontramos el FISH, la técnica utilizada en este estudio y que presenta ventajas. Se analizan núcleos celulares, por tanto, permiten una descripción detallada (porcentaje y número concreto de copias) de los diferentes clones presentes en cada muestra. Existen protocolos diferentes que permiten utilizarla para material diverso, como secciones de parafina, improntas, extensiones de medula ósea, ... También permite visualizar la forma en que se amplifica el gen. Las copias originales del gen se mantienen en su localización cromosómica 2p24 (12), mientras que la amplificación puede seguir diferentes procesos moleculares: dobles minutos (dmins) o regiones homogéneamente teñidas (HSR). En el caso de los dmins, este ADN es extracromosómico y circular; mientras que las HSR aparecen dentro del genoma pero en localizaciones diferentes del cromosoma 2. En nuestro estudio, la mayor parte de las amplificaciones presentaban dmins, y tan sólo 3 casos (2 NB i y 1 NB pd) mostraban HSR. Los casos con ganancia presentan otros mecanismos: podemos encontrar isocromosomas 2 o 2p que contienen las copias adicionales, duplicaciones de la zona 2p24, traslocaciones no equilibradas del extremo 2p, entre otros (13). Es decir, hay una gran variedad de localizaciones y orígenes de las nuevas copias del gen. El FISH, además, es una técnica rápida y sencilla de realizar. Todo eso la convierte en una buena opción a la hora de hacer análisis rutinarios para el diagnóstico de neuroblastomas.
Los genes se transcriben a ARNm y éste se traduce a proteínas. Hay autores que relacionan la inhibición del ARNm MYCN con una reducción de la división celular y un aumento de la diferenciación en líneas celulares neuroblásticas (8), mientras que otros observan una tendencia no estadística entre niveles elevados de ARNm en NB avanzados no amplificados y una mejor evolución (14). Todos nuestros casos de neuroblastomas indiferenciados han mostrado alto nivel de proliferación (Ki-67).
Para la detección de una proteína, la técnica inmunohistoquímica es la más utilizada para el diagnóstico. En nuestro caso se han analizado secciones de parafina, que mantienen la organización tisular y facilitan el reconocimiento de las zonas tumorales, incluso, de grupos o nidos dentro de la misma muestra. El anticuerpo primario que hemos utilizado es monoclonal y reconoce específicamente el extremo N terminal de la proteína, aquel que le permite activar la transcripción de sus genes diana. Frente al estudio genético, donde ya hace tiempo que se comercializa la sonda específica, el estudio de expresión proteica ha ido más lento porque no se disponía de un anticuerpo purificado específico. Después de este estudio, y teniendo en cuenta los altos porcentajes de coincidencia entre los resultados de análisis proteico y de análisis genético (97,7% de los casos positivos para la proteína (42/43) son amplificados para el gen), podemos comenzar a plantear esta técnica, y este clon en concreto, como una alternativa de pronóstico en aquellos centros donde la tecnología del FISH todavía no esté disponible (15).
También hemos encontrado los niveles altos de proteína mycN en una muestra no amplificada. En principio, un aumento del número de copias activas del gen implica un aumento de los niveles de ARNm, que se puede cuantificar utilizando la Reverse Transcription-PCR en tiempo real (real time RT-PCR). ¿Por qué no todos los casos amplificados y ganados presentan gran cantidad de proteína? Los niveles de expresión génica (ARNm) dependen del número de copias del gen y de su nivel de transcripción. Es evidente que un aumento en el número de copias del gen no es suficiente para aumentar los niveles de proteína en la célula. ¿Cómo explicar altos niveles de proteína en un caso no amplificado? Puede ser que la traducción está activada, puede ser que las rutas de degradación del ARNm o de la proteína no funcionen, ... Una muestra no amplificada también puede presentar niveles altos de ARNm si sufre una activación continuada del gen en concreto (10). Se trata de un neuroblastoma pobremente diferenciado con un 80% de neuroblastos, 26 meses de edad y una ploidía de 1,41. Algunos estudios apuntan que la sobreexpresión de un gen sin aumento del número de copias se explica por mecanismos moleculares como la metilación del ADN (16), aunque no se conoce aún el significado clínico. De hecho, aquellos neuroblastomas con sólo dos copias del gen pero con niveles elevados de ARNm tienden a presentar perfiles de expresión génica similares a los casos amplificados con niveles altos de ARNm (17).
Por tanto, está claro que no hay una correlación directa entre el número de copias del gen y altos niveles de proteína. Pero si la amplificación del gen es pronóstica de evolución desfavorable, ¿cómo provoca los efectos en la maquinaria celular sin la acción de la proteína que codifica? La proteína mycN es un regulador transcripcional que afecta a muchos genes. El amplicón MYCN incluye otros genes que también se sobreexpresan; descubrir aquellos que co-amplifican con el gen MYCN nos informaría de otros genes implicados en la biología tumoral. Necesitamos saber más sobre los perfiles de expresión génica de los neuroblastomas para realizar clasificaciones moleculares que nos permitan una mejor aproximación clínica (17).
Quizá no se requieren niveles altos de proteína, sino modificaciones post-traduccionales que la hagan más activa y eficaz. Quizá es más importante que encuentre las proteínas necesarias para formar heterodímeros y así funcionar. Quizá los mecanismos moleculares que aumentan el número de copias permiten la síntesis de otros productos capaces de modificar el funcionamiento celular (¿ARN de interferencia?)
¿Cuál es entonces el papel de la proteína mycN en la evolución de los neuroblastomas?
Aunque sabemos que no podemos considerar la expresión de la proteína mycN como un factor pronóstico equivalente a la amplificación del gen MYCN, tendremos que estudiar cuál es su papel y relacionarla con otros factores biológicos que nos ayuden a tener una visión global y más completa del comportamiento de esta enfermedad tan compleja desde el punto de vista génico y que presenta tanta variedad clínica.
AGRADECIMIENTOS
Este estudio ha sido posible gracias al apoyo de los proyectos PI05/0383 y FIS G03/89 (RITSI) de la red temática de investigación cooperativa del Instituto Carlos III de Madrid.
Damos las gracias a A. Sempere y C. Mongort, del departamento de Patología, por el apoyo técnico que nos han proporcionado. Gracias también a Valérie Combaret, del Laboratoire d’Oncologie Moléculaire del Centre Leon Berard de Lyon, por sus análisis de plasma sanguíneo.
BIBLIOGRAFÍA
Ferris i Tortajada J, Ortega Garcia JA, Garcia i Castell J, Lopez Andreu JA, Berbel Tornero O, Crehua Gaudiza E. Factores de riesgo para el neuroblastoma. An Pediatr (Barc) 2005. 63: 50-60.
Brodeur G.M., R.C. Seeger, Gene amplification in human neuroblastomas: basic mechanisms and clinical implications. Cancer Genet Cytogenet 1986; 19: 101-11.
Ramsay G, Stanton L, Schwab M, Bishop JM. Human proto-oncogene N-myc encodes nuclear proteins that bind DNA. Mol Cell Biol 1986; 6: 4450-7.
Ueno K, Katoh K, Kondoh H. Subnuclear localization and antitransforming activity of N-myc:beta-galactosidase fusion proteins. Mol Cell Biol 1988; 8: 4529-32.
Nakajima H, Ikeda M, Tsuchida N, Nishimura S, Taya Y. Inactivation of the N-myc gene product by single amino acid substitution of leucine residues located in the leucine-zipper region. Oncogene 1989; 4: 999-1002.
Wenzel A, Cziepluch C, Hamann U, Schurmann J, Schwab M. The N-Myc oncoprotein is associated in vivo with the phosphoprotein Max(p20/22) in human neuroblastoma cells. Embo J 1991; 10: 3703-12.
Billaud M, Isselbacher KJ, Bernards R. A dominant-negative mutant of Max that inhibits sequence-specific DNA binding by Myc proteins. Proc Natl Acad Sci U S A, 1993; 90: 2739-43.
Lu X, Pearson A, Lunec J, The MYCN oncoprotein as a drug development target. Cancer Lett 2003; 197: 125-30.
Gotoh T, Hosoi H, Iehara T, Kuwahara Y, Osone S, Tsuchiya K, Ohira M, Nakagawara A, Kuroda H, Sugimoto T. Prediction of MYCN amplification in neuroblastoma using serum DNA and real-time quantitative polymerase chain reaction. J Clin Oncol 2005; 23: 5205-10.
Spitz R, Hero B, Skowron M, Ernestus K, Berthold F. MYCN-status in neuroblastoma: characteristics of tumours showing amplification, gain, and non-amplification. Eur J Cancer 2004; 40: 2753-9.
Tanaka S, Tajiri T, Noguchi S, Shono K, Ihara K, Hara T, Suita S. Clinical significance of a highly sensitive analysis for gene dosage and the expression level of MYCN in neuroblastoma. J Pediatr Surg 2004; 39: 63-8.
Corvi R, Amler LC, Savelyeva L, Gehring M, Schwab M. MYCN is retained in single copy at chromosome 2 band p23-24 during amplification in human neuroblastoma cells. Proc Natl Acad Sci USA 1994; 91: 5523-7.
Valent A, Le Roux G, Barrois M, Terrier-Lacombe MJ, Valteau-Couanet D, Leon B, et al. MYCN gene overrepresentation detected in primary neuroblastoma tumour cells without amplification. J Pathol 2002; 198: 495-501.
Cohn SL, London WB, Huang D, Katzenstein HM, Salwen HR, Reinhart T, et al. MYCN expression is not prognostic of adverse outcome in advanced-stage neuroblastoma with nonamplified MYCN. J Clin Oncol 2000; 18: 3604-13.
Noguera R, Piqueras M, Subramaniam M, Cruz J, Cañete A, Llombart-Bosch A, et al. Immunohistochemical evaluation of a novel clone of monoclonal anti-mycN antibody B8.4B in neuroblastic tumors: A correlation with MYCN gene status. Virchows Arch 2006; 449: 277-8.
Ballestar E, Esteller M. The impact of chromatin in human cancer: linking DNA methylation to gene silencing. Carcinogenesis 2002; 23: 1103-9.
Alaminos M, Mora J, Cheung NK, Smith A, Qin J, Chen L, Gerald WL. Genome-wide analysis of gene expression associated with MYCN in human neuroblastoma. Cancer Res 2003; 63: 4538-46.