
Vol. 40, n.º 2, 2007
REVISTA
ESPAÑOLA DE
Vol. 40, n.º 2, 2007 |
ORIGINALES
Francisco José Gómez García1, Vicente Vicente Ortega1, Nuria Álvarez Sánchez1, Josefa Yáñez Gascón1, Miguel Alcaraz Baños2, Lydia Ortiz Ortiz1
Cátedra de Anatomía Patológica, Facultad de
Medicina, Universidad de Murcia. Campus de Espinardo, 30100 Murcia. España.
Telf.: 968 367150. Fax: 968 364150.
1 Cátedra de Anatomía Patológica, Dep. Oftalmología,
Otorrinolaringología y Anatomía Patológica.
2 Cátedra de Radiología y Medicina Física, Dep. Dermatología,
Estomatología, Radiología y Medicina Física.
vvortega@um.es
RESUMEN
Antecedentes: La piel puede sufrir, además del envejecimiento cronológico, el fotoenvejecimiento, secundario a las radiaciones ultravioletas, las cuales se consideran el carcinógeno ambiental más potente. Material y métodos: Hemos utilizado 32 ratones Swiss en 4 grupos: I. control; II. TPA (102 sesiones); III. UVA (102 sesiones, 120 minutos/sesión); IV. TPA y UVA (32 sesiones, 120 minutos/sesión). Al final realizamos la necropsia. La piel del lomo y orejas fueron incluidas en parafina por el método habitual, seccionadas a 5 µm y teñidas con H.E. Valoramos diversos criterios histológicos epidérmicos y dérmicos (+, ++ o +++), por dos observadores distintos. Resultados: Hemos establecido un modelo de fotoenvejecimiento en los dos grupos tratados con UVA que presentaban lesiones de displasia moderada a severa en el grupo irradiado con UVA y carcinomas invasores en el grupo con UVA y TPA, mientras que en el grupo de TPA sólo observamos múltiples áreas de hiperplasia epitelial. Conclusiones: La exposición crónica a UVA asociada al promotor tumoral TPA ha desarrollado un modelo de fotocarcinogénesis cutánea en ratones Swiss.
Palabras clave: UVA, TPA, ratones Swiss, fotoenvejecimiento, fotocarcinogénesis.
SUMMARY
Introduction: Chronological ageing aside, skin may also experience photoageing as a result of exposure to ultraviolet radiation, considered to be the most potent environmental carcinogen. Materials and Methods: 32 Swiss mice (divided into 4 groups) were treated as follows: I (Control); II (TPA: 102 sessions); III (UVA: 102 sessions at 120 minutes/session); IV (TPA & UVA: 32 sessions at 120 minutes/session). Finally, necropsies were performed. The skin from the back and ears was included in paraffin via the usual method, sectioned at 5 µm and stained using H-E. Diverse dermal and epidermal histological criteria were evaluated (+, ++, +++), by two different observers. Results: A model for photoageing was established for both groups treated with UVA, which displayed moderate to severe dysplasia in the case of those treated with UVA alone and invasive carcinoma in the case of those treated with UVA and TPA, whilst only (multiple) areas of epithelial hyperplasia were observed in the group treated with TPA alone. Conclusions: Chronic exposure to UVA in conjunction with the tumour promoter TPA has provided a model for cutaneous photocarcinogenesis in Swiss mice.
Key words: UVA, TPA, Swiss mice, photoageing, photocarcinogenesis.
INTRODUCCIÓN
Durante las últimas décadas, la exposición solar ha sufrido un aumento considerable, sobre todo la intermitente o de tipo recreativo o social. La exposición crónica de la piel a las radiaciones ultravioleta provoca una inflamación crónica secundaria al paso de éstas a través de los tejidos, que a su vez origina estrés oxidativo (1-4). Este estrés genera una serie de cambios genéticos (dímeros de pirimidina, mutación de protooncogenes, etc.) que condicionan la degeneración de distintas estructuras cutáneas e inmunosupresión.
Las consecuencias de la exposición solar son complejas, destacando según Diffey (5) y Matsumura (6) tres tipos: agudas (eritema, quemaduras y pigmentación o bronceado), subagudas (hiperplasia epitelial) y crónicas (fotoenvejecimiento y fotocarcinogénesis) (7-12). La exposición crónica de la piel a las radiaciones ultravioleta produce según diversos estudios alteraciones en la estructura de la misma (13-18). Además, la radiación ultravioleta A (UVA) posee mayor poder de penetración en la piel que la UVB (13-17), pudiendo afectar a todas las capas de la piel hasta la dermis profunda (15). La radiación UVA induce alteraciones cutáneas, entre las que se incluyen el fotoenvejecimiento y el cáncer cutáneo (19). Por otra parte, las radiaciones ultravioleta provocan también alteraciones del sistema inmune, dando lugar a estados de inmunosupresión relativa, que dificultan el rechazo del tumor por parte del paciente e incluso colaboran activamente en su progresión (4,6,19-21). La radiación ultravioleta es la causante de la gran mayoría de los casos de cáncer cutáneo diagnosticado en humanos, sobre todo en individuos caucásicos. En concreto, es responsable de más de un millón de lesiones cutáneas malignas diagnosticadas cada año en los EEUU, lo que la convierte en el carcinógeno ambiental más importante (22).
Los modelos experimentales descritos utilizaron ratones Hairless para el estudio de los efectos de la irradiación crónica con radiación ultravioleta, con lesiones cutáneas similares a las humanas en el fotoenvejecimiento y la fotocarcinogénesis (14,17-18). En nuestro trabajo hemos utilizado ratones Swiss.
MATERIAL Y MÉTODOS
Animales
Hemos utilizado 32 ratones Swiss, hembras, con un peso medio de 33,83 g y una media de edad de 8-10 semanas del Servicio de Animales de Laboratorio (SACE- Universidad de Murcia, REGAES300305440012). Fueron mantenidos en cajas de 22 x 22 cm (484 cm2) en habitación con fotoperiodo luz-oscuridad 12-12 horas y comida y bebida «ad libitum».
Los animales fueron separados en 4 grupos de 8 ratones cada uno:
Grupo I: control.
Grupo II: aplicación tópica de TPA (12-O-tetradecanoylphorbol-13-acetato, Sigma Aldrich Co).
Grupo III: irradiados con radiación ultravioleta A (UVA).
Grupo IV: aplicación tópica de TPA más irradiación UVA.
Procedimiento experimental
Los animales fueron rasurados 48 horas antes de comenzar los experimentos y colocados en cajas de 22 x 22 cm, de modo que cada caja contenía un grupo experimental completo.
Para la irradiación con UVA, utilizamos el modelo de lámpara Original Home Solaria de Philips Typl HB 171/A, que consta de 4 tubos Philips Cleo 15 w con un espectro de emisión de 300-425 nm y un pico máximo de 354 nm. Las cajas con los animales de los grupos III y IV fueron colocadas una a una bajo los tubos de la lámpara a una distancia foco-piel de 20 cm. Las sesiones de UVA eran realizadas diariamente (4 días a la semana) con una duración de 120 minutos, durante las cuales se controlaba que la temperatura no fuera superior a 23º C. La energía absorbida en cada sesión fue de 8,74 J/cm2; la energía absorbida total en el grupo III fueron 892 J/cm2 y en el grupo IV 280 J/cm2. Con el fin de homogeneizar la exposición, las cajas eran rotadas semanalmente.
Los animales del grupo III recibieron 102 sesiones de radiación UVA, mientras que los del grupo IV recibieron 32.
En los grupos II y IV, el TPA, disuelto en acetona (2,5 µg/0,2 ml de acetona por dosis), fue aplicado tópicamente con micropipeta en la región dorsal y orejas de los animales una hora antes de la exposición a UVA dos veces a la semana.
Método anatomopatológico
Los animales fueron sacrificados al acabar los experimentos mediante dislocación cervical realizando la necropsia, extirpando la piel del lomo expuesta a las radiaciones y las orejas, así como los diferentes órganos. Todas las muestras fueron fijadas en formol neutro tamponado al 10% y posteriormente incluidas en parafina por el método habitual, seccionadas a 5 µm y teñidas con H.E.
Las secciones histológicas fueron estudiadas al microscopio óptico por dos observadores, valorando de una a tres cruces los siguientes parámetros: en la epidermis se valoró: hiperplasia, atrofia, hiperqueratosis, pérdida de polaridad y atipias celulares; en la dermis evaluamos la zona Grenz, fibras colágenas, elastosis y alteraciones de los vasos, glándulas sebáceas y glándulas sudoríparas, así como la presencia de linfocitos y macrófagos.
RESULTADOS
Los animales del grupo II, tratados con el promotor tumoral TPA mostraban características macro y microscópicas superponibles en general a las del grupo I (control) con la piel sonrosada y pelos blancos, excepto por múltiples zonas de engrosamiento cutáneo de aspecto granular, tanto en la piel del lomo como en la parte más expuesta de las orejas (porción superior), que microscópicamente correspondía a hiperplasia de los queratinocitos, que originaba acantosis con mayor o menos grado de papilomatosis en todos los animales de este grupo, aunque oscilaba de moderada (++) a intensa (+++) según las áreas (fig. 1). No observamos atipias citológicas.
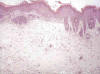
Fig. 1:
Piel del lomo con hiperplasia epidérmica intensa,
hiperqueratosis compacta y fibrosis dérmica (H.E., 125x).
Los animales del grupo III, tratados exclusivamente con radiación UVA presentaban eritema difuso en la piel del lomo y en la porción superior de las orejas, que era de carácter pasajero durante las primeras tres o cuatro semanas, haciéndose permanente a partir de ese período y que se caracterizaban por mostrar un aspecto reticular (fig. 2). A partir de cuatro a seis semanas de exposición, en esas zonas destacaba el engrosamiento irregular, granular y difuso de la piel, que se acompañaba generalmente de superficie escamosa. Estas zonas alternaban con otras de aspecto predominantemente telangiectásico y con las de alopecia irregular. Pasadas 60-65 sesiones las áreas de engrosamiento cutáneo eran más extensas e irregulares, y estaban normalmente infiltradas, mostrando superficies escamosas de coloración roja o amarillenta. Sin embargo, no observamos lesiones de aspecto claramente neoplásico.

Fig. 2:
Eritema difuso en la piel del lomo.
Microscópicamente, tanto en la piel como en las orejas se observaban numerosas áreas irregulares de acantosis de aspecto compacto, que alternaban con fenómenos de alargamiento irregular de las crestas epidérmicas y papilomatosis. Estas áreas solían acompañarse de hiperqueratosis y, en ocasiones, paraqueratosis. También eran frecuentes las áreas de displasia leve (+) o moderada (++) y esporádicamente severa (+++) (fig. 3). Estas zonas mostraban pérdida de la polaridad celular y atipias que se caracterizaban por marcado pleomorfismo celular y nuclear, alteración de la relación núcleo-citoplasma a favor del núcleo, hipercromatismo nuclear con frecuente aspecto vesiculoso del núcleo y uno o varios nucléolos voluminosos e irregulares, así como frecuentes figuras de mitosis. No observamos carcinomas en ningún animal de este grupo.
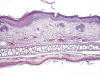
Fig. 3:
Hiperplasia epidérmica en la oreja, con áreas de
displasia leve-moderada en la piel de la porción superior (H.E., 125x).
Asimismo era constante la expansión de la dermis papilar por aumento de los capilares sanguíneos y por acúmulos de sustancia intercelular. En la dermis reticular destacaba la desorganización estructural por fragmentación y degeneración de las fibras elásticas con depósitos irregulares de material elastótico. En las zonas subyacentes a las áreas de displasia epitelial, se observaban además infiltrados irregulares de linfocitos y células plasmáticas.
Todos los animales del grupo IV, tratados con TPA y UVA presentaban alteraciones macroscópicas, fundamentalmente en la piel del lomo y en la parte superior de ambas orejas, que empezaban tras las primeras aplicaciones, y se caracterizaban por eritema generalizado y pasajero. A partir de cuatro a seis semanas aparecían áreas de engrosamiento granular e irregular alternando con otras rojizas de aspecto telangiectásico. Tras 10-12 sesiones destacaban los fenómenos de alopecia así como las arrugas cutáneas (fig. 4). Dichas arrugas eran al principio pequeñas e irregulares, con fenómenos de laxitud y pérdida de elasticidad de la piel, y aumentaban progresivamente de longitud y grosor, de modo que pasadas dos o tres semanas eran largas, dispuestas en sentido longitudinal a lo largo de todo el lomo, que se acompañaban de marcada flaccidez. Posteriormente destacaban las áreas de engrosamiento cutáneo, nodulares e irregulares y fijadas profundamente; algunas mostraban superficies escamosas o costrosas de color rojo amarillento y en ocasiones estaban erosionadas o incluso eran sangrantes con aspecto ulcerado (fig. 5). Tras 20-25 sesiones, en el 30% de los animales del grupo IV aparecían varias lesiones nodulares fijadas a planos profundos. Algunas de ellas tenían límites irregulares, eran sobreelevadas, con bordes congestivos y aspecto verrucoso, mientras que otras mostraban el centro deprimido con aspecto escamoso e incluso algunas estaban centralmente ulceradas. En la piel de las orejas se observaban lesiones similares a las descritas en la piel del lomo en cualquiera de los estadios antes citados, excepto las lesiones nodulares o verrucosas que no se presentaron en ningún animal.
Fig. 4:
Extensas arrugas cutáneas que alternan con áreas
de engrosamiento irregular y alopecia.

Fig. 5:
Queratosis y lesiones nodulares verrucosas en la
piel del lomo.
Microscópicamente se observaban en todos los animales numerosas áreas (en el lomo y la porción superior de las orejas) con hiperplasia de la epidermis de grado variable, predominantemente de grado moderado (++) o severo (+++), acompañadas frecuentemente de papilomatosis, y de hiperqueratosis compacta y a veces paraqueratosis (fig. 7). También eran frecuentes las áreas de displasia epitelial, sobre todo de grado I y II, caracterizadas por proliferación celular con pérdida de la polaridad, pleomorfismo celular y nuclear con núcleos pleomórficos, así como alteración de la relación núcleo-citoplásmica y frecuentes figuras de mitosis, que no sobrepasaban la mitad inferior de la epidermis. En ocasiones, dichos fenómenos afectaban a la mayor parte del espesor epitelial (displasia grado III o severa) e incluso a toda la epidermis, bajo la forma de carcinoma «in situ» (fig. 7). En cuatro animales se presentaron carcinomas escamosos de aspecto verrucoso o ulcerado. Estaban formados por lóbulos o nidos irregulares de queratinocitos poligonales o globulosos con pleomorfismo moderado, siendo frecuentes los fenómenos de disqueratosis y la presencia de globos córneos (fig. 8). Dichos lóbulos celulares invadían la dermis, donde formaban columnas o regueros de células epiteliales, rodeados por estroma fibroso, con densos infiltrados de linfocitos y células plasmáticas. En ningún caso se encontraron metástasis ganglionares o hematógenas.
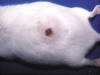
Fig. 6:
Lesión verrucosa parcialmente ulcerada.
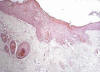
Fig. 7:
Piel del lomo con áreas de displasia
severa-carcinoma in situ. Reacción mesenquimal dérmica (H.E ., 312.5x).
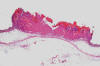
Fig. 8:
Carcinoma espinocelular vegetante y escamoso que
infiltra la dermis hasta el nivel muscular (H.E., 31.25x).
También se observaban fenómenos de ensanchamiento de la dermis papilar, por la presencia de numerosos vasos capilares sanguíneos y de acúmulos irregulares de sustancia intercelular. En algunas zonas existía hiperplasia de glándulas sebáceas. En la dermis reticular era también frecuente la existencia de áreas con desorganización del patrón fibrilar, caracterizado por fragmentación de las fibras elásticas, con depósitos irregulares de material elastótico en grumos gruesos o grandes placas, según las zonas.
DISCUSIÓN
Existen numerosas evidencias epidemiológicas y clínicas que relacionan las radiaciones ultravioleta solares con el fotoenvejecimiento cutáneo o dermatoheliosis como ha sido denominado también recientemente por Oppel (24). A su paso a través de los tejidos, estas radiaciones pueden originar estrés oxidativo, que sería el responsable de las alteraciones tisulares que tendrán lugar tanto en la epidermis como en la dermis, así como de la inmunosupresión (1-3), pues van a afectar a las membranas celulares y de los orgánulos y a la síntesis de aminoácidos (25). Asimismo, pueden provocar la dimerización de las bases pirimidínicas del ADN (26) generando mutaciones. Estas alteraciones constituyen la base patogénica del espectro de las lesiones que caracterizan al denominado fotoenvejecimiento y a la fotocarcinogénesis cutáneos (6).
El cáncer cutáneo es el más frecuente en la raza blanca y ha sufrido un dramático incremento durante los últimos 40 años, debido fundamentalmente al cambio social experimentado respecto a la exposición al sol y radiaciones ultravioleta. Esto ha determinado que se considere a las radiaciones ultravioleta como el carcinógeno ambiental más importante en la actualidad (22), y explica el enorme interés sanitario por el conocimiento y control de los efectos de estas radiaciones.
Además, las radiaciones ultravioleta A pueden originar diversas neoplasias, siendo los tipos tumorales más frecuentes los carcinomas escamosos (baso y espinocelulares) y con mucha menos frecuencia el melanoma o los linfomas no Hodgkin, que suelen ser excepcionales.
En la bibliografía no hemos encontrado descritos modelos experimentales de fotoenvejecimiento cutáneo en ratones Swiss mediante la exposición crónica a radiaciones ultravioleta A (UVA).
Para nuestro experimento nos planteamos un periodo de exposición de seis meses (4 sesiones semanales de 120 minutos cada una, con un total de 102 sesiones) para los grupos II (aplicación de TPA) y III (radiación UVA). El tratamiento del grupo IV (TPA y radiación UVA) se suspendió tras tres meses (3 sesiones semanales de 120 minutos cada una, con un total de 36 sesiones) por la aparición de tumores cutáneos en la mitad de los animales y la muerte de uno de ellos, a fin de poder realizar el estudio anatomopatológico de todos los animales. Consideramos que los periodos de exposición son suficientemente prolongados respecto a la supervivencia media de los animales (2-3 años), equivaliendo a 12-15 años humanos de exposición para los grupos de tratamiento individual (II y III) y de 6-7 para el grupo de tratamiento combinado (IV).
En nuestro trabajo hemos establecido un modelo experimental de fotoenvejecimiento cutáneo en los animales de los grupos expuestos a radiación UVA. En ambos grupos aparecieron áreas de displasia epitelial de alto grado en todos los animales y, además, en el grupo irradiado y tratado con el promotor tumoral se desarrollaron varios carcinomas en la mitad de los animales (fotocarcinogénesis) a pesar de la menor duración del tratamiento.
Consideramos que estos hechos confirman la importancia de la exposición crónica a las radiaciones UVA en el origen del fotoenvejecimiento cutáneo, puesto que han originado todo el espectro de signos clínicos e histopatológicos descritos previamente por diversos autores (13-18), consistente en: eritema y telangiectasias superponibles a las lesiones agudas observadas en humanos tras la exposición prolongada al sol (5); presentación de múltiples áreas de engrosamiento cutáneo, que corresponderían a las lesiones de presentación subaguda en humanos; y presentación progresiva de arrugas profundas y de lesiones similares a las queratosis actínicas, que semejarían a las lesiones por exposición crónica en humanos (26).
Microscópicamente, observamos también todo el espectro de lesiones, desde la hiperplasia hasta la displasia moderada-severa, cuando exponíamos los animales exclusivamente a las radiaciones UVA. Cuando se combinaban radiaciones con el promotor tumoral estas lesiones se presentaban con mayor frecuencia y mayor extensión y aparecían neoplasias escamosas invasivas, superponibles a los carcinomas espinocelulares bien diferenciados de los humanos similares a los descritos por Benedetto (8). Dichos tumores invadían la dermis papilar y reticular alcanzando al tejido celular subcutáneo.
Asimismo, nuestro estudio confirma el doble mecanismo implicado en el desarrollo de la carcinogénesis cutánea: la inducción tumoral causa alteraciones irreversibles del material genético, y, a través de la acción del promotor tumoral TPA, se favorece la proliferación de las células mutadas con formación de neoplasias «in situ» e incluso invasivas. En contraste, los animales a los que aplicamos exclusivamente el promotor tumoral, solo desarrollaron áreas de engrosamiento cutáneo por hiperplasia de los queratinocitos.
AGRADECIMIENTOS
Agradecemos a Víctor Bolarín Lucas, técnico en Anatomía Patológica por su asistencia técnica y a Enrique Rubio y Francisco Zapata del Servicio de Animales de Laboratorio (SACE) de la Universidad de Murcia. Este trabajo ha sido parcialmente financiado con una ayuda del Proyecto de Estímulo a la Transferencia de Resultados de Investigación (Ref. PTR1995-0582-OP).
BIBLIOGRAFÍA
Wlaschek M, Tantcheva-Poor I, Naderi L, Ma W, Schneider LA, Razi-Wolf Z, Schuller J, Scharffetter-Kochanek K. Solar UV irradiation and dermal photoaging. J Photochem Photobiol B 2001; 63: 41-51.
Ichihashi M, Ueda M, Budivanto A, Bito T, Oka M, Funkunaga M, Tsuru K, Horikawa T. UV-induced skin damage. Toxicology 2003; 189: 21-39.
Nishigori C, Hattori Y, Toyokuni S. Role of reactive oxygen species in skin carcinogenesis. Antioxid Redox Signal 2004; 6: 561-70.
Halliday GM. Inflammation, gene mutation and photoimmunosuppression in response to UVR-induced oxidative damage contributes to photocarcinogenesis. Mutation Res 2005; 571: 107-20.
Diffey BL, Gies HP. The confounding influence of sun exposure in melanoma. Lancet.1998; 351: 1101-2.
Matsumura Y, Ananthaswamy HN. Short-term and long-term cellular and molecular events following UV irradiation of skin: implications for molecular medicine. Expert Rev Mol Med 2002; 2002: 1-22.
Gilchrest BA, Bohr VA. Aging processes, DNA damage, and repair. FASEB J 1997; 11: 322-30.
Benedetto AV. The environment and skin aging. Clin Dermatol 1998; 16: 129-39.
Toyoda M, Morohashi M. Morphological alterations of epidermal melanocytes in photoageing: an ultraestructural and cytomorphometric study. Br J Dermatol 1998; 139: 444-52.
Chung KY, Chang NS, Park YK, Lee KH. Effect of ultraviolet light on the expression of adhesion molecules and T lymphocyte adhesion to human dermal microvascular endothelial. Yonsei Med J 2002; 43: 165-74.
El-Domyati M, Attia S, Saleh F, Brown D, Birk DE, Gasparro F, Ahmad H, Uitto J. Intrinsic aging vs. photoaging: a comparative histopathological, immunohistochemical, and ultraestructural study of skin. Exp Dermatol 2002; 11: 398-405.
Petit L, Pierard GE. Analytic quantification of solar lentigines lightening by a 2% hydroquinone-cyclodextrin formulation. J Eur Acad Dermatol Venereol 2003; 17: 546-9.
Bernstein, Underhill CB, Hahn PJ, Brown DB, Uitto J. Chronic sun exposure alters both the content and distribution of dermal glycosaminoglycans. Br J Dermatol 1996; 135: 255-62.
Kambayashi H, Yamashita M, Odake Y, Takada K, Funasaka Y, Ichihashi M. Epidermal changes caused by chronic low-dose UV irradiation induce wrinkle formation in hairless mouse. J Dermatol Sci 27 2001 (suppl 1); S19-S25.
Wang C, Yao R, Liu Z, Zhong W, Liu X, Wang Y. Protective effect of polypeptide from Chlamys farreri on hairless mice damaged by ultraviolet A. Acta Pharmacol Sin 2002; 23: 813-8.
Matsumura Y, Ananthaswamy HN. Toxic effects of ultraviolet radiation on the skin. Toxicol Appl Pharmacol. 2004; 195: 298-308.
Mitani H, Naru E, Yamashita M, Arakane K, Suzuki T, Imanari T. Ergocalciferol promotes in vivo differenciation of keratinocytes and reduces photodamage caused by ultraviolet irradiation in hairless mice. Photodermatol Photoinmunol Photomed 2004; 20: 215-23.
Reeve VE, Widyarini S, Domanski D, Chew E, Barnes K. Protection against photoaging in the hairless mouse by the isoflavone equol. Photochem Photobiol 2005; 81: 1548-53.
De Laat A, van der Leun JC, de Gruijl FR. Carcinogenesis induced by UVA (365 nm) radiation: the dose-time dependence of tumor formation in hairless mice. Carcinogenesis 1997; 18: 1013-20.
Steerenberg PA, Garssen J, Dortant P, Hollman PC, Alink GM, Dekker M, Bueno-de-Mesquita HB, van Loveren H. Protection of UV-induced suppression of skin contact hypersensitivity: a common feature of flavonoids after oral administration?. Photochem Photobiol 1998; 67: 456-61.
Yuen KS, Nearn MR, Halliday GM. Nitric oxide-mediated depletion of Langerhans cells from the epidermis may be involved in UVA radiation-induced inmunosuppression. Nitric Oxide 2002; 6: 313-8.
Matsumura Y, Ananthaswamy HN. Short-term and long-term cellular and molecular events following UV irradiation of skin: implications for molecular medicine. Expert Rev Mol Med 2002; 2002: 1-22.
Afaq F, Adhami VM, Ahmad N. Prevention of short-term ultraviolet B radiation-mediated damages by resveratrol. Toxicol Appl Pharmacol 2003; 186: 28-37.
Oppel T, Korting HC. Actinic keratosis: the key event in the evolution from photoaged skin to squamous cell carcinoma. Therapy based on pathogenetic and clinical aspects. Skin Pharmacol Physiol 2004; 17: 67-76.
Lavker RM, Veres DA, Irwin CJ, Kaidbey KH. Quantitative assessment of cumulative damage from repetitive exposures to suberythemogenic doses of UVA in human skin. Photochem Photobiol 1995; 62: 348-52.
Ananthaswamy HN, Fourtanier A, Evans RL, Tison S, Medaisko C, Ullrich SE, Kripke ML. p53 mutations in hairless SKH-hr1 mouse skin tumors induced by a solar simulator. Photochem Photobiol 1998; 67: 227-32.