
Vol. 40, n.º 2, 2007
REVISTA
ESPAÑOLA DE
Vol. 40, n.º 2, 2007 |
CASUÍSTICA
María Planelles Asensio, F. Ignacio Aranda López, Concepción Córdoba Polo, Adel Abuomar, Artemio Payá Romá
Servicio de Patología. Hospital General
Universitario de Alicante. c/ Pintor Baeza s/n. 03010. Alicante. España.
Teléfono: 965938184. Fax: 965938181.
planelles_marase@gva.es
RESUMEN
Introducción: El timoma micronodular con hiperplasia linfoide de células B es una variedad de neoplasia epitelial tímica incluida recientemente en la clasificación de la OMS. Caso clínico: El presente caso corresponde a una mujer de 67 años con un gran quiste en la cavidad torácica izquierda, identificado en una radiografía de tórax, siendo el resto de la exploración física normal. Resultados: El estudio anatomopatológico mostró nódulos epiteliales múltiples separados por un estroma rico en linfocitos B con centros germinales.
Palabras clave: Timoma micronodular, hiperplasia linfoide células B.
Micronodular thymoma with lymphoid B-cell hyperplasia. Report of a case
SUMMARY
Introduction: Micronodular thymoma with lymphoid B-cell hyperplasia is a new type of epithelial thymic neoplasms, included in the last WHO classification. Clinical findings: The case we explain below is about a 67 years old woman presenting with a big and asynthomatic cyst in the left intrathoracic cavity, which was diagnosed by an x-ray exploration. The physical examination was absolutely normal. Results: Microscopically, we observed multiples epithelial nodules separated by an abundant lymphocytic stroma with follicular germinal centres.
Key words: Micronodular thymoma, lymphoid B-cell hyperplasia.
INTRODUCCIÓN
Las neoplasias epiteliales tímicas son tumores relativamente raros, que pueden presentar un amplio espectro morfológico. Generalmente están constituidos por lóbulos de células epiteliales neoplásicas tímicas delimitados por septos fibrosos, y asociados a una población variable de linfocitos T inmaduros (1,2). En 1999, la OMS, desarrolló una nueva clasificación recientemente revisada, que utiliza letras y números para designar los diferentes subtipos de timoma, con significado pronóstico y un aceptable nivel de reproducibilidad (3), que ha sido recientemente revisada (3,4). La presencia de linfocitos B con formación de folículos formando parte del estroma es un hallazgo infrecuente en el timoma y ha sido documentada en el tejido tímico de pacientes con miastenia gravis y enfermedades autoinmunes (1,2). Una variante inhabitual de timoma lo constituye el denominado «timoma micronodular con hiperplasia linfoide de células B» (TMNHLB), cuya presentación radiológica suele simular un quiste mediastínico, y que presenta una morfología peculiar que puede originar problemas de diagnóstico diferencial anatomopatológico (5,6). En el presente trabajo, se describen las características clinicopatológicas de un caso de TMNHLB con presentación radiológica en forma de gran quiste intratorácico asintomático.
CASO CLÍNICO
Mujer de 67 años remitida al Hospital General Universitario de Alicante para valoración de una lesión de aspecto quístico de gran tamaño en hemitórax izquierdo identificada en una radiografía de tórax (fig. 1). La paciente se encontraba asintomática, aunque refería una historia de 4 ó 5 meses de evolución de calambres generalizados, motivo por el que acudió a su hospital de referencia, donde se le practicó el examen radiológico. Como antecedentes personales destacaba la presencia de hipertensión arterial, en tratamiento con amlodipino (Astudal®) y que había sido fumadora hasta hace 9 meses de 50 paquetes/año. No presentaba intervenciones quirúrgicas previas ni otros antecedentes médicos de interés. Nunca antes se le había realizado una radiografía de tórax.
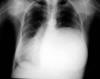
Fig. 1:
Radiografía postero-anterior de tórax. Masa bien
delimitada de densidad homogénea que ocupa los 2/3 inferiores de hemitórax
izquierdo con desplazamiento mediastínico contralateral.
En la exploración física, sólo se describe una disminución del murmullo vesicular en los dos tercios inferiores del hemitórax izquierdo, con desplazamiento del latido cardíaco a hemitórax derecho, y lesiones por rascado en región pretibial de ambos miembros inferiores. El hemograma, la bioquímica y la coagulación, así como el electrocardiograma, estaban dentro de la normalidad. La radiografía de tórax, mostraba un tumor quístico de bordes bien definidos y densidad homogénea que ocupaba los dos tercios inferiores de hemitórax izquierdo con desplazamiento mediastínico contralateral (fig. 1). En la TAC de tórax, se observó una gran masa de 16 x 14 cm, lisa y bien definida, con bordes parcialmente calcificados, hipodensa y de contenido homogéneo. En su porción más craneal y en localización prevascular, tenía un componente más sólido (fig. 2). En la RMN de tórax, la imagen sugirió alto contenido proteico con cierto grado de sangrado intraquístico (fig. 3). En la espirometría se objetivó una disfunción ventilatoria restrictiva leve. Posteriormente, se realizó una PAAF transtorácica de la que se obtuvo sangre hemolizada y material necrótico-hemorrágico con células inflamatorias e histiocitos.
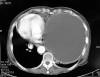
Fig. 2:
TAC torácico. Masa 16 x 14 cm, bien delimitada,
hipodensa con contenido homogéneo.
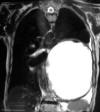
Fig. 3:
RMN tórax. Masa de probable contenido proteico
con sangrado intraquístico.
Ante estos hallazgos, se decidió realizar la resección de la tumoración quística mediante toracotomía posterolateral izquierda. Debido a la imposibilidad de extirpación, por el tamaño de la lesión, se realizó punción y aspiración del contenido quístico durante la intervención, seguida de la exéresis, liberando la lesión del mediastino, del diafragma y del pulmón izquierdo. Se consideró la cirugía incompleta, dado que una zona marginal de la cápsula de la lesión, de unos 10 cm, permanecía adherida a la língula y hubiera requerido una resección pulmonar mucho más amplia, para su exéresis completa, lo que no se llegó a realizar porque las características macroscópicas de la lesión no sugerían malignidad. La evolución de la paciente fue buena y el postoperatorio satisfactorio y sin complicaciones.
En el estudio anatomopatológico macroscópico se observó la pared de una cavidad quística fragmentada, con diámetro aproximado corregido de 16 cm, de superficie externa lisa y superficie interna rugosa con algunos depósitos de fibrina. A la sección, la pared alcanzaba un espesor medio de 0,2 cm con áreas de consistencia calcárea. Además, se apreciaba en la superficie externa, un área excrecente, lobulada, de 5 x 4 x 2 cm, formada por tejido rosáceo carnoso. El estudio microscópico correspondía a un crecimiento multinodular de células epiteliales fusiformes, acompañado de tejido linfoide con folículos hiperplásicos (figs. 4 y 5). Además, presentaba un gran componente quístico revestido por epitelio aplanado (fig. 6). El estudio inmunohistoquímico, confirmó la naturaleza epitelial de los nidos celulares con positividad para citoqueratina AE1:AE3 (fig. 7) y negativos para CD20. El componente linfoide, constituido por linfocitos positivos para CD20 y CD79a, con folículos hiperplásicos, presentaba centros germinales bcl-2 negativos. La tinción para cadenas ligeras kappa y lambda demostró un patrón policlonal. De manera dispersa, se identificaron algunos linfocitos T, positivos para CD3 y CD1a.
Fig. 4:
Crecimiento multinodular de células epiteliales
rodeadas de folículos linfoides (HEx10).
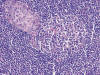
Fig. 5:
Centro germinal de folículo linfoide y células
epiteliales (HEx20).
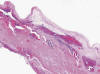
Fig. 6:
Pared quística revestida por epitelio aplanado
(HEx20).
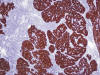
Fig. 7:
Positividad del componente epitelial para
citoqueratinas (AE1:AE3x100).
La paciente fue sometida a tratamiento adyuvante con radioterapia, no existiendo hasta la fecha, evidencia de enfermedad residual.
DISCUSIÓN
El TMNHLB es una entidad rara, y constituye el 3% de todos los timomas (5). La edad de diagnóstico varía entre 45-95 años sin que tenga predilección por ningún sexo. Hasta la fecha se han publicado 50 casos, localizados en su mayoría en el mediastino anterior (6-8) y solo uno en localización ectópica (9). Desde el punto de vista microscópico está constituido por nódulos epiteliales múltiples separados por un estroma linfocítico abundante que contiene centros germinales (5,6). El componente epitelial está compuesto de células ovaladas y fusiformes con algunos linfocitos intraepiteliales, similar al componente epitelial de los timomas de tipo A (6). Pueden verse formaciones rosetoides compuestas por células epiteliales y no se observan corpúsculos de Hassall o espacios perivasculares. Las células plasmáticas pueden ser prominentes, sin que presenten restricción de cadenas ligeras (6). Son muy características las áreas micro y macroquísticas particularmente de localización subcapsular. Inmunohistoquímicamente, el componente epitelial del TMNHLB es positivo para citoqueratinas 5/6 y 19. La mayoría de los linfocitos son positivos para CD20, pero puede acompañarse de una población positiva para CD3. Las características clínicas de este tumor están relacionadas con el tamaño y la extensión local del mismo. A pesar del componente linfoide B hiperplásico, su asociación con miastenia gravis es controvertida, oscilando entre el 0 y el 40%, ya que en las series de casos descritos no existe concordancia (1,6). El tamaño tumoral oscila entre 3 y 15 cm, siendo el presente caso el mayor descrito hasta la fecha. Está encapsulado en el 90 % de los casos y la resección suele ser curativa. Esta forma de presentación hace que el principal diagnóstico diferencial radiológico se plantee con lesiones quísticas mediastínicas como el quiste tímico congénito originado en restos del sistema ductal timofaríngeo, que con frecuencia incluyen restos paratiroideos (7). Por otra parte, los timomas convencionales también pueden presentar cambio quístico (4).
La patogenia de la hiperplasia linfoide B en esta variante de timoma no está definida. La hiperplasia linfoide en tejido tímico puede observarse en pacientes con miastenia gravis, y otras enfermedades autoinmunes como lupus eritematoso sistémico y anemia hemolítica autoinmune. Al ser excepcional la asociación de TMNHLB y enfermedad autoinmune se ha sugerido una reacción del huésped frente a la proliferación epitelial tímica, similar a la observada en casos de seminoma y de carcinoma linfoepitelial (6). La hiperplasia linfoide también podría ser explicada por una peculiar reacción del compartimento de células B del timo frente a determinados antígenos de las células epiteliales neoplásicas (6).
La morfología inhabitual de la proliferación micronodular de células epiteliales en el seno de una proliferación de células de B puede ser origen de problemas de diagnóstico diferencial, especialmente en pequeñas biopsias mediastínicas obtenidas con aguja o mediante biopsia quirúrgica. La presencia de nidos epiteliales asociados a linfocitos B podría plantear diagnóstico diferencial con metástasis de carcinoma en ganglios linfáticos mediastínicos. La ausencia de atipia celular y de actividad mitótica unido a la presentación radiológica en forma de quiste debe hacer plantear la posibilidad de esta variedad de timoma.
En resumen, el presente caso constituye un ejemplo de presentación de TMNHLB en forma de gran quiste intratorácico. La morfología característica con la hiperplasia linfoide B, corroborada con la inmunohistoquímica permiten el correcto diagnóstico. Su peculiar morfología ha determinado que la nueva clasificación de la OMS haya optado por incluirlo como un tipo especial dentro de las neoplasias epiteliales tímicas (4).
BIBLIOGRAFÍA
Pan CC, Chen WY, Chiang H. Spindle cell and mixed spindle/lymphocytic thymomas: an integrated clinicopathologic and immunohistochemical study of 81 cases. Am J Surg Pathol 2001; 25: 111-20.
Kim DJ, Yang WI, Choi SS, Kim KD, Chung KY. Prognosis and clinical relevance of the World Health Organization schema for the classification of thymic epithelial tumors. Chest 2005; 127: 755-6.
Rieker RJ, Hoegel J, Morresi-Hauf A, Hofman WJ, Blaeker H, Penzel R et al. Histologic classification of thymic epithelial tumors: comparison of established classification schemes. Int J Cancer 2002; 98: 900-6.
Travis WD, Brambilla E, Muller-Hermelink HK, Harris CCE, editores. World Health Organization Classification of Tumours. Pathology and Genetics of Tumours of the Lung, Pleura, Thymus and Hearth. Lyon: IARCPress. 2004.
Strobel P, Marino M, Feuchtenberger M, Rouziere AS, Tony HP, Wulbrand U, et al. Micronodular thymoma: an epithelial tumour with abnormal chemokine expression setting the stage for lymphoma development. J Pathol 2005; 207: 72-82.
Suster S, Moran CA. Micronodular thymoma with lymphoid B-cell hyperplasia: clinicopathologic and immunohistochemical study of eighteen cases of a distinctive morphologic variant of thymic epithelial neoplasm. Am J Surg Pathol 1999; 23: 955-62.
Rieker RJ, Aulmann S, Schnabel PA, Sack FU, Otto HF, Mechtersheimer G, et al. Cystic thymoma. Pathol Oncol Res 2005; 11: 57-60.
Thomas De Montpreville V, Zemoura L, Dulmet E. Thymoma with epithelial micronodules and lymphoid hyperplasia: six cases of a rare and equivocal subtype. Ann Pathol 2002; 22: 177-82.
Mende S, Moschopulos M, Marx A, Laeng RH. Ectopic micronodular thymoma with lymphoid stroma. Virchows Arch 2004; 444: 397-9.