
Vol. 40, n.º 4, 2007
REVISTA
ESPAÑOLA DE
Vol. 40, n.º 4, 2007 |
ORIGINALES
Francisco Javier Torres Gómez1, Francisco Javier Torres Olivera2
1 Unidad de Anatomía Patológica. Hospital de Alta
Resolución de Utrera. Avda. Brigadas Internacionales, s/n. 41710 Utrera
(Sevilla).
2 Departamento de Anatomía Patológica. Hospital
Universitario Virgen Macarena. Sevilla.
javiertorresgomez@yahoo.es
RESUMEN
Introducción: El carcinoma ductal infiltrante representa el tipo histológico más frecuente de los tumores malignos mamarios y muestra un comportamiento biológico bastante heterogéneo. La variable evolución de la enfermedad ha estimulado a los investigadores a definir los parámetros que permitan delimitar subgrupos de pacientes con el objetivo de optimizar la terapéutica. Los parámetros morfológicos han logrado este objetivo con resultados más o menos satisfactorios. Las técnicas inmunohistoquímicas han permitido señalizar nuevas rutas terapéuticas con resultados poco contrastados. La valoración comparativa de ambos parámetros está escasamente reflejada en la literatura. Material y métodos: Se han determinado en 165 pacientes con carcinoma ductal infiltrante (NOS) el tamaño tumoral, grado histológico combinado, estatus ganglionar axilar y la expresión de receptores estrogénicos, p53 y c-erbB2, correlacionándose entre sí los parámetros morfológicos e inmunohistoquímicos. Resultados: Hemos obtenido correlación estadísticamente significativa entre la expresión positiva de receptores estrogénicos con el grado nuclear, índice mitósico, grado histológico, estatus ganglionar axilar y número de ganglios afectados cuando es superior a 4, pero no con la formación tubular ni con el tamaño tumoral. La diferente expresión de p53 no muestra variaciones significativas cuando se relaciona con los diferentes parámetros morfológicos. La expresión de c-erbB2 se correlaciona con la formación tubular y el grado histológico pero no con el resto de los parámetros referidos.
Palabras clave: Carcinoma ductal infiltrante, receptores estrogénicos, p53, c-erbB2, grado histológico, tamaño tumoral, estatus ganglionar.
SUMMARY
Introduction: Invasive ductal carcinoma is the commonest malignant tumour of the breast and its behaviour is heterogeneous. Different therapeutic groups have been established depending on the morphologic features. Immunohistochemistry has opened new therapeutic options but the results are not contrasted enough. Material and methods: We have correlated tumoral size, combined histologic grade, axilar ganglionar status and p53, c-erbB2 and expression of estrogens receptors in 165 patients with invasive ductal carcinoma of the breast. Results: There is statistic correlation between expression of estrogens receptors and nuclear grade, mitotic index, histologic grade, axilar ganglionar status and number of positive nodes. There is not correlation with the tumoral size and tubular differentiation. There are not significant alterations in p53 expression when it is correlated with the different morphologic parameters. C-erbB2 expression correlates only with tubular differentiation and histologic grade.
Keywords: invasive ductal carcinoma, oestrogen receptors, p53, c-erbB2, histologic grade, tumoral size, gangionar status.
INTRODUCCIÓN
El cáncer de mama femenino es un problema de salud pública de primer orden a nivel mundial, especialmente en los países de nivel económico-social alto-medio, debido a su frecuencia (20-25% de todos los cánceres femeninos), alta predisposición a padecerlo (5-10% con una expectativa de vida de 74 años ) y a su alta mortalidad (10%) entre los 35 y 55 años, prácticamente estable a pesar del refinamiento de las técnicas de diagnóstico precoz y a la investigación terapéutica (1). El 95% de las mujeres tiene al menos un factor de riesgo. Estas premisas fundamentan el interés en delimitar los parámetros de la enfermedad con valor pronóstico fiable, con el fin de optimizar la terapéutica.
El estudio anatomopatológico del cáncer mamario ha sido de gran utilidad en el reconocimiento de características morfológicas que han permitido evaluar su comportamiento biológico. Entre el 25 y el 30% de los carcinomas mamarios muestran características histológicas que permiten subclasificarlos como lesiones de buen pronóstico (2), siempre que dichas características están presentes al menos en el 75% del mismo, es decir, en aquellas ocasiones en las que las mismas constituyen la característica predominante del tumor (3). El carcinoma ductal infiltrante es el tipo histológico más frecuente de las neoplasias mamarias (3,4) y su comportamiento biológico es bastante heterogéneo. Esta heterogeneidad ha impulsado la búsqueda de parámetros con valor pronóstico, al principio morfológicos y posteriormente inmunohistoquímicos y biomoleculares que permitieran definir su evolución.
El grado histológico combinado es el resultado final de los intentos de mejorar durante varias décadas la clasificación pronóstica de los carcinomas mamarios iniciada por Greenouch en 1925 (5-11). En 1973 en el Nottingham/Tenovus Primary Breast Cancer Study se establece, de manera estandarizada, el potencial pronóstico de una serie de características morfológicas en el cáncer mamario mediante la valoración semicuantitativa en cortes histológicos, de la diferenciación tubular, atipia nuclear y número de mitosis (8). El análisis individualizado de cada uno de estos parámetros obtiene un valor predictivo diferente, siendo la formación tubular el mejor indicador de buen pronóstico, mientras que un índice mitósico alto es el mejor indicador de una mala evolución (12). El índice mitósico (número de mitosis contadas en 10 campos microscópicos de gran aumento) es el mejor predictor de supervivencia en pacientes con cáncer de mama independientemente del estatus ganglionar axilar (13-16). Su alta reproducibilidad está fundamentada en estrictos criterios para reconocer las mitosis y las áreas en las que deben ser buscadas (8). El recuento de mitosis relacionado con un porcentaje establecido de células tumorales se correlaciona estrechamente con la proliferación celular (17,18). El grado histológico combinado, adecuadamente protocolizado, refuerza el consenso inter e intraobservadores y minimiza la discrepancia en parámetros aislados sin alterar el grado histológico final, lo que incrementa su utilidad clínica (19). A diferencia de otros sistemas de categorización, que incluyen casi 2/3 de los casos como carcinomas escasamente diferenciados, este sistema discrimina los casos en grupos más homogéneos (20). Los carcinomas mamarios poco diferenciados presentan altas tasas de metástasis axilares y baja supervivencia, independientemente del tamaño tumoral (21,22).
El tamaño tumoral (TT) y el estatus ganglionar axilar (EG) son factores pronósticos estrechamente correlacionados e independientes (13,23,24). La medición microscópica del TT tiene mayor fiabilidad pronóstica (21,25), pero no siempre es posible en tumores de cierto tamaño. El aumento del TT se relaciona directamente con peor supervivencia, independientemente del EG (1). Un TT hasta 1 cm supone una tasa de supervivencia e intervalo libre de enfermedad semejantes a las de los tipos histológicos especiales de buen pronóstico (24,26). La supervivencia a los 5 años declina progresivamente con el aumento del número de ganglios afectados (21,27). Entre el 25 y el 30% de las pacientes con carcinoma limitado a la mama, fallecen por la enfermedad frente al 50-75% de las que tienen ganglios axilares metastásicos (28). Las micrometástasis (focos tumorales <2 mm) están presentes entre el 9 y el 13% de los ganglios axilares inicialmente considerados como negativos (21) y los falsos negativos aumentan hasta un 20 % cuando se utiliza inmunohistoquímica (29). Sin embargo no hay consenso sobre la influencia de las micrometástasis sobre el pronóstico (30-32).
El desarrollo de las técnicas inmunohistoquímicas ha permitido cuantificar determinados factores por métodos morfológicos, conservando la arquitectura y características histológicas de la lesión.
La determinación de receptores hormonales (estrógenos y progesterona) en las células neoplásicas mamarias es un método valorativo de la diferenciación tumoral (33-35) pero su valor pronóstico no ha sido satisfactorio. En los pacientes con ganglios axilares negativos y expresión positiva de dichos receptores, el grado de recurrencia es sólo un 8-10% menor que en los pacientes que no los expresan (35) y el intervalo libre de enfermedad a largo plazo es similar en ambos grupos (34). Otros relacionan la expresión de receptores con la supervivencia pero no con el intervalo libre de enfermedad (36). No obstante es un dato útil desde el punto de vista terapéutico ya que las pacientes con expresión positiva de receptores responden mejor al tratamiento con Tamoxifeno u otras formas de modulación hormonal que las que no los expresan (36-38).
La expresión del factor de proliferación celular (Ki 67) es muy heterogénea y se correlaciona bien con otros indicadores de la proliferación celular (timidina marcada, fracción de la fase S y contaje mitósico (39).
La sobre expresión inmunohistoquímica de la proteína c-erbB2 (neu) es muy específica cuando es negativa o fuertemente positiva. En este último caso tiene valor predictivo, relacionándose con alto grado histológico, baja supervivencia y mala respuesta a los tratamientos hormonal y quimioterápico convencionales (29,40). La sobre expresión de c-erbB2 posibilita el bloqueo del dominio extracelular del receptor de membrana con Transtuzumab con buenos resultados en pacientes con metástasis (41). Los casos con expresión moderada se correlacionan mal con los resultados terapéuticos por lo que se deben valorar complementariamente mediante hibridación in situ fluorescente (FISH) (42).
La sobre expresión de p53 se produce en el 25% de los carcinomas mamarios debida a la mutación del gen supresor TP53, lo que induce un acúmulo de proteína inactiva y estable en las células neoplásicas (43). Sin embargo, en el 20% de los casos la mutación no produce una proteína estable, por lo que no es detectada inmunohistoquímicamente. La participación de p53 en procesos tan importantes como el control del ciclo celular, la reparación del ADN y la apoptosis sugiere que mutaciones puntuales en determinadas localizaciones del gen, estén más relacionadas son un pronóstico adverso que otras (44-46). No hay consenso sobre la relación entre sobre expresión de p53 y supervivencia (21).
MATERIAL Y MÉTODOS
Hemos estudiado 165 pacientes con diagnóstico anatomopatológico de carcinoma ductal infiltrante (NOS), de los que conocemos el tamaño tumoral (TT) y el estatus ganglionar axilar (EG). En cada uno de ellos hemos valorado el grado histológico combinado (GH) (8) en cortes histológicos teñidos con HE y realizado estudio inmunohistoquímico de antígenos frente a los anticuerpos p53 (monoclonal, no diluido), c-erbB2 (monoclonal, no diluido), Ki 67 (monoclonal no diluido) (Concepta Byosistems S.S., Barcelona) y antireceptores estrogénicos (diluido 1:50) (Novocastra Lab.Ltd. UK) en un procesador automático VENTANA ES (Ventana Medial Systems, Tucson, Arizona, USA) empleando el kit de detección Ventana Enhanced DAD (solución inhibidora de peróxido de hidrógeno, anticuerpo biotilinado antiratón, solución de peróxido de hidrógeno, DAD, solución de sulfato de cobre, hematoxilina y colorante de fondo). El desenmascaramiento antigénico se ha realizado mediante tampón citrato a ph 6, en olla a presión durante 4 minutos.
Hemos correlacionado entre sí el TT, GH y sus tres parámetros (formación tubular, grado nuclear e índice mitósico), el EG y el número de ganglios afectados. Asimismo se han correlacionado cada uno de los parámetros referidos con la expresión de receptores estrogénicos (RE), p53 y c-erbB2.
En la valoración de los parámetros que integran el GH, FT1,FT2 y FT3 indican respectivamente marcada, moderada y escasa o nula formación tubular; GN1, GN2 y GN3 indican respectivamente escasa, moderada e intensa atipia nuclear; IM1, IM2 e IM3 indican respectivamente bajo, moderado y alto índice mitósico.
La determinación de receptores estrogénicos se ha realizado valorando el porcentaje de células tumorales con tinción nuclear positiva (47). La expresión de p53 se ha reflejado en resultado positivo o negativo. La expresión de c-erbB2 se ha valorado como positiva fuerte cuando más del 10% de las células tumorales exhiben tinción de membrana completa e intensa, positiva débil cuando más del 10% de las células neoplásicas exhiben tinción de membrana débil o incompleta y negativa cuando la tinción de membrana es negativa o cuando menos del 10% de las células tumorales exhiben tinción de membrana débil o incompleta (42).
El estudio estadístico se ha realizado con el programa SPSS versión 12.0 para Windows, empleando Tablas de Contingencia u Homogeneidad con el test de Chi-cuadrado, tablas 2 x 2 con la corrección de continuidad y el Análisis de la Varianza (ANOVA). En los casos en que se han obtenido diferencias significativas hemos utilizado el Test de Comparaciones Múltiples de Bonferroni.
RESULTADOS
139 casos (84,24%) expresaron inmunopositividad frente a los receptores estrogénicos (RE+) y 26 (15,76%) no (RE–).
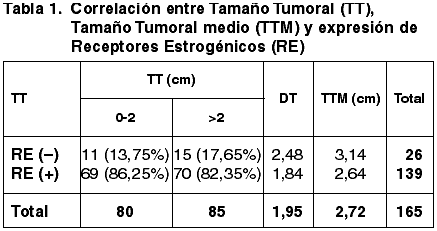
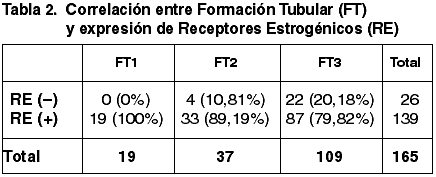
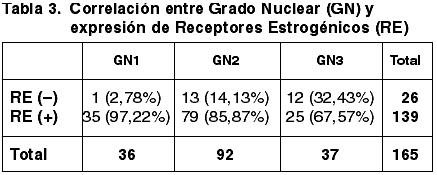
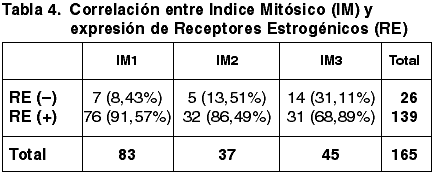
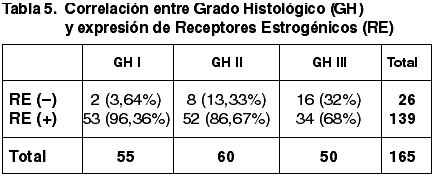
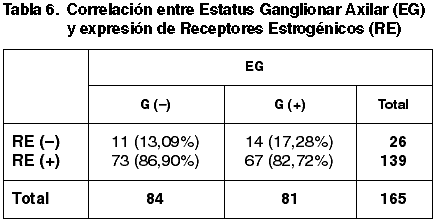
Las correlaciones establecidas entre el TT, Tamaño tumoral medio (TTM), FT, GN, IM, GH, EG, número de ganglios afectados y la expresión de RE quedan reflejadas en las tablas 1-7.

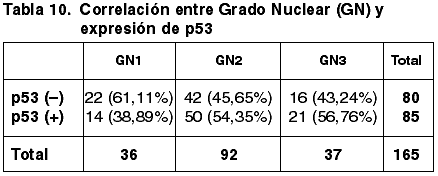
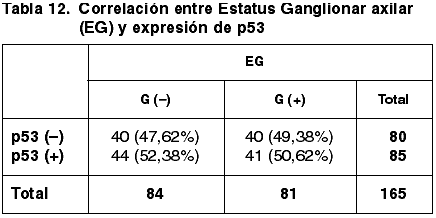
85 casos (51,52%) expresaron inmunopositividad frente a p53 y 80 (48,48%) no.
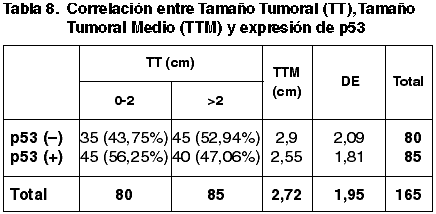
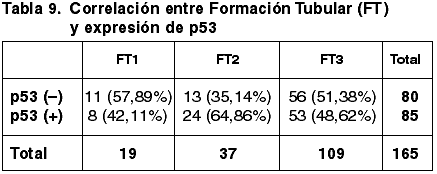
Las correlaciones establecidas entre los parámetros considerados anteriormente y la expresión de p53 quedan reflejadas en las tablas 8-13.


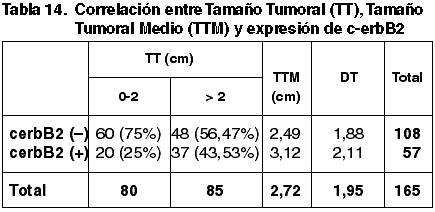
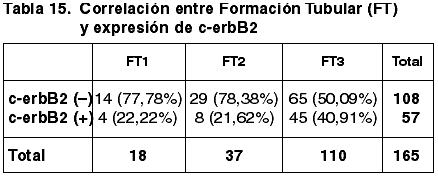
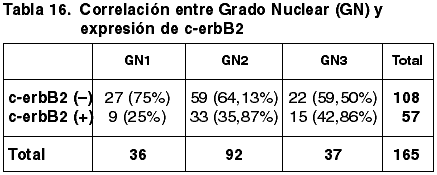
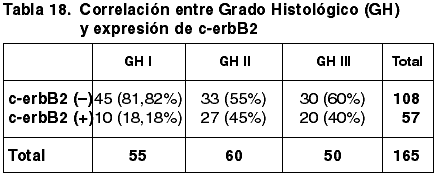
57 casos (34,55%) expresaron inmunopositividad frente a c-erbB2. 106 casos (65,45%) no expresaron c-erbB2.
Las correlaciones establecidas entre los parámetros referidos con anterioridad y la expresión de c-erbB2 quedan reflejadas en las tablas 14-20.



DISCUSIÓN
Se ha correlacionado la expresión de RE con un crecimiento lento del carcinoma mamario (47). No hemos obtenido diferencias significativas entre los casos con inmunoexpresión positiva y negativa de RE al correlacionarlos con el TT (p=0,636). Sin embargo el TTM es menor en la serie con RE positivos que el obtenido en la serie con RE negativos.
Al correlacionar la expresión de RE con los tres parámetros del GH hemos obtenido correlación estadísticamente significativa con el GN (p=0,002) y con el IM (p=0,003) pero no con la FT (p=0,054). Asimismo hemos obtenido una correlación altamente significativa entre la diferente inmunoexpresión de RE y el GH (p=0,000) coincidente con la de otros autores (34,35,48).
En otros trabajos no se establece correlación entre la inmunoexpresión de RE y el EG (47,48). Nuestros resultados sin embargo muestran diferencias significativas (p=0,018) que se mantienen en la serie con más de 4 ganglios axilares afectados, pero se pierde en el grupo con menos de 4 ganglios metastáticos.
La correlación entre el TT, TTM e inmunoexpresión de p53 es contradictoria y sin relevancia estadística (p=0,238). Asimismo no hemos obtenido diferencias significativas entre la diferente inmunoexpresión de p53 y los diferentes parámetros del GH (FT, GN e IM) (p=0,159, p=0,223, p=0,659 respectivamente). Tampoco hemos encontrado correlación con el GH (p=0,373) ni con el EG (p=0,920). Estos resultados son coincidentes con los de otros autores (43).
Aunque existe una correspondencia entre la inmunoexpresión de c-erbB2, TT y TTM, no tiene significación estadística (p=0,600), coincidente con otros trabajos (43). Hemos encontrado diferencias significativas entre la diferente inmunoexpresión de c-erb2 y la FT (p=0,017) pero no con el GN (p=0,141) ni con el IM (0,316). La literatura recoge resultados contradictorios referentes a la correlación entre el GH y la inmunoexpresión de c-erbB2 (43,49). En nuestro estudio hemos obtenido diferencias significativas (p=0,004). No se ha establecido correlación significativa con el EG.
Con el presente trabajo hemos intentado estudiar y correlacionar los parámetros morfológicos e inmunohistoquímicos que han demostrado con el paso de los años tener mayor correlación con la evolución clínica del paciente, determinando cuantitativamente la progresión más probable de la neoplasia. Conforme avance el estudio del carcinoma de mama surgirán nuevos factores pronósticos muchos de ellos genéticos y moleculares que a buen seguro no sólo se añadirán a los clásicos sino que llegarán a determinar de un modo más conciso la probable evolución de la enfermedad. Se trata únicamente de factores pronósticos. La realidad marca sus propias reglas; un adecuado conocimiento de los factores pronósticos y la relación entre los mismos nos permitirá en gran número de casos afrontar el tratamiento del carcinoma ductal infiltrante, y por ende el carcinoma de mama en general, del modo más racional.
BIBLIOGRAFÍA
Ernster V, Barclay L, Kerlikowske K, Wilkie H, Ballard-Barbash R. Mortality among women with ductal carcinoma in situ of the breast in the population –based surveillance, epidemiology and end results program. Arch Intern Med 2000; 160: 953-8.
Simpson J. Predictive utility of the histopathologic analysis of carcinoma of the breast. Advances in Pathol Lab Med 1994; 7: 107-21.
Ellis I, Schnitt S, Sastre-Garau X. Invasive breast carcinoma. En: Tavassoli F & Devilee P, editores. Pathology and Genetics of Tumours of the Breast and Female Genital Organs. Lyon: WHO. IARC Press; 2003. p. 13-59.
Ellis I, Galea M, Brougton N. Pathologic prognostic factors in breast cancer. II: Histologic type. Relationship with survival in a large study with long term follow-up. Histopathology 1992; 20: 479-89.
Black M, Barclay T, Hankey B. Prognosis in breast cancer utilizing histologic characteristics of the primary tumor. Cancer 1975; 36: 2048-55.
Bloom H, Richardson W. Histological grading and prognosis in breast cancer. Br J Cancer 1957; 11: 359-77.
Champion H, Wallace I, Prescott T. Histology in breast cancer prognosis. Br J Cancer 1972; 26: 129-38.
Elston C, Ellis I. Pathological prognostic factors in breast cancer. I. The value of histological grade in breast cancer; experience from a large study with long-term follow-up. Histopathology 1991: 403-410.
Fisher E, Redmond C, Fisher B. Histologic Grading of Breast Cancer. Pathol Ann Part I 1980: 239-52.
Hartveit F. Prognostic typing in breast cancer. Br Med J 1971; 4: 253-7.
Wolf B. Histological grading in carcinoma of breast. Br J Cancer 1966; 20: 36-40.
Baak J. Mitosis counting in tumors. Human Pathol. 1990; 21: 683-5.
Parl F, Duppont W. A restrospective cohort study of histologic risk factors in breast cancer patients. Cancer 1982; 50: 2410-6.
Baak J, Van Dop H, Kurver P. The value of morphometry to classic prognosticators in breast cancer. Cancer 1985; 56: 374-82.
van Diest P, Baak J. The Morphometric prognostic index is the strongest prognosticator in premenopausal lymph node–negative and lymph node-positive breast cancer patients. Hum Pathol 1991; 22: 326-30.
Van Diest P, Baak J, Matze-Cok P, Wisse-Brekelmans EC, van Galen CM, Kurver PH, et al. Reproducibility of mitosis counting in 2469 breast cancer specimens: results from the Multicenter Morphometric Mammary Carcinoma Project. Hum Pathol 1992; 23: 603-7.
Simpson J, Dutt PH, Page D. Expression of mitoses per thousand cells and cell density in breast carcinomas: a proposal. Hum Pathol 1992; 23: 608-11.
Weidner N, Mooore D, Vartanian R. Correlation of ki-67 antigen expression with mitotic figure index and tumor grade in breast carcinomas using the novel parafin reactive M1B1 antibody. Human Pathol 1994; 25: 337-42.
Cross S.Grading and scoring in histopathology. Histopathology 1998; 11: 99-106.
Fitzgibbons P, Page D, Weaver D, Thor AD, Allred DC, Clark GM, et al. Prognostic factors in breast cancer. College of American Pathologists Consensus Statement 1999. Arch Pathol Lab Med 2000; 124: 966-78.
Mansour E, Ravdin P, Dressler L. Prognostic factors in early breast carcinoma. Cancer 1994; 74: 381-400.
Leitner S, Swern A, Weinberger D, Duncan LJ, Hutter RV. Predictors of recurrence for patients with small (one centimeter or less) localized breast cancer (T1a,b N0 M0). Cancer 1995; 76: 2266-74.
Seidman J, Schnapper L, Aisner S. Relationship of the size of the invasive component of the primary breast carcinoma to axillary lymph node metastasis. Cancer 1995; 75: 65-71.
Chen Y, Schnitt S. Prognostic factors for patients with breast cancers 1 cm and smaller. Breast Cancer Res Treat 1998; 51: 209-25.
Abner A, Collins L, Peiro G, Recht A, Come S, Shulman LN, et al. Correlation of tumor size and axillary lymph node involvement with prognosis in patients with T1 breast carcinoma. Cancer 1998; 83: 2502-8.
Rosen P, Oberman H. Tumors of the Mammary Gland. Atlas of Tumor Pathology. Third Series. Fascicle 7. Washington DC: AFIP; 1993.
Visscher D, Sarkar F, Crissman J. Clinical significance of pathologic, cytometric and molecular parameters in carcinoma of the breast. Advances Pathol Lab Med 1992; 5: 123-61.
Arora R, Joshi K, Nijhawan R, Radotra BD, Sharma SC. Angiogenesis as an independent prognostic indicator in node-negative breast cancer. Anal Quant Cytol Histol 2002; 24: 228-33.
Allred D, Elledge R. Caution concerning micrometastatic breast carcinoma in sentinel lymph nodes. Cancer 1999; 86: 905-7.
Clayton F, Hopkins C. Pathologic correlates of prognosis in lymph node-positive breast carcinomas. Cancer 1993; 71: 1780-90.
De Mascarell I, Bonichon F, Coindre JM, Trojani M. Prognostic significance of breast cancer axillary lymph node micrometastases assessed by two special techniques: re-evaluation with longer follow-up. Br J Cancer 1992; 66: 523-7.
Liberman L. Pathologic analysis of sentinel lymph nodes in breast carcinoma. Cancer 2000; 88: 971-7.
Fox S, Leek R, Weekes M, Whitehouse RM, Gatter KC, Harris AL. Quantitation and prognostic value of breast cancer angiogenesis: comparison of microvessel density, Chalkey count and computer image analisis. J Pathol 1995; 177: 275-83.
Henderson I, Canellos G. Cancer of the breast. The past decade. N Engl J Med 1980; 103: 17-20.
McGuire W, Tandon A, Allred DC, Chamness GC, Clark GM. How to use prognostic factors in axillary node-negative breast cancer patients. J Natl Cancer Inst 1990; 82: 1006-15.
Anderson E: The use of steroid receptors in predicting response to hormonal therapy. Pronostic and predicitive factors in breast cancer. London: Walter R. Edit.; 2003. p. 135-46.
Harvey J, Clark G, Osborne CK, Allred DC. Estrogens receptor status by immunohistochemistry is superior to the ligand-binding assay for predicting response to adjuvant endocrine therapy in breast cancer. J Clin Oncol 1999; 17: 1474-81.
Thor A. Prognostic factors in breast cancer: integrating the cytology laboratory. Diag Cytopathol 1992; 4: 319-21.
Connor A, Pinder S, Elston CW, Bell JA, Wencyk P, Robertson JFR, et al. Intratumoral heterogeneity of proliferation in invasive breast carcinoma evaluated with MIB-1 antibody. Breast 1997; 6: 171-6.
Allred D, Elledge R. Caution concerning micrometastatic breast carcinoma in sentinel lymph nodes. Cancer 1999; 86: 905-7.
Thor A, Berry D, Budman DR, Muss HB, Kute T, Henderson IC, et al. Erb-2, p53, and efficacy of adjuvant therapy in lymph node-positive breast cancer. J Natl Cancer Inst 1998; 90: 1346-60.
Vogel C, Cobleigh M, Tripathy D, Gutheil JC, Harris LN, Fehrenbacher L, et al. Efficacy and safety of Trastuzumab as a single agent in first-line treatment of Her-2 over expressing metastatic breast cancer. J Clin Oncol 2002; 20: 719-26.
Ridolfi R, Jamenhdor M, Arber J. Her-2/neu testing in breast carcinoma: a combined immunohistochemical and fluorescence in situ hibridation approach. Mod Pathol 2000; 13: 866-73.
Erden O, Dursun A, Loskun U, Günel N. The prognostic value of p53 and c-erbB2 expression, proliferative activity and angiogenesis in node-negative breast carcinoma. Tumori 2005; 91: 46-52.
Kucera E, Speiser P, Gnant M, Szabo L, Samonigg H, Hausmaninger H, et al. Prognostic significance of mutation in the p53 gene, particularly in the zinc-binding domains, in lymph node-and steroid receptor positive breast cancer patient. Austrian Breast Cancer Study Group. Eur J Cancer 1999; 35: 398-405.
Wood D, Vousden K. Regulation of p53 function. Exp Cell Res 2001; 264: 56-66.
Zheng W, Zhan R. Quantitative comparison of apoptosis to cell proliferation and p53 protein in breast carcinomas. Analyt Quant Cytol Histol 1998: 20: 1-6.
Leaker R, Barnes D, Pinder S, Ellis I, Anderson L, Anderson T, et al. Immunohistochemical detection of steroid receptors in breast cancer: a working protocol. J Clin Pathol 2000; 53: 634-5.
Sopel M, Kasprzyk I, Berdowska I. Maspin and cerbB2 expression in correlation with microvessel density in invasive ductal breast cancer. Folia Histoch Cytobiol 2005; 43: 109-16.