
Vol. 40, n.º 4, 2007
REVISTA
ESPAÑOLA DE
Vol. 40, n.º 4, 2007 |
ORIGINALES
F. Ignacio Aranda López, María Niveiro de Jaime, Gloria Peiró Cabrera, Cristina Alenda González, Antonio Picó Alfonso1
Hospital General Universitario de Alicante. Av. Pintor Baeza,
s/n. 03010 Alicante.
1 Servicio de Endocrinología.
aranda_ign@gva.es
RESUMEN
Antecedentes: Los adenomas hipofisarios son neoplasias benignas que pueden tener un comportamiento localmente agresivo. Métodos: En el presente trabajo se analiza el significado de la actividad proliferativa mediante inmunotinción con Ki-67 en una serie de 107 adenomas hipofisarios. Resultados: La actividad proliferativa media fue de 1,99% (rango 0%-18%) y la mayoría (81%) presentaron Ki-67 <3%. Se observó una tendencia a la asociación entre mayor nivel de Ki-67 y extensión extraselar, tipo inmunohistoquímico hormonal (prolactinomas y adenomas gonadotropos), sexo masculino y menor edad. Sin embargo, no se demostró asociación significativa con la densidad mitocondrial y la densidad microvascular (DMV), la actividad funcional o la aparición de recidiva. Conclusiones: El estudio de la actividad proliferativa con Ki-67 puede definir un subgrupo de adenomas hipofisarios con comportamiento localmente más agresivo.
Palabras clave: Adenoma hipofisario, Ki-67, proliferación celular, inmunohistoquímica, angiogénesis.
SUMMARY
Introduction: Pituitary adenomas are benign neoplasias, but they may behave locally more aggressive. Methods: The present study analyzes the significance of proliferative activity by Ki-67 staining in a series of 107 pituitary adenomas. Results: The mean proliferative activity rate was 1.99% (range 0%-18%) and the majority (81%) showed Ki-67 <3%. We showed a trend towards a higher Ki-67 in adenomas with extrasellar extension, hormonal subtype (prolactinomas and gonadotroph cell adenomas), male gender and younger age. However, no significant differences were found between Ki-67 and mitochondrial or microvascular densities, functional activity or recurrence. Conclusions: We conclude that the proliferative activity evaluated by Ki-67 can define a subset of pituitary adenomas with a more aggressive behavior.
Key words: Pituitary adenoma, Ki-67, cell proliferation, immunohistochemistry, angiogenesis.
INTRODUCCIÓN
Los adenomas hipofisarios (AH) constituyen un 10-15% de las neoplasias intracraneales en series quirúrgicas (1-4). Su clasificación se basa en criterios histológicos, inmunohistoquímicos y ultraestructurales, que tienen en cuenta los hallazgos bioquímicos, de técnicas de imagen y quirúrgicos (3). Las primeras clasificaciones de los AH distinguían, basándose en las propiedades tintoriales de las células, tres tipos de adenoma: acidófilo, basófilo y cromófobo, con escasa correlación con la clínica. La generalización de las técnicas inmunohistoquímicas en los años 80 permitió el desarrollo de clasificaciones más funcionales y la identificación de subtipos morfológicos con criterios bien definidos (1,2,4,5). Otras técnicas auxiliares como el estudio de proliferación celular con Ki-67, también aportan información útil en un contexto morfológico (6-9). La nueva clasificación OMS define tres tipos principales de tumor hipofisario: AH típico, AH atípico y carcinoma hipofisario (3). Sin embargo las diferencias entre los «típicos» y «atípicos» no quedan claramente establecidas. Los AH «atípicos» presentarían algunos rasgos morfológicos que sugieren mayor agresividad biológica, como mayor pleomorfismo nuclear, necrosis, incremento del número de mitosis, actividad proliferativa con Ki-67 mayor del 3-5% y en general, un comportamiento localmente agresivo detectado con técnicas de imagen. Los adenomas sin estas características, serían clasificados como «típicos» y constituyen la mayoría de los AH (3). El objetivo del presente trabajo es evaluar la actividad proliferativa estimada tras inmunotinción con Ki-67 en una serie de AH y su correlación con a) características clínicas como edad y sexo, b) presentación radiológica y c) patológicas como tipo inmunohistoquímico hormonal, densidad mitocondrial y densidad microvascular (DMV).
MATERIAL Y MÉTODOS
De una serie de 122 AH procedentes del archivo del Servicio de Patología del Hospital General Universitario de Alicante, intervenidos entre 1990 y 2005, se seleccionaron 107 casos. Quince casos fueron excluidos al considerarse el material muy escaso, necrótico o no representativo. La edad de los pacientes osciló entre 12 y 83 años (media 51, desv. típica 15); 53 fueron mujeres y 54 hombres; 10 casos (9%) fueron microadenomas (<10 mm). Once pacientes (10%) presentaron recidiva tumoral en periodos comprendidos entre 3 y 36 meses.
El tejido había sido fijado en formalina neutra al 10%, tamponada e incluido en parafina de forma convencional. Las secciones de 2 micrometros de espesor, fueron desparafinadas y rehidratadas. Los anticuerpos utilizados y las diluciones pueden observarse en la tabla 1. El estudio inmunohistoquímico fue realizado utilizando estreptavidina-biotina peroxidasa en un inmunoñidor automático (TechMate 500 Dako). La metodología de cuantificación ha sido descrita previamente (10,11). Los adenomas fueron clasificados siguiendo los criterios clinicopatológicos recomendados por la OMS (3): 27 adenomas somatotropos, 9 prolactinomas, 2 adenomas de célula madre acidófila (incluidos en el grupo de prolactinomas a efecto de análisis), 13 corticotropinomas, 2 tirotropinomas, y 54 gonadotropinomas/nulos (12 oncocíticos). Los adenomas somatotropos fueron subclasificados teniendo en cuenta el patrón de tinción con citoqueratinas y la densidad de inmunotinción con GH (12). En relación con los signos de función endocrina, un 43% (46/107) de los casos fueron adenomas funcionantes. De los no funcionantes (57%; 61/107), 53 fueron adenomas gonadotropos/nulos, 6 adenomas corticotropos y 2 prolactinomas.
Para el análisis de la actividad proliferativa con Ki-67 se establecieron dos puntos de corte, 3 y 5%. La densidad mitocondrial fue estimada en 85 casos tras inmunotinción con anticuerpo antimitocondrial, siguiendo criterios previamente establecidos (11). En 67 casos se determinó la densidad microvascular tras inmunotinción con CD34, expresada en vasos/mm2 (10).
Análisis estadístico
Se calculó el nivel de asociación entre las variables analizadas. Los datos fueron analizados utilizando la aplicación estadística SPSS v 12.0. Tras evaluar si las pruebas parámetricas eran válidas (Kolmogorov-Sminov p>0,05), se aplicaron métodos paramétricos (Anova y t-student) y no paramétricos (U-Mann Whitney). Para las variables cualitativas se aplicó la prueba del chi cuadrado o prueba exacta de Fisher para analizar las diferencias. Sólo las diferencias con p<0,05 fueron consideradas significativas.
RESULTADOS
La actividad proliferativa media con Ki-67 fue 1,99% (rango 0-18%, desv. típica 2,7) (fig. 1). El 21% de los casos presentaron Ki-67 ≥3% y el 8% ≥5%. En relación con la edad, los adenomas en pacientes <50 años presentaron una mayor actividad proliferativa (corte 3% y 5%), si bien las diferencias no fueron significativas (p=0,16; test de Fisher). Esta tendencia se perdió cuando se compararon pacientes mayores y menores de 65 años (p=0,68).
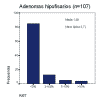
Fig. 1:
Gráfico de barras con distribución de los casos
según el porcentaje de células positivas para Ki-67.
El 26% de los adenomas en hombres y el 15% en mujeres tenían Ki-67 ≥3% (p=0,16; chi cuadrado). Sin embargo, con el corte del 5% no se observó diferencias significativas (tabla 2).
El 80% de los adenomas presentaron extensión extraselar en la evaluación con TAC/RMN, y de ellos, 23% tenían Ki-67 >3%. Sin embargo, observamos que el 10% de los adenomas sin extensión presentaban también Ki-67 ≥3% (p=0,23; test de Fisher). Por otra parte todos los adenomas con Ki-67 ≥5% presentaron extensión extraselar, y ninguno de los AH limitados a la silla turca presentó ese nivel de actividad proliferativa (p=0,2; Fisher). Tras comprobar la distribución no normal de la variable Ki-67(p>0,05, Kolmogorov-Smirnoff), se realizó análisis de medianas (prueba U-Mann-Whitne) que demostró diferencias significativas de Ki-67 en relación con la extensión extraselar (p=0,034) (fig. 2).
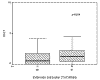
Fig. 2:
Gráfico de cajas, con distribución de Ki-67 y
valoración radiológica de la extensión extraselar.
El 55% y 46% de los prolactinomas (fig. 3), 20% y 6% de los gonadotropinomas-nulos (fig. 4), 11% y 0% de los adenomas somatotropos (fig. 5), 15% y 8% de los corticotropos (fig. 6) y 0% y 0% de los tirotropinomas presentaron Ki-67 ≥3% y ≥5%, respectivamente (p=0,041 y p<0,000). El análisis de medias también demostró diferencias significativas por tipo hormonal (p=0,017, Anova) (fig. 7). No se observó asociación entre actividad proliferativa y actividad funcional del adenoma (p=0,23), ni con aparición de recidiva tumoral (p=0,56).
![]()
Fig. 3:
Prolactinoma. A) Inmunotinción para prolactina
con patrón paranuclear (x400); B) Positividad nuclear para Ki67, con actividad
proliferativa estimada del 4,2% (x400).
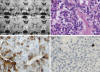
Fig. 4:
Adenoma hipofisario gonadotropo. A) Cortes
coronales con RMN. Macroadenoma con destrucción selar y extensión supraselar. B)
Arquitectura pseudorosetoide con células de citoplasma cromófobo (H&E x 400). C)
Inmunotinción para LH (x400). D) Inmunotinción nuclear para Ki67, con actividad
proliferativa menor del 3% (x400).

Fig. 5:
Adenoma hipofisario somatotropo. A) RM, corte
lateral. Microadenoma intraselar de 9 mm. B) Leve pleomorfismo nuclear, y
citoplasmas tintorialmente cromófobos (x400). C) Inmunotinción para GH (x400).
D) Inmunotinción para Ki-67, con actividad proliferativa baja, menor del 3%
(x400).
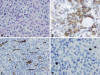
Fig. 6:
Adenoma corticotropo silente. A) Adenoma
tintorialmente cromófobo. Algunas de las células presentan cambio hialino
citoplasmático (x400). B) Inmunotinción para ACTH (x400). C) Red microvascular
con CD34 (x400). D) Inmunotinción con Ki-67 baja, menor del 3%.
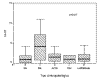
Fig. 7:
Gráfico de cajas con distribución de Ki-67 en
relación con el tipo clinicopatológico de adenoma.
Dentro de los adenomas somatotropos, no se observaron diferencias significativas de la actividad proliferativa entre adenomas densa- y pobremente granulados (Ki-67 ≥3% en 1/11 adenomas densamente granulados contra 2/16 en adenomas pobremente granulados, p=n.s.).
En el grupo de adenomas gonadotropos/nulos, 11 adenomas (28%) estaban constituidos por 50% o más oncocitos. No se observaron diferencias significativas en la actividad proliferativa de adenomas oncocíticos y no oncocíticos (p=n.s.).
La DMV con CD34 fue estimada en 67 adenomas, con una media de 245 vasos/mm2 (rango 85-575, desv. típica 105). La DMV media fue de 248 y 245 vasos/mm2 en adenomas con Ki-67 ≥3% y ≥5% frente a 225 y 235 vasos/mm2 en adenomas con Ki-67 <3% y <5%, respectivamente (p=n.s.).
DISCUSIÓN
Los resultados del presente trabajo confirman que la actividad proliferativa de la mayoría de los adenomas hipofisarios es baja (<3%). En nuestra serie, la actividad proliferativa media fue de 1.99%, similar a la observada por otros autores, con rangos que oscilan entre 1,1 y 2,6% (7,8,13-15). Sin embargo, teniendo en cuenta únicamente la actividad proliferativa, un 21% de los AH pueden considerarse «atípicos», con Ki-67 >3%.
Otro de los aspectos analizados y poco estudiado previamente, es la relación entre actividad proliferativa y edad de presentación. Nuestros resultados sugieren que los adenomas en pacientes menores de 50 años tienen mayor actividad proliferativa. Por otra parte, otros investigadores demuestran una relación inversa entre estas dos variables sólo en adenomas secretores (14) o una mayor actividad proliferativa en pacientes mayores de 65 años (16).
La prevalencia de la invasión oscila entre el 10% y 95% (14,17). En la presente serie, 80% de los adenomas presentaron extensión extraselar demostrada por TAC y/o RMN, en asociación a una mayor actividad proliferativa, de acuerdo con estudios recientemente publicados (6,8,14,15,17-19). Sin embargo, existen datos contradictorios (20-23). Estas discrepancias podrían atribuirse, al menos en parte, a los diferentes criterios para definir la invasión (6,8,14,15,17,18). En relación con el riesgo de recidiva, no encontramos asociación con el grado de actividad proliferativa, en concordancia con otros autores (14,24). Por otra parte, este hallazgo no es sorprendente ya que factores como el tamaño y extensión del tumor en el momento de la intervención pueden ser más relevantes que la proliferación celular.
La nueva clasificación de la OMS se basa en la aplicación de criterios clínicos y patológicos, que incluyen la inmunohistoquímica hormonal (3). Si bien los prolactinomas son los adenomas hipofisarios más prevalentes, están menos representados en las series quirúrgicas ya que en su mayoría son controlados medicamente (25) y sólo los casos resistentes a este tratamiento son intervenidos quirúgicamente. En la presente serie, 91% de los prolactinomas fueron invasivos y 55% mostraron Ki-67 ≥3%. Además de los prolactinomas, los adenomas más proliferativos fueron los gonadotropos/nulos y los corticotropos, de modo similar a otros estudios (17).
Muchos de los adenomas clasificados como «no secretores» por otros investigadores, corresponden en realidad a adenomas gonadotropos cuando se realiza el estudio inmunohistoquímico completo (4,26). Los adenomas oncocíticos son adenomas gonadotropos o nulos constituidos por células con alta densidad mitocondrial (11,27). En nuestros casos (11) no hemos podido demostrar una mayor actividad proliferativa en los adenomas oncocíticos, lo que contrasta con los resultados obtenidos por Schreiber et al (28). Además, al igual que otros autores (17), tampoco encontramos asociación entre una mayor actividad proliferativa en adenomas funcionantes comparada con los no funcionantes. Sin embargo, Jaffrain-Rea et al (14) en una serie de 132 AH estudiados con MIB-1, con una media de 1,22% de células positivas, encuentran diferencias significativas entre adenomas clínicamente secretores y no secretores, con mayor actividad proliferativa en el grupo secretor. Estas diferencias podría ser atribuibles a la diferente distribución de los casos según el tipo hormonal, Así en la serie citada (14), el subtipo predominante fue el de los adenomas somatotropos, lo que podría influir en sus resultados.
En el grupo de adenomas somatrotropos, se ha observado un comportamiento localmente más agresivo de los adenomas pobremente granulados así como una mayor actividad proliferativa con Ki-67 (9). Sin embargo, nuestros resultados no mostraron diferencias significativas, si bien esto podría deberse al bajo número de casos que constituye este subgrupo en nuestra serie.
Parte de los resultados del presente estudio relacionados con la angiogénesis han sido previamente publicados (10). La inclusión de más pacientes, corrobora la ausencia de asociación entre la actividad proliferativa y la DMV, también observado por otros autores (29,30).
En resumen, el estudio de la actividad proliferativa con Ki-67 debería formar parte del estudio rutinario de los AH, ya que puede contribuir a delimitar un grupo de adenomas de comportamiento localmente más agresivo.
AGRADECIMIENTOS
Agradecemos a M.ª Dolores Durán, Juan Pulido, y Cristina Albaladejo, técnicos especialistas en Anatomía Patológica del Hospital General Universitario de Alicante, su asistencia técnica en el procesamiento y realización de las técnicas inmunohistoquímicas.
BIBLIOGRAFÍA
Sanno N, Teramoto A, Osamura RY, Horvath E, Kovacs K, Lloyd RV, et al. Pathology of pituitary tumors. Neurosurg Clin N Am 2003, 14: 25-39.
Kovacs K, Horvath E, Vidal S. Classification of pituitary adenomas. J Neurooncol 2001; 54: 121-7.
DeLellis RA LR, Heitz PU, Eng C, editores. World Health Organization Classification ot Tumours. Pathology and genetics of Endocrine Organs. Pathology and genetics of tumours of endocrine organs. Lyon: IARC; 2004; p. 9-47.
Niveiro M, Aranda FI, Peiró G: Patología de los adenomas hipofisarios. Rev Esp Patol 2003; 36: 357-72.
Lloyd RV, Scheithauer BW, Kovacs K, Roche PC. The Immunophenotype of Pituitary Adenomas. Endocr Pathol 1996; 7: 145-50.
Landolt AM, Shibata T, Kleihues P. Growth rate of human pituitary adenomas. J Neurosurg 1987; 67: 803-6.
Kitz K, Knosp E, Koos WT, Korn A. Proliferation in pituitary adenomas: measurement by MAb KI 67. Acta Neurochir Suppl (Wien) 1991; 53: 60-4.
Mastronardi L, Guiducci A, Spera C, Puzzilli F, Liberati F, Maira G. Ki-67 labelling index and invasiveness among anterior pituitary adenomas: analysis of 103 cases using the MIB-1 monoclonal antibody. J Clin Pathol 1999; 52: 107-11.
Thapar K, Kovacs K, Scheithauer BW, Stefaneanu L, Horvath E, Pernicone PJ, et al. Proliferative activity and invasiveness among pituitary adenomas and carcinomas: an analysis using the MIB-1 antibody. Neurosurgery 1996; 38: 99-106.
Niveiro M, Aranda FI, Peiro G, Alenda C, Pico A. Immunohistochemical analysis of tumor angiogenic factors in human pituitary adenomas. Hum Pathol 2005; 36: 1090-5.
Niveiro M, Aranda FI, Paya A, Boix E, Peiro G, Pico A. Oncocytic transformation in pituitary adenomas: immunohistochemical analyses of 65 cases. Arch Pathol Lab Med 2004; 128: 776-80.
Aranda FI, Anaya A. Adenomas hipofisarios asociados con acromegalia. Rev Esp Patol 1991; 24: 7-16.
Wolfsberger S, Wunderer J, Zachenhofer I, Czech T, Bocher-Schwarz HG, Hainfellner J, et al. Expression of cell proliferation markers in pituitary adenomas-correlation and clinical relevance of MIB-1 and anti-topoisomerase-IIalpha. Acta Neurochir (Wien) 2004; 146: 831-9.
Jaffrain-Rea ML, Di Stefano D, Minniti G, Esposito V, Bultrini A, Ferretti E, et al. A critical reappraisal of MIB-1 labelling index significance in a large series of pituitary tumours: secreting versus non-secreting adenomas. Endocr Relat Cancer 2002; 9: 103-13.
Thapar K, Yamada Y, Scheithauer B, Kovacs K, Yamada S, Stefaneanu L. Assessment of Mitotic Activity in Pituitary Adenomas and Carcinomas. Endocr Pathol 1996; 7: 215-21.
Mastronardi L, Guiducci A, Puzzilli F, Maira G. Anterior pituitary adenomas in patients aged more than 65 years: analysis of growth fraction (using the MIB-1 monoclonal antibody) and of clinical features in comparison to younger patients. Clin Neurol Neurosurg 2002; 104: 44-8.
Pizarro CB, Oliveira MC, Coutinho LB, Ferreira NP. Measurement of Ki-67 antigen in 159 pituitary adenomas using the MIB-1 monoclonal antibody. Braz J Med Biol Res 2004; 37: 235-43.
Knosp E, Kitz K, Steiner E, Matula C. Pituitary adenomas with parasellar invasion. Acta Neurochir Suppl (Wien) 1991; 53: 65-71.
Zhao D, Tomono Y, Nose T. Expression of P27kip1 and Ki-67 in pituitary adenomas: an investigation of marker of adenoma invasiveness. Acta Neurochir (Wien) 1999; 141: 187-92.
Gandour-Edwards R, Kapadia SB, Janecka IP, Martinez AJ, Barnes L. Biologic markers of invasive pituitary adenomas involving the sphenoid sinus. Mod Pathol 1995; 8: 160-4.
Kawamoto H, Uozumi T, Kawamoto K, Arita K, Yano T, Hirohata T. Analysis of the growth rate and cavernous sinus invasion of pituitary adenomas. Acta Neurochir (Wien) 1995; 136: 37-43.
Yonezawa K, Tamaki N, Kokunai T. Clinical features and growth fractions of pituitary adenomas. Surg Neurol 1997; 48: 494-500.
Losa M, Franzin A, Mangili F, Terreni MR, Barzaghi R, Veglia F, et al. Proliferation index of nonfunctioning pituitary adenomas: correlations with clinical characteristics and long-term follow-up results. Neurosurgery 2000; 47: 1313-8.
Hentschel SJ, McCutcheon E, Moore W, Durity FA. P53 and MIB-1 immunohistochemistry as predictors of the clinical behavior of nonfunctioning pituitary adenomas. Can J Neurol Sci 2003; 30: 215-9.
Heaney AP, Melmed S. Molecular targets in pituitary tumours. Nat Rev Cancer 2004; 4: 285-295.
Ho DM, Hsu CY, Ting LT, Chiang H. The clinicopathological characteristics of gonadotroph cell adenoma: a study of 118 cases. Hum Pathol 1997; 28: 905-911.
Nishioka H, Ito H, Hirano A, Shibata N, Kobayashi M. Immunocytochemical study of pituitary oncocytic adenomas. Acta Neuropathol (Berl) 1997; 94: 42-47.
Schreiber S, Saeger W, Ludecke DK. Proliferation markers in different types of clinically non-secreting pituitary adenomas. Pituitary 1999; 1: 213-220.
Turner HE, Harris AL, Melmed S, Wass JA. Angiogenesis in endocrine tumors. Endocr Rev 2003; 24: 600-632.
Vidal S, Kovacs K, Horvath E, Scheithauer BW, Kuroki T, Lloyd RV. Microvessel density in pituitary adenomas and carcinomas. Virchows Arch 2001; 438: 595-602.