
Vol. 41, n.º 1, 2008
REVISTA
ESPAÑOLA DE
Vol. 41, n.º 1, 2008 |
ORIGINALES
Carmen Etxezarraga, José I. López
Servicio de Patología, Hospital de Basurto.
Universidad del País Vasco (EHU/UPV). Avda. Montevideo, 18. 48013 Bilbao.
joseignacio.lopez@ehu.es
RESUMEN
Antecedentes: La neoplasia intraepitelial prostática de alto grado (PIN-AG) y el foco de microglándulas atípicas (ASAP) son dos hallazgos histológicos estrechamente relacionados con el cáncer de próstata. En este trabajo se analiza una serie amplia de ambos diagnósticos como único dato reseñable en la primera biopsia y su relación con el adenocarcinoma de próstata aparecido en biopsias subsiguientes. Métodos: Se analizan histológicamente 125 PIN-AG sin adenocarcinoma concomitante y 45 ASAP diagnosticados entre un total de 4.770 biopsias transrectales durante un periodo de 8 años (1998-2005). Se analizan todas las rebiopsias de cada uno de los casos y las características propias de los carcinomas aparecidos en algunas de éstas. Resultados: El porcentaje de cáncer en la muestra general es del 30,3%. Sin embargo, entre los casos previamente diagnosticados de PIN-AG se detectó cáncer en 21 (16,8%) y entre los diagnosticados de ASAP, en 12 (26,7%). La demora media entre ambos diagnósticos y el cáncer fue de 12,3 y 12,7 meses, respectivamente. El número de rebiopsias necesarias hasta la aparición de cáncer fue de 1 a 4 en el PIN-AG y de 1 a 3 en el ASAP. Se observa una correlación significativa entre el PIN-AG y varios parámetros histológicos del cáncer en la biopsia [número de focos de cáncer (p=0,003), milímetros totales de cáncer (p=0,000), bilateralidad (p=0,024), Índice de Gleason (p=0,011), invasión perineural (p=0,015)] y en la prostatectomía radical [pT (p=0,010)]. Conclusiones: No existe mayor probabilidad de detectar cáncer de próstata en aquellos pacientes con diagnóstico previo de PIN-AG o ASAP respecto de la población general que se biopsia. En el caso de existir cáncer, pueden ser necesarias hasta 4 biopsias repetidas para detectarlo.
Palabras Clave: PIN de alto grado, ASAP, adenocarcinoma de próstata, demora diagnóstica, rebiopsia.
SUMMARY
Background: High-grade PIN and ASAP are histological findings closely related to prostate cancer. We analyse a large series of both diagnoses and their relationship with the prostate cancers appeared in subsequent biopsies. Methods: We analyse 125 high-grade PIN and 45 ASAP cases diagnosed among 4,770 transrectal biopsies during an 8-year period (1998-2005). The histological characteristics of all the rebiopsies and the peculiarities of every cancer subsequently diagnosed of cancer are reviewed. Results: Prostate cancer was detected in 30.3% in the general series. However, it was found only in 16.8% and 26.7% of cases previously diagnosed as high grade PIN and ASAP, respectively. Mean delay in the diagnosis of cancer was 12.3 and 12.7 months and the number of rebiopsies needed for it oscillated between 1and 4 in high-grade PIN and 1 and 3 in ASAP. A significant correlation between high-grade PIN and several histological parameters of cancer in the biopsy [number of cancer foci (p=0.003), total millimetres of cancer (p=0.000), bilateralism (p=0.024), Gleason index (p=0.011), perineurial invasion (p=0.015)] and in the radical prostatectomy [pT (p=0.010)] were detected. Conclusions: There is no higher probability to found prostate cancer in cases with previous high-grade PIN or ASAP. The diagnosis of cancer may need up to 4 repeated biopsies.
Key Words: High grade PIN, ASAP, prostate adenocarcinoma, diagnostic delay, rebiopsy.
INTRODUCCIÓN
La neoplasia intraepitelial prostática de alto grado (PIN-AG) ha sido tradicionalmente considerada como una lesión precursora del cáncer de próstata (1,2). Sin embargo, estudios recientes muestran una incidencia irregular de esta neoplasia en pacientes a los que se ha diagnosticado previamente PIN-AG (3-8). Más allá de la recomendación genérica de rebiopsiar estos casos, no existen protocolos consensuados sobre cuándo y cómo hacerlo, y ni siquiera se tiene una idea unificada sobre de que manera valorar la cantidad y extensión del PIN-AG encontrado a la hora de plantear estrategias de seguimiento clínico. Asimismo, existen en la literatura datos contradictorios incluso sobre la relativa importancia del número de cilindros afectados en relación al riesgo subsiguiente de hallar cáncer en biopsias sucesivas (3,7,9-11).
El diagnóstico de ASAP también se ha relacionado estrechamente con el hallazgo de adenocarcinoma de próstata en biopsias posteriores (12-16). De hecho, este diagnóstico se realiza ante pequeños focos de glándulas pequeñas que no cumplen los criterios mínimos de seguridad de cáncer y cuyos parámetros están bien definidos (17). Asimismo, existen en la literatura cifras variadas de asociación con cáncer en biopsias posteriores (12-16).
En este trabajo se analizan los datos propios en una serie de casos amplia, tanto los relativos a PIN-AG como a la ASAP. Además, se establece la relación entre estos hallazgos histológicos y su relación con el cáncer en biopsias repetidas posteriores, así como las peculiaridades de éste cuando aparece.
MATERIAL Y MÉTODOS
Durante el período 1998-2005, se han practicado en el Hospital de Basurto un total de 4.770 biopsias transrectales de próstata siguiendo criterios clínicos homogéneos. Los pacientes diagnosticados de PIN de alto grado (PIN-AG) sin adenocarcinoma acompañante o de proliferación microglandular atípica (ASAP), fueron seguidos clínicamente mediante determinaciones periódicas semestrales de PSA y por tacto rectal. Se realizó rebiopsia siguiendo el criterio clínico en cada caso, ante elevaciones mantenidas de PSA, o ante cifras anormales en la densidad (>15 ng/ml/cc) y/o la velocidad (>0,75 ng/ml/año o >20% anual) de PSA.
Se obtuvieron en cada caso entre 6 y 10 cilindros de tejido prostático en la primera biopsia y entre 10 y 12 en las biopsias repetidas. Los cilindros obtenidos se fijaron en formol y se procesaron en el Laboratorio de Anatomía Patológica de manera rutinaria. Se realizaron entre 24 y 36 cortes histológicos que se tiñeron con Hematoxilina-Eosina para el estudio histológico. La inmunotinción con p504S, p63, y citoqueratina 5.6 se reservó para resolver casos dudosos. Los diagnósticos de PIN-AG y de ASAP se basaron en los criterios morfológicos previamente descritos, distinguiéndose en el caso del PIN-AG los siguientes patrones: plano, micropapilar, cribiforme, en tachuela, y «tufted» (18,19).
Se analiza la correlación estadística existente entre el hallazgo de PIN-AG o ASAP y determinados parámetros del adenocarcinoma con especial significado pronóstico (test de Spearman) (SPSS 14.0 para Windows, Chicago, USA).
RESULTADOS
Se han diagnosticado 1.450 carcinomas de próstata, 125 PIN-AG no asociado a cáncer, y 45 ASAP en un total de 4.770 biopsias por punción transrectal. Ello supone detectar cáncer en el 30,3% de las biopsias, PIN-AG sin cáncer en el 2,6%, y ASAP en el 0,9%. Entre los casos diagnosticados de PIN-AG, 21 (16,8%) tuvieron un diagnóstico posterior de cáncer, y entre los ASAP, 12 (26,7%). El 25% de los cánceres diagnosticados en este mismo periodo fueron tratados mediante cirugía radical. De los 21 carcinomas con diagnóstico previo de PIN-AG, 9 fueron tratados con cirugía radical y de los 12 con ASAP, 3.
La edad media de los pacientes en el grupo de pacientes con PIN-AG no asociado a cáncer fue de 72 años (rango, 57-88). La demora media entre el primer diagnóstico de PIN-AG y el hallazgo de cáncer fue de 12,3 meses (rango, 2-39) y el número de biopsias repetidas necesarias para detectarlo, entre 1 y 4 (media: 1,33). Siguiendo criterios clínicos y analíticos, en 29 casos (23,2%) no se realizó una segunda biopsia y en 9 casos (7%) el PIN-AG volvió a ser la única alteración en las biopsias posteriores. Es de señalar que el 1,4% de los cánceres de próstata diagnosticados en nuestro centro han tenido previamente una o más biopsias con PIN-AG como único hallazgo relevante. El número de focos tumorales y el total de milímetros de cáncer en este grupo de pacientes fue 1,8 focos (rango, 1-4) y 5,5 mm. (rango, 1-19). La distribución de los casos en función del Índice de Gleason fue: <6, 15 casos; 3+4, 4 casos; 4+3, 1 caso; >7, 0 casos).
Existe una buena correlación estadística entre el PIN-AG encontrado en la biopsia y varios parámetros histológicos en el cáncer subsiguiente que tienen que ver con el pronóstico de éste; así, el PIN-AG en la biopsia se correlaciona con los milímetros totales de cáncer (r=0,213, p=0,000), con el número de focos (r=0,219, p=0,003), con la afectación bilateral (r=0,139, p=0,024), con el Índice de Gleason (r=0,178, p=0,011) y con la invasión perineural (r=0,174, p=0,015). Además, se correlaciona con el estadio pT (r=0,184, p=0,010) en la prostatectomía radical en aquellos casos en los que se optó por este método terapéutico.
La edad media de los pacientes en el grupo de pacientes con ASAP fue de 68 años (rango, 54-87). La demora media entre el primer diagnóstico de ASAP y el hallazgo del cáncer fue de 12,7 meses (rango, 2-30), y el número de biopsias repetidas necesarias para detectarlo, entre 1 y 3 (media, 0,8). Siguiendo criterios clínicos y analíticos, en 16 casos (34,8%) no se realizó una segunda biopsia. No hubo ningún caso con dos diagnósticos consecutivos de ASAP. Asimismo, merece la pena señalar que el 0,82% de los cánceres de próstata han tenido previamente una biopsia con diagnóstico de ASAP. El número de focos tumorales y el total de milímetros de cáncer en este grupo de pacientes fue de 2 focos (rango 1-5) y 5 mm. (rango, 1-14). La distribución de los casos por el Índice de Gleason fue: <6, 9 casos; 3+4, 2 casos; 4+3, 0 casos; >7, 1 caso.
DISCUSIÓN
La profundización en el conocimiento de una neoplasia en un órgano cualquiera lleva necesariamente al planteamiento de neoplasia in situ en ese mismo órgano. Ocurrió en el cáncer de cérvix con el concepto de CIN y ocurre mucho más recientemente en el cáncer de páncreas con el de PaNIN. Por su parte, el PIN apareció y se desarrolló al albur del enorme crecimiento cualitativo y cuantitativo que tuvo el diagnóstico del cáncer de próstata en los años 90. Dicho concepto se estructuró en base a una serie de hallazgos histológicos que dieron lugar a 3 grados de PIN. Pronto se vio que solamente el PIN-AG estaba relacionado con el cáncer, describiéndose a continuación varios patrones histológicos (18) que son hoy en día perfectamente conocidos por todos los patólogos. A pesar de ello, la distinción entre PIN-AG y cáncer puede ser complicada en cilindros biopsia en donde el material escasea (fig. 1). Otro diagnóstico diferencial complicado se produce en entre el PIN-AG y el cáncer con patrón de crecimiento intraductal (fig. 2) debido a que éste último suele presentar patrones micropapilares o cribiformes en todo semejantes al PIN-AG.
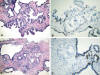
Fig. 1: PIN
de alto grado de morfología micropapilar (A, hematoxilina/eosina, x250) que
muestra tinción basal discontinua con queratinas (B, CK 5,6, x250) y foco
diminuto de carcinoma (C, hematoxilina/eosina, x250) con ausencia de tinción
basal para queratinas (D, 34‚E12, x250) en biopsias transrectales.
![]()
Fig. 2: Patrón
de crecimiento micropapilar y cribiforme en el cáncer de próstata de patrón
intraductal (hematoxilina/eosina, x100 y x250).
¿En que medida están relacionados el PIN-AG y el cáncer de próstata?, ¿qué trascendencia clínica tiene el hallazgo aislado de PIN-AG en una biopsia transrectal?, ¿qué posibilidades hay de encontrar cáncer de próstata en las biopsias repetidas?, ¿qué actitud debe tomar el urólogo ante un diagnóstico de PIN-AG?, son sólo alguna de las preguntas que aparecieron y sobre las que se ha escrito tal cantidad de literatura que en la práctica resulta imposible abarcarla toda.
El análisis de los trabajos más consistentes publicados al respecto en los últimos años arroja resultados diversos, a veces contradictorios (3,7,9-11). Por ejemplo, mientras Bishara y cols (3) y Herawi y cols (4) demuestran en trabajos recientes la existencia de cáncer de próstata en la rebiopsia post-PIN-AG respectivamente en el 28,8% y 30,5% de los casos, Roscigno y cols (7) lo hace en el 45% y Zlotta y cols (20) llega incluso hasta el 100%. Por otro lado, Kamoi y cols (6) y O’dowd y cols (21), y Langer y cols (22) encuentran cifras menores, en torno al 22%. Al igual que ocurre en nuestra serie, algunos autores (9) muestran una menor probabilidad de encontrar cáncer en la rebiopsia tras un diagnóstico previo de PIN-AG que tras una biopsia negativa, lo cual pone en entredicho la supuesta importancia de este hallazgo y la conveniencia de realizar rebiopsia sistemática apoyándose sólo en la existencia de PIN-AG. Existen discrepancias incluso sobre la importancia que tiene el número de focos de PIN-AG encontrados en la probabilidad de encontrar cáncer en la rebiopsia. Por ejemplo, mientras que Roscigno y cols (7) detectan una mayor probabilidad en los casos con PIN-AG multifocal, Naya y cols (11) aseguran que el número de cilindros afectados por PIN-AG no predice la aparición de cáncer en biopsias posteriores.
Una vez decidido que un paciente concreto con diagnóstico previo de PIN-AG va a ser rebiopsiado, queda por determinar cuándo y de qué manera, y sobre esto tampoco existen criterios uniformes. Algunos recomiendan la rebiopsia sin lugar a dudas tras un periodo de no más de 6 meses (22) mientras que otros (7) la posponen hasta los 18 meses. En relación a cómo hacerlo, mientras Kamoi y cols (6) proponen la realización de biopsias ipsilaterales respecto del lugar en donde se detectó previamente el PIN-AG, otros (7,8,22) propugnan la rebiopsia bilateral por sextantes, o incluso extendida a 12 cilindros, al haber encontrado cáncer de próstata significativo también en el lado contralateral al PIN-AG previo.
En lo que respecta a la ASAP, la literatura ofrece opiniones paralelas a las referidas para el PIN-AG. ASAP es un término acuñado a la fuerza para referirse a aquellos casos que muestran hallazgos histológicos propios, aunque insuficientes, para diagnosticar con seguridad cáncer de próstata (fig. 3). La distinción entre carcinoma diminuto, o mínimamente expresado, y ASAP en biopsias transrectales es un dilema típico entre patólogos. Entre los hallazgos que inclinan la balanza hacia el lado del cáncer están: el patrón de crecimiento infiltrante, las mitosis, los nucleolos prominentes en al menos el 10% de las células, el agrandamiento nuclear, el hipercromatismo, las secreciones intraluminales basófilas, el hallazgo de PIN-AG concomitante, y la ausencia de atrofia (17), pero al final siempre existe un cierto grado de incertidumbre que cada patólogo maneja según su propia experiencia, y es muy difícil proporcionar reglas fijas.
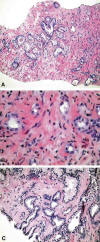
Fig. 3: Glándulas
atípicas sospechosas pero no totalmente diagnósticas de cáncer que caracterizan
a la ASAP (hematoxilina/eosina, x250 y x400).
Parece ser que la ASAP se relaciona más estrechamente con el cáncer en la rebiopsia que el PIN-AG (23). En nuestra experiencia, el 26,7% tuvieron cáncer en biopsias posteriores. La media de cáncer en la rebiopsia se sitúa en la literatura en torno al 40% (12-16). La probabilidad de tener cáncer en biopsias posteriores es tan grande ante un diagnóstico de ASAP que, según algunos autores (24), se podría proponer prostatectomía radical como tratamiento de elección de elección ante este diagnóstico.
Otros datos interesantes respecto de la ASAP son: que no existe diferencia en la edad ni en las cifras de PSA entre los casos con ASAP y los casos con cáncer en la biopsia inicial (13), ni entre los casos con ASAP y los que no tienen ninguna patología (12), que un diagnóstico de ASAP genera una demora media en el diagnóstico de cáncer posterior de más de 6 meses, sin que ello repercuta en el curso clínico de éste (25), y que parece existir una mayor probabilidad de cáncer de próstata cuando coexisten PIN-AG y ASAP en la misma biopsia (15,26).
Debido al alto índice de cáncer de próstata subsiguiente, ante un diagnóstico de ASAP se aconseja realizar rebiopsia siempre (12,16), añadiendo a la biopsia normal por sextantes, la biopsia de la zona transicional (14).
CONCLUSIONES
Aunque existen datos contradictorios en la literatura, parece existir una cierta relación entre el descubrimiento de PIN-AG y de ASAP en una biopsia inicial y la aparición de cáncer de próstata en biopsias subsiguientes. La asociación de ambos hallazgos acrecienta las posibilidades. La solidez de dichas afirmaciones descansa en varios aspectos que merece la pena mencionar y que son muy difíciles de homogeneizar, por ejemplo, la rigurosidad de los criterios clínicos que llevan a un paciente a la biopsia, el número de biopsias obtenidas y el protocolo de punción obtenido, y el rigor a la hora de aplicar los criterios histológicos tanto de PIN-AG como de ASAP, entre otros. Los diversos autores que han tratado el tema tampoco se ponen de acuerdo en cómo actuar ante cualquiera de estos diagnósticos, quedando este importante aspecto en manos del juicio clínico del urólogo.
BIBLIOGRAFÍA
Oyasu R, Bahnson RR, Nowels K, y cols. Cytological atypia in the prostate gland: frequency, distribution, and posible relevante to carcinoma. J Urol 1986; 135: 959-962.
Sakr WA, Grignon DJ, Haas GP, y cols. Epidemiology of high-grade prostatic intraepithelial neoplasia. Pathol Res Pract 1995; 191: 838-41.
Bishara T, Ramnani DM, Epstein JI. High-grade prostatic intraepithelial neoplasia on needle biopsy: risk of cancer on repeat biopsy related to number of involved cores and morphological pattern. Am J Surg Pathol 2004; 28: 629-33.
Herawi M, Kahane H, Cavallo C, y cols. Risk of prostate cancer on re-biopsy following a diagnosis of high-grade prostatic intraepithelial neoplasia (HGPIN) is related to the number of cores sampled. J Urol 2006; 175: 121-4.
Davidson D, Bostwick DG, Qian J, y cols. Prostatic intraepithelial neoplasia is a risk factor for adenocarcinoma: predictive accuracy in needle biopsies J Urol 1995; 154: 1295-1299.
Kamoi K, Troncoso P, Babaian RJ. Strategy for repeat biopsy in patients with high grade prostatic intraepithelial neoplasia. J Urol 2000; 163: 819-23.
Roscigno M, Scattoni V, Freschi M, y cols. Monofocal and plurifocal high-grade prostatic intraepithelial neoplasia on extended prostate biopsies: factors predicting cancer detection on extended repeat biopsy. Urology 2004; 63: 1105-10.
Netto GJ, Epstein JI. Widespread high-grade prostatic intraepithelial neoplasia on prostatic needle biopsy: a significant likelihood of subsequently diagnosed adenocarcinoma. Am J Surg Pathol 2006; 30: 1184-8.
Gokden N, Roehl KA, Catalona WJ, y cols. High-grade prostatic intraepithelial neoplasia in needle biopsy as risk factor for detection of adenocarcinoma: current level of risk in screening population. Urology 2005; 65: 538-42.
Kronz JD, Allan CH, Shaikh AA y cols. Predicting cancer following a diagnosis of high-grade prostatic intraepithelial neoplasia on needle biopsy: data on men with more than one follow-up biopsy. Am J Surg Pathol 2001; 25: 1079-85.
Naya Y, Ayala AG, Tamboli P, y cols. Can the number of cores with high-grade prostatic intraepithelial neoplasia predict cancer in men who undergo repeat biopsy? Urology 2004; 63: 503-8.
Mallen E, Gil P, Sancho C, y cols. Atypical small acinar proliferation. Review of a series of 64 patients. Scand J Urol Nephrol 2006; 40: 272-5.
Iczkowski KA, Chen HM, Yang XJ, y cols. Prostate cancer diagnosed after initial biopsy with atypical small acinar proliferation suspicious for malignancy is similar to cancer found on initial biopsy. Urology 2002; 60: 851-4.
Borboroglou PG, Sur RL, Roberts JL, y cols. Repeat biopsy strategy in patients with atypical small acinar proliferation or high grade prostatic intraepithelial neoplasia on initial prostate needle biopsy.J Urol 2001; 166: 866-70.
Scattoni V, Roscigno M, Freschi M, y cols. Predictors of prostate cancer after initial diagnosis of atypical small acinar proliferation at 10 to 12 core biopsies. Urology 2005; 66: 1043-7.
Epstein JI, Herawi M. Prostate needle biopsies containing prostatic intraepithelial neoplasia or atypical foci suspicious for carcinoma: implications for patient care. J Urol 2006; 175: 820-4.
Iczkowski KA, Bostwick DG. Criteria for biopsy diagnosis of minimal volume prostatic adenocarcinoma: analytic comparisosn with non-diagnostic but suspicious atypical small acinar proliferation. Arch Pathol Lab Med 2000; 124: 98-107.
Young RH, Srigley JR, Amin MB y cols. Tumors of the prostate gland, seminal vesicles, male urethra, and penis. Atlas oof Tumor Pathology, Third Series, Fascicle 28. Washington DC: AFIP; 2000. 69-109.
Argani P, Epstein JI. Inverted (hobnail) high-grade prostatic intraepithelial neoplasia (PIN): report of 15 cases of a previously undescribed pattern of high-grade PIN. Am J Surg Pathol 2001; 25: 1534-9.
Zlotta AR, Raviv G, Schulman CC y cols. Clinical prognostic criteria for later diagnosis of prostate carcinoma in patients with initial isolated prostatic intraepithelial neoplasia. Eur Urol 1996; 30: 249-55.
O’dowd GJ, Miller MC, Orozco R, y cols. Analysis of repeated biopsy results within 1 year after a noncancer diagnosis. Urology 2000; 55: 553-9.
Langer JE, Rovner ES, Coleman BG, y cols. Strategy for repeat biopsy of patients with prostatic intraepithelial neoplasia detected by prostate needle biopsy. J Urol 1996; 155: 228-31.
Ouyang RC, Kenwright DN, Nacey JN, y cols. The presence of atypical small acinar proliferation in prostate needle biopsy is predictive of carcinoma on subsequent biopsy. BJU Int 2001; 87: 70-4.
Brausi M, Castagnetti G, Dotti A, y cols. Immediate radical prostatectomy in patients with atypical small acinar proliferation. Over treatment? J Urol 2004; 172: 906-8.
Fadare O, Wang S, Mariappan MR. Practice patterns of clinicians following isolated diagnoses of atypical small acinar proliferation on prostate biopsy specimens. Arch Pathol Lab Med 2004; 128: 557-60.
Schlesinger C, Bostwick DG, Iczkowski KA. High-grade prostatic intraepithelial neoplasia and atypical small acinar proliferation: predictive value for cancer in current practice. Am J Surg Pathol 2005; 29: 1201-7.