
Vol. 41, n.º 1, 2008
REVISTA
ESPAÑOLA DE
Vol. 41, n.º 1, 2008 |
CASUÍSTICA
Walter Marcial Martínez Rodríguez1, Aurora Velásquez Martínez2, Magali Rodríguez Concepción1, Olga Forteza Trujillo3, Mayda Martínez Rodríguez4, Raúl Rúa Martínez5, Ana Gloria Pérez Reyes6
Hospital Universitario «Dr. León Cuervo Rubio»,
Pinar del Río, Cuba.
1 Especialista de 2.º grado en Anatomía Patológica, Profesor
Asistente, J. del Servicio de Patología del Hospital Universitario «Dr. León
Cuervo Rubio».
2 Especialista de 1.er grado en Cirugía Máxilo Facial.
3 Especialista de 1.er grado en Anatomía Patológica.
4 Especialista de 1.er grado en Gineceo Obstetricia.
5 Médico Residente.
6 Citotécnica, responsable de la consulta de PAAF del centro.
RESUMEN
Se presenta un caso de Branquioma Maligno. N. B. M., de 52 años, masculino, blanco, B-1224.06, que acude a consulta por presentar nódulo en la región lateral derecha del cuello de 4 x 3 cms, por delante del esternocleidomastoideo, por debajo del ángulo de la mandíbula, bien delimitada, redondeada, no dolorosa, no fija a los planos profundos, blanda, renitente, diagnosticada clínicamente como quiste branquial; en la toma de la muestra se confirma el carácter quístico de la lesión; el material es untuoso pero no característico de quiste branquial.
La muestra de la PAAF estaba constituida microscópicamente por células en fibra, células en renacuajo, células poligonales, y células naranjófilas; las células presentaban anisonucleosis, macronucleosis, pérdida de la relación núcleo citoplasma, distribución irregular de la cromatina, marginación periférica de la cromatina, cromatina en gránulos groseros y queratinización individual. Se diagnosticó como: Compatible con Branquioma maligno, se requiere biopsia exerética para confirmación diagnóstica definitiva. Se plantea que el primer diagnóstico diferencial debe hacerse con las metástasis de carcinoma en ganglios de la región lateral del cuello, en especial de un primario situado en amígdalas o base de lengua, que puede ser tan pequeño que pudiera ser detectado solo por biopsias a ciegas del lecho amigdalino. Se exponen los Criterios de Martin H2, modificados por Khafif RA3, de Certeza de Branquioma maligno: 1) localización del tumor en la región anatómica donde se originan los quistes branquiales, 2) aspecto histológico del tumor compatible con su origen en restos branquiales, 3) Supervivencia no menor de 5 años, posterior al diagnóstico, sin que se identifique un tumor primario en exámenes periódicos, 4) Presencia de carcinoma en la pared de un quiste epitelial identificable, 5) Identificar una zona de transición entre el epitelio escamoso normal del quiste y el carcinoma, 6) Ausencia de tumor maligno primario, de otra localización, después de una exhaustiva evaluación del paciente
Palabras claves: Branquioma maligno, Carcinoma Branquiogénico, Carcinoma en quiste branquial.
SUMMARY
Introduction: The hypothesis that some malignant lesions from the lateral region of the neck could develop from branchial clefts was proposed in 1882 by Von Volkman. Martin H. et al. defined malignant tumours originating from vestigial remmanants of this structures. Many of them are epithelial as branchiogenic carcinoma However, they precise that these tumors must be called malignant branchiomas because they can also originate from the conective tissue of the cystic wall. Method: A case of malignant branchioma in a 52 years old, white male is reported. The patient presented a latero-cervical cyst. Fine Needle Aspiration Cytology (FNAC) and an excisional biopsy were performed. Samples were stained with hematoxylin and eosin and Masson’s Trichrome. Results: A dignosis of consistent with malignant branchioma based on Martin H s criteria modified by Khafif RA was made. An other possible primary tumor was not found at any location. In this way, the diagnosis of malignant branchioma was confirmed. At the present time, the patient is free of disease and without evidence of other primary tumor of nasopharynx or elsewhere. An analytic review of the literature was made.
Key words: Malignant branchioma, branchiogenic carcinoma, branchial cyst.
INTRODUCCIÓN
Ha pasado algún tiempo ya desde que en el 1882, Von Volkmann (1) propusiera la hipótesis de que algunas lesiones malignas de la región lateral de cuello podían originarse de remanentes de las hendiduras branquiales. El autor presentó tres pacientes con carcinomas en la parte superior del cuello y no encontró primario después de revisar minuciosamente la cavidad oral y la faringe. Martín H et al (2), lo definen aquellos tumores malignos que se originan en remanentes vestigiales de las hendiduras branquiales, la mayoría de las cuales son epiteliales y por eso los designan como carcinoma branquiogénico, aunque pudiera ser más específico el nombre de branquioma maligno, ya que teóricamente también el tejido conectivo de la pared de los restos de las hendiduras branquiales puede dar origen a una neoplasia.
En los albores del pasado siglo el branquioma maligno recibió amplia aceptación, pero a partir de los 50 ha sido objeto de controversia y vigorosa discusión por parte de los autores, muchos de los cuales ponen en tela de juicio de bona fide neoplasia malignas a punto de partida de restos de las hendiduras branquiales; considerando que en realidad la mayoría de los casos publicados corresponden a metástasis quísticas de un carcinoma epidermoide oculto de la orofaringe, de tal manera que hasta el 89, de los 67 casos reportados en la literatura (3), solo 10 presentan evidencia indiscutible de corresponder a verdaderos branquiomas malignos de acuerdo con los criterios de Martín, H (2). En esta revisión, Khafif RA, Prichep R, y Minkowitz S (3); presentan los criterios, modificados de Martín; que según ellos, debe reunir un tumor para que sea considerado como un auténtico branquioma maligno: 1) localización del tumor en la región anatómica donde se originan los quistes branquiales, 2) aspecto histológico del tumor compatible con su origen en restos branquiales, 3) Supervivencia no menor de 5 años, posterior al diagnóstico, sin que se identifique un tumor primario en exámenes periódicos, 4) Presencia de carcinoma en la pared de un quiste epitelial identificable, 5) Identificar una zona de transición entre el epitelio escamoso normal del quiste y el carcinoma, 6) Ausencia de tumor maligno primario, de otra localización, después de una exhaustiva evaluación del paciente (tabla 1). Por lo tanto, estos autores plantean que su incidencia no es tan alta como se supone, no existiendo hasta el 94 más de 30 casos. Por su interés, hemos querido presentar nuestro caso y hacer una breve revisión de este tema, que ha sido objeto de tanta controversia.

Se presenta un caso de carcinoma branquiogénico atendido en la consulta de punción aspirativa con aguja fina (PAAF ), del Servicio de Patología del hospital universitario «León Cuervo Rubio», de la provincia de Pinar del Río, Cuba; remitido por el Servicio de Cirugía Máxilo Facial, del centro; por presentar, nódulo cervical.
CASO CLÍNICO
Paciente de 52 años, masculino, blanco, que acude a consulta por presentar nódulo en la región lateral derecha del cuello de 4 x 3 cm, por delante del esternocleidomastoideo, por debajo del ángulo de la mandíbula, bien delimitada, redondeada, no dolorosa, no fija a los planos profundos, blanda, renitente, diagnosticada clínicamente como quiste branquial; en la toma de la muestra se confirma el carácter quístico de la lesión; el material es untuoso pero no característico de quiste branquial.
La muestra de la PAAF estaba constituida microscópicamente por células en fibra, células en renacuajo, células poligonales, y células naranjófilas; las células presentaban anisonucleosis, macronucleosis, pérdida de la relación núcleo citoplasma, distribución irregular de la cromatina, marginación periférica de la cromatina, cromatina en gránulos groseros y queratinización individual. Se diagnosticó como: Compatible con Branquioma maligno, se requiere biopsia exerética para confirmación diagnóstica definitiva.
La macroscopía consiste en una formación quística redondeada, al corte se comprueba una cavidad central y un material que no recuerda al material blanco nacarado, untuoso, aséptico, de las escamas de queratina acumuladas en la luz del quiste branquial; por el contrario el material es necrótico sanguinolento, la pared del quiste medía aproximadamente 3 mm., y de consistencia fibrosa periférica, el revestimiento interior no era blanco nacarado con el revestimiento del quiste branquial sino grisáceo, la consistencia general era leñosa.
Microscópicamente, se confirma todo lo señalado anteriormente, tanto en la PAAF, como en el examen macroscópico, el revestimiento interior era en todos los cortes un carcinoma epidermoide, verrugoso, queratinizante, e invasor (figs. 1 a 4) ; no se encontró epitelio normal de revestimiento de los quistes branquiales, no existían por lo tanto zonas de transición, por debajo del epitelio tumoral se encontró tejido linfoide con verdaderos centros germinales; por fuera existía una pared constituida por tejido fibroso, densamente colagenizada, confirmado lo anterior con tricrómica de Masson contrastada con azul de anilina. Se corroboró el diagnóstico de la PAAF y se aconsejo descartar la posibilidad de que el caso, a pesar de simular, perfectamente un branquioma maligno; fuera realmente una metástasis de un carcinoma en ganglios de la región lateral del cuello y se propuso una investigación profunda otorrinolaringológica, con énfasis especial en amígdalas y base de la lengua. Evolutivamente, los cirujanos máxilo faciales que atienden el paciente no pudieron encontrar primario de otra localización y confían de que se trata de un auténtico branquioma maligno.

Fig. 1: A.
Vista a menor aumento de la pared del quiste donde se puede observar su
arquitectura y su disposición en capas, con un revestimiento interior
constituido por un epitelio plano estratificado y, en este caso queratinizado;
exteriormente, se aprecia una pared constituida eminentemente por tejido fibroso
densamente colagenizado. TMx30 B. Detalle a mediano aumento donde puede
apreciarse en la parte superior la presencia de células sueltas, reflejo de la
pérdida de cohesividad, entremezcladas con restos celulares y sangre, que
presentan discariosis, con anisonucleosis, pérdida de la relación núcleo
citoplasma, gigantismo nuclear, hipercromatismo, borde nuclear irregular,
angulaciones agudas del borde nuclear, distribución de la cromatina en grumos
gruesos e irregulares y marcada condensación del citoplasma, algunas de ellas,
pudiéndose catalogar de células naranjófilas o diferenciadas de tercer orden.
HEx200.
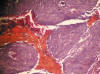
Fig. 2: A
mediano aumento, se observa el patrón papilomatoso del epitelio tumoral, en el
centro las células queratinizadas, destacan por su especial tonalidad
naranjófila. TMx10.
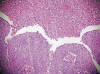
Fig. 3: Detalle
a pequeño aumento donde puede apreciarse en la parte superior la presencia de
células sueltas, reflejo de la pérdida de cohesividad, entremezcladas con restos
celulares y sangre, que presentan discariosis, con anisonucleosis, pérdida de la
relación núcleo citoplasma, gigantismo nuclear, hipercromatismo, borde nuclear
irregular, angulaciones agudas del borde nuclear, distribución de la cromatina
en grumos gruesos e irregulares y marcada condensación del citoplasma, algunas
de ellas, pudiéndose catalogar de células naranjófilas o diferenciadas de tercer
orden. HEx200.
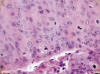
Fig. 4: A
mayor aumento puede apreciarse, con mayor detalle la marcada anaplasia del
epitelio escamoso carcinomatoso con presencia, cerca del borde inferior, de
mitosis tripolares. HEx400.
DISCUSIÓN
La obliteración incompleta de cualquier resto embrionario, de cualquier localización anatómica, puede dar lugar a senos, fístulas, o quistes branquiales. Los restos de las hendiduras branquiales pueden estar revestidas por epitelio plano estratificado no queratinizado, epitelio cilíndrico simple ciliado seudoestratificado con células caliciformes, cúbico alto, cúbico o una mezcla de ellos, en la pared encontramos tejido linfoide con verdadera formación de centros germinales (3,4). Los quistes branquiales fueron descritos por primera vez en 1789 por Hunczowski (5). En el 1949, Chionh EH y Pham VH, et al (5); revisaron 61 casos en un período de 15 años, reportando una mayor incidencia entre los 10 y los 40 años de edad, que se localizan más comúnmente por debajo del ángulo inferior de la mandíbula. En el mismo año King ESJ (6), observó la frecuencia de aparición de tejido linfoide en la pared del quiste, y que el revestimiento interior era mayoritariamente epitelio escamoso, por lo que los llamó quistes laterales linfoepiteliales del cuello. Titchener GW, y Allison RS, en el 1989 (7), revisan 42 casos de quistes cervicales laterales, la mayoría de ellos se presentaban como masa dolorosas la mayor parte en el sitio clásico de localización y todos ellos en personas mayores de 10 años.
No fue hasta el 1882, en que Von Volkmann (1), sugirió que algunos tumores malignos de la región lateral del cuello pudieran originarse en quistes branquiales. James Ewing en el 1919 admitió que no existía un patrón histológico característico de branquioma maligno y pensaba que estas lesiones eran realmente metástasis en ganglios de primario desconocido (2). Martín H, Morfit HM, y Erlich H; en el 1950, revisan entre 225 a 250 casos reportados hasta esa fecha, muchos de ellos, descritos de manera vaga e incierta, de los cuales no más de tres reunían criterios precisos para ser considerados como verdaderos carcinomas originados en vestigios de las hendiduras branquiales (2). En 1961, Stackpole RH y Pearce JM, reportan 2 casos de branquioma maligno que reúnen los criterios de Martín (8). En el 1968, Katubig C y Damjanov I (9); publican un caso fallecido, de 59 años, con un nódulo en la cara lateral izquierda del cuello, por debajo del esternocleidomastoideo, a 5 cm por debajo del ángulo de la mandíbula, que correspondía con un carcinoma espinocelular originado en un quiste branquial, con extensión local, y metástasis a hígado; sin embargo, no reunía todos los criterios de Martín. En el 1976, Bernstein A, et al (11); reportan un caso de 54 años, se descartó la posibilidad de un tumor primario de otra localización, se encontró metástasis en uno de los 19 ganglios examinados; lo autores recomiendan la radical de cuello en aquellos casos en que el carcinoma se extiende por fuera de la pared del quiste. En el 1989, Khafif RA, Prichep R, Minkowitz S (3); publican una extensa revisión de los casos de branquioma maligno reportados en la literatura, encontrando 67 casos, de los cuales, descartaron 41 por no reunir los criterios de Martín, los 26 casos considerados auténticos, fueron más frecuentes en el sexo masculino en relación de 3,6/1, con un rango de edad de 38 a 71 años. En el mismo año, Swoboda H, y Braun O (12); reportan 8 casos; en 4 de ellos apareció posteriormente un carcinoma de amígdala ipsilateral y 2 de ellos, amigdalectomizados, desarrollaron subsecuentemente carcinomas en el espacio parafaringeo en la base de la lengua, considerando la posibilidad de carcinoma sincrónico o metacrónico. Foss RD, Clark WB, y Morton AL, en el 1991 (13), presentan un paciente de 58 años, con un nódulo yugulodigástrico izquierdo quístico por tomografía axial computarizada (TAC), sin evidencias de primario en otra localización; en el que a pesar de estar amigdalectomizado, se le practicaron biopsias seriadas de las fosas amigdalinas, encontrando un foco de carcinoma espinocelular en la fosa amigdalina izquierda. Por su parte, Bath AP, Murty GE, y Bradley PJ (14); en su artículo, recomiendan como evaluación preoperatorio el estudio minucioso otorrinolaringológico con amigdalectomía ipsilateral y biopsias a ciegas del anillo de Waldeyer con cirugía exerética del nódulo cervical.
El diagnóstico diferencial debe hacerse principalmente con las metástasis de carcinoma en ganglio. Micheau C, et al (15,16); han revisado 21 pacientes, en dos publicaciones, los cuales fueron catalogados inicialmente como genuinos branquiomas malignos, comprobándose posteriormente, que todos sin excepción, eran metástasis quísticas de carcinomas epidermoides, primitivos de la amígdala o de basa de la lengua; presentaban entre 25 y 76 años, plantea que en ocasiones, el tumor ubicado en el anillo de Waldeyer puede ser tan pequeño que resulte difícil o imposible detectarlo por los métodos convencionales, opina que cuando se estudian los casos minuciosamente, se demuestra que el branquioma maligno genuino es muy poco frecuente. Para Batsakis JG (17), representa solo el 0,3% de los tumores supraclaviculares.
El tumor debe ser tratado con disección radical de cuello. La radioterapia se ha empleado como coadyuvante postoperatorio, generalmente para destruir focos microscópicos de tumor en el lecho quirúrgico; sin embargo, algunos prefieren emplearla, solo cuando ocurre una recidiva. Esta conducta parece adecuada, en razón de la naturaleza localmente agresiva del tumor y la radiosensibilidad del carcinoma epidermoide.
El tumor de nuestro paciente estaba localizado en la región anatómica donde usualmente se originan los quistes branquiales e incluso se comportaba como él; presentaba un carcinoma epidermoide invasor queratinizante, el aspecto histológico del tumor era compatible con su origen en restos branquiales; sin embargo, a pesar de los múltiples cortes seriados practicados al tumor, no se pudo identificar epitelio normal, ni mucho menos zona de transición; por lo cual se consideró prudente sugerir la posibilidad de que, a pesar de la similitud de la lesión con un quiste branquial en el cual, a punto de partida de su epitelio de revestimiento interno se originara un carcinoma epidermoide; debía valorarse la posibilidad de que en realidad estuviéramos en presencia de una metástasis de carcinoma en ganglio simulando un branquioma maligno; por lo que debía revisarse más exhaustivamente, desde el punto de vista clínico y dirigiendo la investigación hacia la posibilidad de la existencia de un carcinoma oculto de amígdala o de base de la lengua. A pesar de que hasta el momento que estamos escribiendo este artículo al paciente no se la ha encontrado ningún primario; es muy temprano para decir que no lo tenía pues, sólo tiene 4 meses de evolución postoperatoria.
BIBLIOGRAFÍA
Volkmann R. Das Tiene Branchiogenir HalsKarcinoma. Zentralbl Chir 1882; 9: 49-63.
Martin H, Morfit HM, Herlich H. The case for Branchiogenic Cancer (Malignant Branchioma). Ann Surg 1950; 132: 867-87.
Khafif RA, Prichep R, Minkowitz S. Primary Branchiogenic Carcinoma. Head & Nead 1989; 11: 153-63.
Park S, Collin SK. The First Branchial Cleft Carcinoma. Arch Otolaryngol Head Neck Surg 1992; 118: 969-71.
Chionh EH, Pham VH, Cooke RA, Gough IR. Aetiology of Branchial Cysts. Aust N Z J Surg. 1989; 59: 949-51.
King ESJ. The Lateral Lympho-epithelial Cyst of the Neck (Branchial Cyst).Aust NZJ Surg 1949; 19: 109-21.
Titchener GW, Allison RS. Lateral Cervical Cyst: A review of 42 cases. NZ Med J 1989; 102: 536-37.
Stackpole RH, Pearce JM. Branchial Cleft Carcinoma. Arch of Surg 1961; 82: 347-52.
Katubig C, Damjanov I. Branchial Cleft Carcinoma. Arch Otolaryngol 1969; 89: 92-3.
Benísh BM, Soom ML. Branchial Cleft Carcinoma. Arch Otolaryngol 1973; 98: 208-9.
Bernstein A, Scardino PT, Tomaszewski MM, Cohen MH. Carcinoma Arising in a Branchial Cleft Cyst. Cancer 1976; 37: 2417-22.
Swoboda H, Braun O. Die Branchiogene Zyste im Onkologischen Zusammenhang. Laryngo-Rhino-Otol 1989; 68: 337-41.
Foss RD, Clark WB, Morton AL. Malignant Cyst of the lateral Aspect of the Neck Branchiql Cleft Carcinoma or Metastasis? Oral Surg Oral Med Oral Pathol 1991; 71: 214-7.
Bath AP, Murty GE, Bradley PJ, Branchial Cyst.-to endoscope or not? J Laryngol Otol 1992; 106: 1006-7.
Micheu C, Cachin Y, Cailou B. Cystic Metastasis in the neck revealing occult carcinoma of the tonsil. Cancer 1974; 33: 228-33.
Micheu C, Klijanienko J, Luboinski B, Richard J. So called Branchiogenic Carcinoma is actually cystic metastases in the neck from tonsillar primary. Laryngoscope 1990; 100: 878-83.
Batsakis JG. Metastatic Neoplasms to and from the Head and Neck. Batsakis JG, editor. En: Tumors of Head and Neck. Baltimore: Williams and Wilkins; 1979. p. 224-45.