
Vol. 41, n.º 2, 2008
REVISTA
ESPAÑOLA DE
Vol. 41, n.º 2, 2008 |
ORIGINALES
Felip García1, Xavier Andreu2, Jordi Esquius3, Josefina Autonell4, Montserrat Castro5, Ignaci Roig6, Vicente Marco1
1 Servicios de
Anatomía Patológica de Capio Hospital General de Catalunya de Sant Cugat del
Vallés. Barcelona.
2 Corporació Parc Taulí de Sabadell. Barcelona.
3 Hospital General de Granollers. Barcelona.
4 Hospital General de Vic. Barcelona.
5 Hospital Residencia Sant Camil de Vilanova i la Geltrú. Barcelona.
6 Hospital de Terrassa. Barcelona.
fgarcia@hgc.es
RESUMEN
Introducción: La definición exacta del carcinoma microinvasivo de mama sigue siendo problemática, y su comportamiento clínico incierto. Hemos estudiado de forma retrospectiva 38 casos con el diagnostico de carcinoma microinvasivo realizado en diversas instituciones, según los criterios de Silver y Tavassoli. Material y métodos: Describimos las características clinicopatológicas y la reproducibilidad del diagnostico de microinvasion, siguiendo los criterios predeterminados. También estudiamos el valor de la p63 y de la calponina, para establecer la integridad de la capa mioepitelial. Resultados: Los casos fueron revisados por dos de los autores (FG, VM) y reclasificados como carcinoma microinvasivo en 18 casos (47%), microinvasión dudosa, 1 caso, carcinoma ductal in situ (DCIS) con el pseudoinvasión, 11 casos (28,9%), y carcinoma ductal invasor pT1a y pT1b en 8 casos (21,6%). El tamaño del DCIS asociado varió entre 7 y 80 mm. En once casos solo había un foco de microinvasión, los otros casos demostraron dos o tres focos de microinvasión. Dos casos mostraron invasión vascular como la única evidencia del microinvasión. El estudio immunohistoquímico con la calponina y la p63 fue útil en la diagnosis en el 50% de los casos. La axila se extirpó en 15 casos, con un solo ganglio positivo (6,6%). El seguimiento ha oscilado entre 3-120 meses (promedio de 42 meses) con sólo una recidiva local sobre la cicatriz por CDIS a los 9 meses. Conclusiones: El sobrediagnóstico histológico es uno de los problemas de esta entidad. Unos criterios morfológicos estrictos y el uso de la inmunohistoquímica es útil en el diagnóstico diferencial con el CDIS y el carcinoma ductal infiltrante. La incidencia de las recurrencias locales y la metástasis ganglionar son bajas y usualmente se asocian a CDIS de alto grado con necrosis. La extirpación del ganglio centinela puede estar indicada en casos de CDIS con microinvasión.
Palabras clave: Carcinoma de mama, carcinoma microinvasivo, carcinoma ductal in situ, correlación clinicopatológica.
SUMMARY
Introduction: The exact definition of microinvasive breast carcinoma remains problematic, and its clinical behavior is uncertain. We have studied retrospectively 38 cases with the diagnosis of microinvasive carcinoma made in different institutions, according to the criteria of Silver and Tavassoli. Material and Methods: We describe the clinico-pathologic characteristics and the reproducibility of the diagnosis of microinvasion, following predetermined criteria. We also study the value of immunohistochemical stains with p63 and calponin, to establish the integrity of the myoepithelial layer. Results: The cases were reviewed by two of the authors (FG, VM) and reclassified as microinvasive carcinoma, 18 cases (47%), doubtful microinvasion, 1 case, ductal carcinoma in situ (DCIS) with pseudoinvasion, 11 cases (28.9%), and invasive ductal carcinoma pT1a and pT1b, 8 cases (21.6%).The size of the associated DCIS varied between 7 and 80 mms. In eleven cases one single focus of microinvasion was found, the other cases showed two or three foci of microinvasion. Two cases showed angiolymphatic invasion, as the only evidence of microinvasion. Immunohistochemistry with calponin and p63 was helpful in the diagnosis of microinvasion in 50% of the cases. Axillary lymph nodes were obtained in 15 cases, and a single positive lymph node was found. One patient recurred as DCIS in the surgical scar nine months after surgery. The other patients were disease free after a variable follow-up, between 3 and 120 months (average 42 months). Conclusions: Microinvasive breast carcinoma is often overdiagnosed histologically. The implementation of strict morphological criteria and the use of immunohistochemistry may be helpful in the differential diagnosis with DCIS and invasive ductal carcinoma. The incidence of local recurrence and lymph node metastases is low, and it is usually associated with the presence of high grade DCIS with necrosis. Sentinel lymph node biopsy may be indicated in cases of DCIS with microinvasion.
Keywords: Breast carcinoma, microinvasive carcinoma, ductal carcinoma in situ, clinicopathological profile.
INTRODUCCIÓN
La invasión del estroma mamario por células malignas permite que los tumores puedan metastatizar tanto por vía hematógena como linfática. Pero ¿existe un tamaño mínimo para que la lesión neoplásica infiltrativa tenga un significado clínico? A este tamaño se le denomina microinfiltración.
Se han propuesto varias definiciones de microinvasión. Entre ellas, dos utilizan como criterio de clasificación un tamaño tumoral concreto, como la propuesta por la American Joint Comité on Cancer (AJCC) que tomando un tamaño aleatorio la describe como la invasión del estroma por focos menores de 1 mm sin límite de número de focos T1mic (1); y la propuesta por Silver y Tavassoli (2) que sobre los modelos de angiogéneis tumoral descritos (3) toma como máximo un foco de 2 mm o hasta tres focos no mayores de 1 mm cada uno.
Los datos publicados hasta ahora nos dicen que el carcinoma de mama microinvasivo tiene un comportamiento clínico similar al carcinoma intraductal asociado por si solo, aunque esta conclusión no es todavía firme ya que las series publicadas o son cortas o carecen de homogeneidad para compararlas.
Los objetivos del presente trabajo son la descripción de las características clinicopatológicas de una serie de carcinomas microinfiltrantes, la valoración de la reproducibilidad de este diagnóstico entre patólogos según unos criterios preestablecidos, y la utilidad diagnóstica de la Calponina y la P63 como marcadores de mioepitelio.
MATERIAL Y MÉTODOS
Realizamos un estudio retrospectivo multicéntrico en 6 hospitales, seleccionando cada uno de los autores los casos de carcinoma microinvasivo, siguiendo la definición propuesta por Silver y Tavassoli, obteniendo 38 casos. De forma resumida, la definición de microinfiltración que utilizamos incluye aquellos carcinomas intraductales con un foco de invasión menor o igual a 2 mm o hasta tres focos de 1 mm cada uno. Los focos invasivos carecen de membrana basal, formando grupos o células sueltas afectando el estroma intralobulillar o extendiéndose más allá de él. Añadimos a esta definición, como criterio de microinfiltración, la invasión vascular, caracterizada por la presencia de células tumorales dentro de estructuras vasculares tapizadas por endotelio con hematíes y fibrina, observada en cortes teñidos con hematoxilina-eosina.
Posteriormente dos de los autores (VM, FG) revisaron nuevamente cada caso siguiendo los mismos criterios, clasificándolos como microinfiltrantes, no microinfiltrantes y dudosos.
Analizamos la edad de los pacientes, la forma de presentación clínica, su expresión radiológica, el tipo de carcinoma intraductal asociado (CID), el tamaño del CID, el tipo histológico del componente infiltrativo, el estado de los márgenes, la existencia de multifocalidad, el estado de la axila, los receptores hormonales, el tipo de tratamiento recibido y su evolución clínica.
Utilizamos la clasificación de Van Nuys como método de estratificación de alguno de estos datos (4), así el tamaño se distribuye como 1=<15 mm, 2=16-40 mm y 3=>40 mm. Respecto al margen en grado 1=>10 mm, 2=1-9 mm, y grado 3<1 mm.
Para valorar el grado nuclear también hemos seguido la clasificación de Scarff-Bloom modificada por Elston (5).
Estudiamos el valor del anticuerpo monoclonal de Calponina (clona CALP Dako Corporation) y de la P63 (Dako Corporation) en el diagnóstico de la microinvasión. Los estudios inmunohistoquímicos se han realizado en material parafinado mediante técnica estándar de Streptavidina-Biotina Peroxidasa.
Se ha valorado como positiva la tinción de citoplasma para la Calponina y nuclear para la P63 de las células localizadas en la porción basal de las estructuras neoplásicas, de forma continua o discontinua, e interpretadas como células mioepiteliales.
De forma esporádica se ha valorado la distribución vascular en el componente in situ mediante la inmunotinción con CD34 (Dako Corporation).
RESULTADOS
De los 38 casos revisados 18 (47,3%) correspondieron a carcinoma intraductal microinfiltrante (CID mic) (fig. 1) en la evaluación de consenso (VM-FG) incluyendo dos casos con invasión vascular como único criterio (fig. 2), 1 (2,63%) dudoso, 11 (28,9%) sin microinfiltración, y 8 (21,6%) a carcinomas infiltrantes (6 pT1a y 2 pT1b).
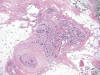
Fig. 1:
Carcinoma intraductal de alto grado con necrosis asociado a un foco de
microinfiltración (HE, 40x).
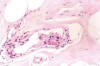
Fig. 2:
Grupo de células neoplásicas adheridas al
endotelio con fibrina interpretado como angioinvasión en un caso de carcinoma
intraductal de alto grado (HE. 200x).
El diagnóstico definitivo de los 11 casos en que no se observó una verdadera microinfiltración, fue de un caso de hiperplasia intraductal atípica (HDA) con afectación lobulillar, cuatro carcinomas intraductales con afectación lobulillar (fig. 3), tres lesiones esclerosantes tipo cicatriz radial o adenosis esclerosante (fig. 4) y tres cambios post-biopsia (fig. 5). Un caso se ha interpretado como dudoso porque mostraba una marcada reacción estromal inflamatoria periductal que dificultaba su interpretación, no siendo concluyente el estudio inmunohistoquímico (fig. 6).
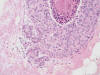
Fig. 3:
Carcinoma intraductal continuándose con estructuras ductolobulillares que pueden
simular microinfiltración, pero mantienen un patrón organoide (HE, 100x).
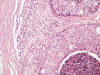
Fig. 4:
Grupo de estructuras glandulares con aspecto organoide adyacente a carcinoma
intraductal que simula microinfiltración (HE, 40x).
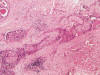
Fig. 5:
Artefacto secundario a biopsia con aguja con
desestructuración de conductos epiteliales por una proliferación fibroblástica
que mantiene una direccionalidad de la que puede deducirse su origen (HE, 40x).
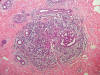
Fig. 6:
Marcada reacción estromal inflamatoria periductal que dificultaba su
interpretación (HE, 40x).
Presentación clínica
Los carcinomas microinfiltrantes afectaban a pacientes con una edad media de 56 a. (36-83 a). Once casos eran pacientes asintomáticas que se detectaron durante estudios radiológicos de cribado, seis casos se manifestaron como una lesión palpable y en uno se desconoce.
El patrón radiológico fue la presencia de microcalcificaciones en catorce casos, uno en forma de nódulo, un caso sin alteraciones y desconociéndose en los dos restantes.
Características histológicas (tabla 1)
Histológicamente el tipo de carcinoma intraductal asociado fue en siete casos de tipo sólido, en seis de tipo comedo, en cuatro cribiforme-micropapilar y en uno mixto.
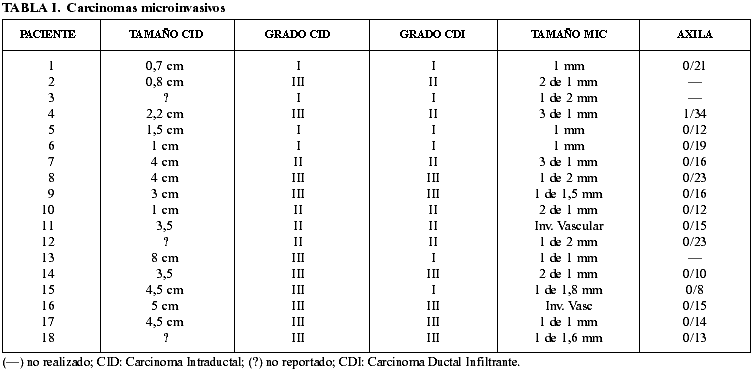
El tamaño del componente intraductal reportado en quince casos oscilaba entre 7-80 mm con una media de 33 mm (Van Nuys I:4; II:7 ; III:4).
El grado del componente intraductal se distribuía como GI en cuatro casos; GII en otros cuatro y GIII en diez.
Necrosis de tipo comedo se detectó en catorce casos.
El grado nuclear del componente infiltrante se distribuía en grado I (seis casos) grado II (seis casos) y grado III (seis casos). El tipo histológico de este componente predominaba el tipo ductal (NOS) (diecisiete casos), y uno de tipo mucinoso, similar a mucocele.
En el componente intraductal se detectaron focos múltiples en seis casos.
El n.º de focos de microinfiltración fue de 1 en once casos, de 2 en tres, de 3 en dos y en dos sólo se observó invasión vascular.
El estado de los márgenes está definido en diez casos. En seis el margen es mayor de 10 mm (Van Nuys 1) y en cuatro es menor de 1 mm (Van Nuys 3).
Estudios complementarios
La determinación de los receptores hormonales de estrógenos se había realizado en catorce casos, siendo en nueve positivos y cinco negativos.
El estudio inmunohistoquímico con Calponina y P63 se realizó en diez casos, siendo útil para el diagnóstico final en cinco casos (fig. 7 y 8) y en cinco no fue concluyente por haber desaparecido parcial o totalmente la zona problema en los nuevos cortes de todos ellos menos en uno en que la tinción fue difícil de valorar por su debilidad.
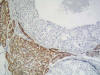
Fig. 7:
Calponina. Positividad citoplasmática de células mioepiteliales en grupos
irregulares de células ductales que permiten confirmar la infiltración
neoplásica de un foco de adenosis (HE, 100x).

Fig. 8:
P63. Positividad nuclear de células mioepiteliales en grupos irregulares de
células ductales que permiten descartar el carcinoma microinfiltrante (P63,
100x).
Es llamativa la distribución de los vasos marcados con CD34 que se sitúan en abundancia alrededor de las estructuras ductales afectas de carcinoma in situ, localizándose ya inmediatamente por debajo de la capa epitelial basal.
Tratamiento y evolución (tablas 1 y 2)
El tratamiento realizado en su conjunto (teniendo en cuenta uno o varios tiempos quirúrgicos) fue de cinco tumorectomías más vaciamiento axilar, diez mastectomías radicales modificadas, y tres mastectomías simples. A todos los casos tratados con cuadractectomía se les asoció radioterapia adyuvante.
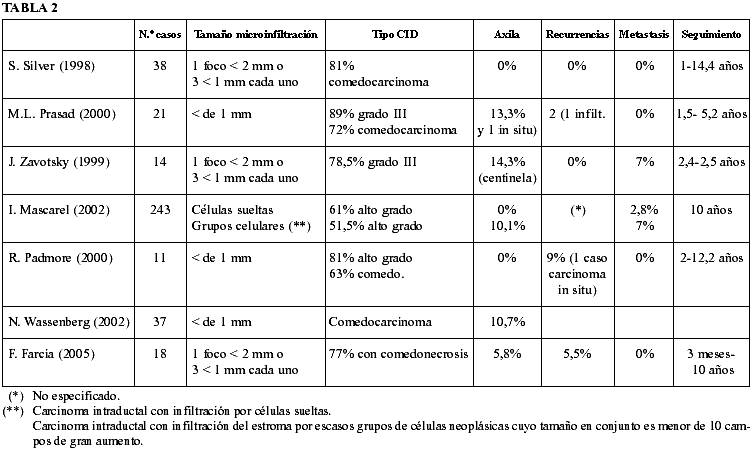
De los cuatro casos con márgenes Van Nuys 3 dos se trataron con mastectomía, uno con mastectomía y radioterapia y uno con radioterapia.
La resección axilar, realizada en quince casos, fue positiva en un caso (6,6%) con un ganglio positivo sobre treinta y cuatro extirpados. El número promedio de ganglios resecados en cada axila fue de 16 (8-34)
El seguimiento ha sido de entre 3-120 meses con una media de 42 meses.
Un caso (5,5%) tratado con tumorectomía y vaciamiento axilar asociado a radioterapia ha presentado recidiva local sobre la cicatriz en forma de carcinoma in situ a los nueve meses y tratada con mastectomía.
DISCUSIÓN
El carcinoma de mama intraductal plantea la paradoja terapéutica de que la cirugía puede ser curativa pero a expensas de ser más agresiva (mastectomía) que la indicada en tumores infiltrantes (cuadrantectomía). La cirugía conservadora produce, en estos casos, un número no desdeñable de recidivas locales (30%) y aproximadamente la mitad de ellas en forma de carcinoma infiltrante (6). La frecuencia global de metástasis axilares del carcinoma intraductal oscila entre el 0-4%, con una mortalidad del 1,8% a los 8 años. (7).
Uno de los parámetros que entorpecen el abordaje diagnóstico y terapéutico del carcinoma intraductal de mama es la dificultad de valorar la extensión real de la lesión, que junto con la afectación de los márgenes, el grado histológico y la edad, están claramente relacionados con la incidencia de recidiva local (8). Para solucionar este problema se han diseñado técnicas de manejo de la pieza quirúrgica (9) que ayudan a estimar, junto con los estudios por imagen (10), con bastante precisión, la extensión real de la lesión y por lo tanto a valorar mejor el estado de los márgenes. Esta mejora en el manejo junto a la práctica de radioterapia adyuvante en casos seleccionados ha hecho disminuir notablemente el número de recidivas locales (13%) (7).
Otra de las situaciones que plantea dudas a la hora de tomar una decisión terapéutica en este tipo de tumores es la coexistencia de microinvasión. Su presencia se asocia a una posible extensión a distancia planteando la pregunta de si se debe o no realizar vaciamiento axilar en esta situación, no existiendo de momento una actitud unánime al respecto. Un problema añadido es que no hay una única definición sobre lo que entendemos por microinfiltración en carcinoma de mama.
Se han propuesto varias definiciones. Todas tienen en común en definirla como la penetración de células tumorales más allá de la membrana basal de los conductos epiteliales. Donde hay disparidad de criterio es en valorar el tamaño tumoral para diferenciarla de la infiltración tumoral tipo pT1a según los parámetros del TNM. Nosotros hemos escogido la propuesta por Silver y Tavassoli (2). Esta se apoya en los ensayos con bioesferas tumorales donde se demuestra que los grupos tumorales no pueden crecer más de 2 mm a menos que estén vascularizados, pudiéndose explicar este fenómeno al ser esa la distancia máxima que pueden difundir el oxígeno y los nutrientes (3).
El abordaje de la microinvasión no carece de dificultades por: (1) ser difícil su detección, lo que obliga aun muestreo exhaustivo de la pieza en caso de CID; (2) la posibilidad de confundir verdaderas y falsas micro infiltraciones; (3) no existir todavía una definición morfológica firme de lo que entendemos por micro infiltración y (4) desconocer su valor clínico-biológico.
Schnitt considera que el mayor problema del diagnóstico de la micro infiltración es precisamente su sobre diagnóstico (11), por lo que vale la pena tener en cuenta aquello que no lo es. En nuestra experiencia el 28,2% de los casos revisados, a pesar de haber establecido criterios predeterminados, eran falsos positivos según dos de los autores. La pseudoinvasión asociada a lesiones esclerosantes o cancerización del lobulillo así como los artefactos post punción, han sido las causas más frecuentes de confusión. La ausencia de un patrón organoide así como la invasión más allá del estroma especializado perilobulillar acompañado de la falta completa de células mioepiteliales puede evitar estas posibles confusiones (12).
La infiltración aislada del estroma perilobulillar, generalmente por células sueltas, además de ser difícil su observación tiene interpretaciones diversas. Hay quién lo considera como una verdadera microinvasión (2) y hay quién no lo considera como tal o como mínimo pone en duda su significado biológico (12) aconsejando que se describa pero que se indique que su significado es incierto. No hay que olvidar que se han demostrado ultraestructuralmente la presencia de estructuras vasculares dentro del estroma lobulillar (13) como también lo demuestra la tinción con CD34 donde los vasos llegan a situarse inmediatamente por debajo del epitelio basal de la lesión intraductal (fig. 9). Por lo tanto, hipotéticamente, las vías metastásicas están presentes a este nivel.
Fig. 9:
Estructuras vasculares marcadas con CD34 situadas
inmediatamente por debajo de la membrana basal de una estructura ductal con
carcinoma in situ (CD34, 400x).
La presencia de una respuesta fibroblástica de tipo cicatricial y el antecedente de biopsia previa también son consideraciones ha tener en cuenta teniendo que recordar que las estructuras epiteliales distorsionados por la punción pueden carecer de células mioepiteliales (14). Un infiltrado inflamatorio denso periductal acompañado o no de fibrosis puede dificultar el diagnóstico de microinfiltración pero por si solo no es indicativo de su existencia (11).
La inmunohistoquímica tendría que podernos ayudar en los casos de duda. En nuestras manos la Calponina y la P63 han tenido un valor relativo, siendo útiles en un 50% de los casos realizados. El tamaño reducido de las lesiones es un obstáculo para este tipo de técnicas, ya que en la mayoría donde estas no fueron útiles el motivo fue la falta de representación de la zona problema en los nuevos cortes. La tinción con Calponina es de ayuda cuando es claramente positiva sobre todo en las lesiones esclerosantes. Cuando su expresión es incompleta la interpretación resulta más difícil ya que puede observarse en lesiones no infiltrantes. La P63 es un excelente marcador de mioepitelio, sensible y específico, aunque puede dar una tinción discontinua o marcar ocasionalmente células neoplásicas.
La utilización de ambas técnicas puede mejorar su sensibilidad por lo que es aconsejable utilizarlas de forma conjunta. La técnica de doble marcaje con actina y citoqueratina propuesta por Prasad (14) puede ser útil aunque no sabemos si es superior a la utilización de la calponina junto a la P63 o la SMM-HC (smooth muscle myosin heavy chain) (15).
La medida del tamaño también es fuente de problemas al poderse infravalorar como en nuestra serie en un 16,2% de los casos que resultaron pT1a, por lo que es necesario siempre recortar las muestras para asegurar el resultado.
Una vez valorado aquello que no es microinfiltración veamos cuales son las características más destacadas de los casos que si lo son según los criterios anteriormente mencionados. Como en la mayoría de las series publicadas el componente intraductal de nuestros casos ha mostrado un predominio del grado III (55%), observándose necrosis en un 83% de los casos. La forma de expresión morfológica más frecuente en nuestra serie ha sido el patrón sólido o comedociano, alto grado y con necrosis.
Aunque no hay una unanimidad en asociar microinfiltración con el tamaño del componente in situ, en las series más largas si parece existir esta asociación (16).
La invasión vascular aislada no se incluye en las definiciones de microinfiltración, pero creemos que cuando se identifica es un claro exponente del potencial metastático de la neoplasia a pesar de no haber demostrado invasión del estroma, como puede deducirse de los trabajos publicados en que la angioinvasión está marcadamente asociado a la presencia de metástasis ganglionares axilares y es en el análisis multivariante un factor pronóstico independiente asociado a mayor número de recurrencias y peor supervivencia de los carcinomas de mama infiltrantes (17).
Respecto a su comportamiento clínico y según algunas de las experiencias previas, el carcinoma de mama microinvasivo (clasificado según el método de Silver o el TNM), tendría un comportamiento similar al carcinoma intraductal asociado por sí solo (2,18) describiéndose, como en uno de nuestros casos, la recidiva local. Nos llama la atención la disparidad de porcentajes de afectación axilar que oscilan entre el 0% y el 13,3% utilizando alguno de los 2 métodos ya enunciados ( 2,16) siendo en nuestro caso del 6,6%. Esta disparidad podría explicarse por diferencias entre la biología de los tumores, entre la eficacia en el estudio de los ganglios o en la existencia de más focos de infiltración no detectados. El estudio del ganglio centinela en estos casos ha demostrado una positividad de hasta el 14% (19) por lo que no podemos concluir que los tumores microinfiltrantes no se asocian a invasión de la axila, lo que probablemente sea cierto es que el volumen de células tumorales que atraviesan estos ganglios es pequeño y difícil de detectar. La invasión axilar, en los carcinomas microinfiltrantes, generalmente afecta a carcinoma intraductales de alto grado con necrosis (tabla 2).
El modelo utilizado por Tavassoli así como otros modelos que valoran tamaño, no dejan de ser una forma de estimar de forma aproximada el volumen tumoral que puede indicarnos que ha menos células menos posibilidad de metástasis. Este supuesto parece corroborarse en otros trabajos (tabla 2) como el de Mascarel et al (20) en que la incidencia de metástasis en CID y CID asociado a microinfiltración de células aisladas periductales es de 1,4% y 0% respectivamente en comparación con los casos de CID con microinfiltración de escasos grupos cuyo tamaño es menor de 10 campos de gran aumento donde la incidencia de metástasis es del 10,1% y los casos de carcinomas ductales infiltrantes con más de un 80% de componente intraductal donde la incidencia es del 27,6%.
El estudio del ganglio centinela se ha propuesto como parte de la estadificación del carcinoma microinfiltrante para ahorrar la disección de la axila, sobre todo después de validar su utilidad en aquellos casos con cirugía previa (biopsia o lumpectomías) (21) que suele ser el escenario en que se sitúa el diagnóstico de microinfiltración.
Aunque siempre estamos hablando del tamaño tumoral como un factor pronóstico muy importante, sabemos que no es el único y por lo tanto añadimos el grado del tumor así como el tipo histológico como otros factores que permiten mejorar el valor predictivo del diagnóstico morfológico. Además se están estudiando otros marcadores que puedan ayudar a definir mejor el comportamiento de los tumores infiltrantes usuales como son la impronta genética y de los que se puedan deducir de la teoría de la carcinogénesis asociada a células progenitoras que sustenta, que es más importante la presencia de células progenitoras activadas que el número total de células tumorales para explicar la progresión tumoral (22).
Así podemos concluir que: 1. Hay que tener mucho cuidado en no sobrediagnosticar la microinfiltración teniendo en cuenta los simuladores descritos. En caso de duda, nuevos cortes así como el empleo de la inmunohistoquímica nos pueden ayudar. 2. Los casos de microinfiltración suelen asociarse a carcinomas intraductales de alto grado con necrosis. 3. Hay que valorar la posibilidad de incluir la invasión vascular como criterio de microinvasión cuando solo exista esta. 4. La invasión axilar, en los carcinomas microinfiltrantes, generalmente afecta a carcinoma intraductales de alto grado con necrosis. 5. Que los carcinomas definidos hasta ahora como microinfiltrantes tienen una capacidad baja de metastatizar en la axila. A pesar de la baja incidencia de metástasis, vale la pena incluir en su tratamiento el estudio del ganglio centinela. 6. Si persiste la duda diagnóstica a pesar de estudiar bien la lesión, el tratamiento será el del carcinoma in situ asociado a la lesión problema. 7. Cualquiera de los dos métodos más extendidos (Silver -Tavassoli o el TNM) pueden ser útiles a la hora de diagnosticar microinfiltración, pero sabiendo que es necesario definir mejor como medimos la lesión o si hay que introducir técnicas de imagen para determinar el volumen tumoral. 8. Finalmente, habrá que estudiar otros factores que complementen el tamaño tumoral, el grado y el tipo histológico a la hora de determinar la capacidad metastásica de las lesiones microinfiltrantes.
BIBLIOGRAFÍA
American Joint Committee on Cancer. AJCC Cancer Staging Manual. Philadelphia: Lippincott-Raven; 1997. p. 172-3.
Silver SA, Tavassoli FA. Ductal carcinoma in situ with microinvasion. Cancer 1998; 82: 2382-90.
Gimbrone MA Jr, Cotran RS, Leapman SB, Folkman J. Tumor growth and neovascularization: and experimental model using the rabbit cornea. J Natl Cancer Inst 1974; 52: 413-27.
Silverstein MJ, Lagios MD, Craig PH, Waisman JR, Lewinsky BS, Colburn WJ, et al. A prognostic index for ductal carcinoma in situ of the breast. Cancer 1996; 77: 2267-74.
Elston CW, Ellis IO. Pathological prognostic factors in breast cancer. I. The value of histological grades in breast cancer. Experience from a large study with long term follow-up. Histopathology 1991; 19: 403-410.
Cutuli B, Fay R, Cohen-Solal-Le Nir C, De Lafontan B, Mignotte H. Servent V, et al. Ductal Carcinoma in situ of the breast. Analysis of 882 cases. Presse Med 2004; 33: 83-9.
Fisher ER, Dignam J, Tan-chiu E, Constantino J, Fisher B, Paik S, et al. Pathologic findings from the National Surgical Adjuvant Breast Project (NSABP) eigth-year update of protocol B-17: intraductal carcinoma. Cancer 1999; 86: 429-38
Moorthy B, Ye W, Epstein HS, Holmes D, Silberman H, Lagios M. Local control in ductal carcinoma in situ treated by excision alone: incremental benefit of larger margins. Am J Surg 2005; 190: 83-9.
Consensus Conference on the Classification of ductal carcinoma in situ. Hum Pathol 1997; 28: 1221-5.
Shiraishi A, Kurosaki Y, Maehara T, Suzuki M, Kurosumi M. Extension of ductal carcinoma in situ: histopathological association with MR imaging and mammography. Magn Reson Med Sci 2003; 2: 159-63.
Schnitt SJ. Microinvasive carcinoma of the Breast: A Diagnostic in Search Definition. Adv Anat Pathol 1998; 5: 367-72.
Ellis IO, Lee AHS, Elston CW, Pinder SE. Microinvasive carcinoma of the breast: can it be diagnosed reliably and is it clinically significant. Histopathology 1999; 35: 468-72.
Stirling JW, Chandler JA. The fine structure of the normal, resting terminal ductal-lobular unit of the female breast. Virchow Arch 1976; 372: 205-26.
Prasad ML, Hyjek E, Giri DD, Ying L, O’leary JJ, Hoda SA. Double immunolabeling with cytokeratin and smooth-muscle actin in confirming early invasive carcinoma of breast. Am J Surg Pathol 1999; 23: 176-181.
Werling RW, Hwang H, Yaziji H, Gown AM. Immunohistochemical distinction of invasive from non-invasive breast lesions. A comparative study of p63 versus calponin and smooth muscle myosin heavy chain. Am J Surg Pathol 2003; 27: 82-90.
Prasad ML, Osborne MP, Giri DD, Hoda SA. Microinvasive carcinoma (T1mic) of the breast. clinicopathologic profile of 21 cases. Am J Surg Path. 2000; 24: 422-8.
Pinder SE, Ellis IO, Galea M, O’Rouke S, Blamey RW, Elston CW. Pathological prognostic factors in breast cancer. III. Vascular invasion: relationship with recurrence and survival in a large study with long-term follow up. Histopathology 1994; 24: 41-7.
Padmore RF, Fowble B, Hoffman J, Rosser C, Hanlon A, Patchefsky AS. Microinvasive breast carcinoma. Clinicopathologyc analysis of a single institution experience. Cancer 2000; 88: 1403-9.
Zavotsky J, Hansen N, Brennan MB, Turner R.T, Giuliano AE. Lymph node metastasis from ductal carcinoma in situ with microinvasion. Cancer 1999; 85: 2439-43.
Mascarel I, MacGrogan G, Mathoulin-Pélissier S, Soubeyran I, Picot V and Coindre JM. Breast Ductal Carcinoma in situ with Microinvasion. A Definition supported by a long-term study of 1248 serially sectioned ductal carcinomas. Cancer 2002; 94: 2134-42.
Mamounas EP, Brown A, Anderson S, Smith R, Julian T, Miller B, et al. Sentinel node biopsy after neoadjuvant chemotherapy in breast cancer: results from National Surgical Adjuvant Breast and Bowel Project Protocol B-27. J Clin Oncol 2005; 23: 2694-702.
Al-Hajj M, Wicha MS, Benito-Hernández A, Morrison SJ, Clarke MF. Prospective identification of tumorigenic breast cancer cells. Proc Natl Acad Sci USA 2003; 100: 3983-8.