
Vol. 41, n.º 2, 2008
REVISTA
ESPAÑOLA DE
Vol. 41, n.º 2, 2008 |
ORIGINALES
Nuria Álvarez Sánchez1, Cristina Martínez Conesa2, Vicente Vicente Ortega1
1 Cátedra de Anatomía
Patológica. Facultad de Medicina. Universidad de Murcia, Murcia.
2 Departamento de Recursos Naturales y Desarrollo Rural, Instituto
Murciano de Investigación y Desarrollo Agrario y Alimentario (IMIDA), Murcia.
nalvarez@um.es
RESUMEN
Antecedentes: El melanoma metastatiza en aproximadamente un tercio de los pacientes, causando una caída de la supervivencia hasta el 1-2% a los dos años. El único tratamiento eficaz es el interferón alfa (IFN a) a dosis altas, que resulta muy tóxico. Por ello se buscan antitumorales menos tóxicos, entre los que destacan los flavonoides. Nuestro objetivo ha sido estudiar el tratamiento del melanoma metastásico pulmonar combinando IFN a y diosmina en un modelo murino. Material y Métodos: Utilizamos 60 ratones Swiss inoculados con células (5 x 105) de la línea de melanoma murino B16F10, tratados durante 11 días antes y 21 días después de la inoculación: Grupo I: etanol + PBS; Grupo II: etanol + IFN a (600.000 UI); Grupo III: etanol + IFN a (1.200.000 UI); Grupo IV: diosmina + PBS; Grupo V: diosmina + IFN a (600.000 UI); Grupo VI: diosmina + IFN a (1.200.000 UI). Tras el tratamiento, los animales fueron sacrificados y realizamos el contaje macroscópico de los nódulos metastásicos subpleurales. Resultados: Encontramos diferencias significativas entre el grupo control y los tratados (p<0,001), produciéndose la mayor reducción del número de metástasis subpleurales respecto al control en el grupo III (79,74%; p<0,001), seguido del grupo V (77,38%; p<0,001), del VI (72,33%; p<0,001), del IV (61,4%; p<0,001) y del II (59,59%; p<0,001). Conclusiones: La combinación de diosmina con la dosis menor de IFN a mostró la potenciación de la actividad antimetastásica de ambos compuestos, resultando igual de eficaz que la dosis más elevada de IFNa de forma individualizada.
Palabras clave: Diosmina, flavonoide, interferón alfa, melanoma metastásico.
SUMMARY
Background: Melanoma metastasizes in approximately one third of patients, causing a drop in survival of 1-2% at two years. The only effective treatment is Interferon alpha (IFN a) at elevated doses, which is highly toxic. Thus, less toxic antitumoral agents are being sought, among which flavonoids are to be highlighted. Our aim was to study the combined treatment of metastasic lung melanoma with IFN a and diosmin in a murine model. Material & Methods: 60 Swiss mice inoculated with cells (5 x 105) from the B16F10 murine melanoma cell line, treated over 11 days prior and 21 days following inoculation: Group I: ethanol + PBS; Group II: ethanol + IFN a (600,000 IU); Group III: ethanol + IFN a (1,200,000 IU); Group IV: diosmin + PBS; Group V: diosmin + IFN a (600,000 IU); Group VI: diosmin + IFN a (1,200,000 IU). Following treatment, animals were sacrificed and a macroscopic count of subpleural metastasic nodules was performed. Results: We found significant differences between the control and the treated groups (p<0.001), there being a greater drop in the number of subpleural metastasis in group III with respect to the control (79.74%; p<0.001), followed by group V (77.38%; p<0.001), VI (72.33%; p<0.001), IV (61.4%; p<0.001) and II (59.59%; p<0.001). Conclusions: The combination of diosmin with the lower dose of IFN a showed a strengthening of the anti-metastasic action of both compounds, being equally as effective as the highest dose of IFN a on its own.
Keywords: Diosmin, flavonoid, interferon alpha, metastasic melanoma.
INTRODUCCIÓN
El melanoma es el cáncer cutáneo más importante, puesto que, aunque sólo representa en torno al 4%, es el responsable directo del 80% de las muertes por cáncer de piel (1). En España supone el 1,3% (varones) y el 2,5% (mujeres) de los tumores malignos y se calcula que ha experimentado un incremento del 181,3% en hombres y del 205,3% en mujeres (2). No obstante, la supervivencia a los cinco años en pacientes con melanoma ha pasado de alrededor del 80% en el año 1975 a más de un 90% en 1996, gracias a las mejoras en el diagnóstico temprano (3).
Aproximadamente un tercio de los pacientes con melanomas cutáneos primarios desarrollan metástasis, siendo el pulmón la localización visceral más frecuente (18-36%) (4). La supervivencia en los casos de metástasis viscerales distantes cae hasta el 1-2% a los dos años (5). Debido a su mal pronóstico, en el tratamiento del melanoma se han ensayado todas las terapias desarrolladas contra el cáncer, con resultados discretos.
El interferón alfa (IFN a) presenta una actividad razonable (en torno al 15%) contra el melanoma metastático (6). Se han realizado cuatro grandes ensayos clínicos que han demostrado la eficacia del IFN a a dosis elevadas. El primero de ellos (E1684) mostró un aumento significativo en la supervivencia libre de recidivas y en la supervivencia media, aunque en estudios posteriores (NCCTG, E1690, E1694) el aumento de la supervivencia media sólo ha sido significativo en uno de ellos (E1694) (7).
Los interferones de tipo I (IFN a, b y w) humanos inducen la expresión de un gran número de genes implicados en la regulación de respuestas biológicas con actividad antiviral, antiproliferativa e inmunomoduladora. El IFN a ha demostrado capacidad de inducir apoptosis o sensibilizar frente a las señales proapoptóticas de otras moléculas en varias líneas celulares tumorales y en tumores primarios (8). Además, es capaz de inhibir la expresión de la actividad telomerasa en varias líneas celulares de melanoma (9). También es un potente antiangiogénico, ya que inhibe la expresión de distintas moléculas proangiogénicas (10) y regula la expresión de metaloproteasas de matriz (11). Por otra parte, el IFN a estimula la citotoxicidad de las células mononucleares sanguíneas (12), estimula los linfocitos T cooperadores (13) y aumenta la actividad de las células natural killer (células NK) (14). Esta citoquina juega un importante papel en la diferenciación de células hematopoyéticas, entre ellas los linfocitos B y T, las células dendríticas y NK, o los osteoclastos (15).
La supervivencia media no ha mejorado a pesar de décadas de investigación y aplicación de las terapias citotóxicas, inmunológicas y moleculares (16). Por ello, se están realizando numerosos estudios dirigidos a la obtención de compuestos con efectos antitumorales y menor toxicidad. En este campo destaca la investigación sobre compuestos antioxidantes, entre los que se encuentran los flavonoides, compuestos polifenólicos derivados de plantas que han demostrado numerosos efectos beneficiosos para la salud (17). La diosmina es un flavonoide glicosilado con actividad antiinflamatoria y analgésica (18), antimutagénica (19), protectora vascular (20-22) y antioxidante (23). Se utiliza en el tratamiento de enfermedades como la insuficienca venosa (20) y ha demostrado capacidad para inhibir la invasión y la proliferación del melanoma en un modelo murino de melanoma metastático (24-26) y en tumores causados por carcinógenos en distintos órganos (28-30).
El objetivo de nuestro trabajo es estudiar el efecto del tratamiento con IFN a y diosmina, así como su posible sinergismo en un modelo murino de melanoma metastásico pulmonar.
MATERIAL Y MÉTODOS
Animales
Hemos utilizado 60 ratones albinos Swiss hembras de 10-12 semanas de edad con un peso medio de 36,3 g al comienzo del experimento, procedentes del Servicio de Animales de Laboratorio de la Universidad de Murcia (SAI; n.º REGAES300305440012). Se han mantenido y utilizado siguiendo la guía establecida por la Unión Europea sobre la protección de los animales utilizados en experimentación (86/609/CEE).
Línea celular
Utilizamos la línea B16F10 procedente de la European Collection Cell Cultures (ECACC, Reino Unido). Para el cultivo de las células utilizamos medio EMEM (Gibco, EEUU) tamponado a pH 7,2-7,4 y suplementado con un 10% de suero bovino fetal (SBF, Sigma Co., España), 100 UI/mL de penicilina y 100 µg/mL de estreptomicina (Gibco, EEUU). Comprobamos la ausencia de Mycoplasma spp. mediante fluorescencia directa con un colorante específico de DNA (H33233; Hoescht, Germany).
Procedimiento experimental
La diosmina (Furfural Español, España) fue disuelta al 0,2% (peso/volumen) en una solución al 1,2% (volumen/volumen) de etanol (Guinama, España) en agua, y administrada en la bebida y la comida (pienso de mantenimiento para ratón A04 triturado (Panlab, España)). Comida y bebida fueron suministradas «ad libitum». En total, los animales recibieron una dosis aproximada de 550,96 mg/kg ratón/día.
Disolvimos el interferón alfa 2b (IntronA, SP Europe, Bélgica) en tampón fosfato salino (PBS) para conseguir las concentraciones deseadas: 50.000 UI/día/ratón y 100.000 UI/día/ratón en un volumen final de 200 µL. Se administró por vía subcutánea en la región inguinal izquierda tres veces a la semana. Las dosis totales fueron 600.000 UI/ratón y 1.200.000 UI/ratón.
Los animales se repartieron en los siguientes grupos experimentales (n=10):
Grupo I (control). Etanol al 1,2% en la comida y la bebida, y 200 µL de PBS subcutáneo tres veces por semana.
Grupo II. Etanol (1,2%) e IFN a (600.000 UI/ratón).
Grupo III. Etanol (1,2%) e IFN a (1.200.000 UI/ratón).
Grupo IV. Diosmina (0,2%) y PBS.
Grupo V. Diosmina (0,2%) e IFN a (600.000 UI/ratón).
Grupo VI. Diosmina (0,2%) e IFN a (1.200.000 UI/ratón).
Los animales recibieron el tratamiento durante 11 días antes de la inoculación de las células tumorales, y durante los 21 días posteriores a la misma. Inoculamos 5 x 105 células B16F10 en 200 µL de medio de cultivo en la vena lateral de la cola se realizó siguiendo el modelo desarrollado por Martínez Conesa y cols. (30).
Terminados los tratamientos, los ratones fueron sacrificados, realizándose la necropsia. Los órganos (pulmones, riñones, bazo e hígado) fueron fijados en formol neutro tamponado al 10%.
Análisis cuantitativo de las metástasis pulmonares
Para la cuantificación de las metástasis contamos los nódulos metastáticos localizados en la superficie pleural de los cinco lóbulos pulmonares utilizando una lupa estereoscópica Olympus.
Análisis estadístico
Para la comparación de los grupos realizamos un análisis de varianza, que se completó con comparaciones entre pares de medias mediante el método de la mínima diferencia significativa. Consideramos significativos los valores de p inferiores o iguales a 0,05 (p£0,05).
RESULTADOS
Hemos considerado como nódulo metastático contable toda estructura de color marrón homogéneo en la superficie pulmonar, cuyo tamaño oscilaba desde un punto denso hasta un nódulo grande, pero que estaba suficientemente separada de las demás para poder ser contada de forma individualizada (fig. 1).
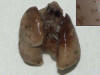
Fig. 1:
Características macroscópicas de los nódulos
metastáticos subpleurales.
En los animales del grupo control (grupo I) encontramos una media de 260,17±32,66 nódulos subpleurales, repartidos por toda la superficie pulmonar (fig. 2, tabla 1).

Fig. 2:
Frecuencia media de aparición de los nódulos
metastáticos subpleurales. Barra de error: error de la media. Asterisco:
significación estadística (p-<0,05) respecto al grupo control.
El grupo tratado con etanol e IFN a a la dosis de 600.000 UI (grupo II) mostró una reducción significativa (p<0,001) del número de nódulos subpleurales respecto al grupo I del 59,59% (fig. 2, tabla 1).
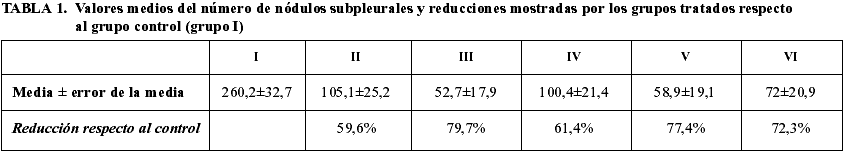
Al comparar el grupo tratado con diosmina y PBS (grupo IV) con el control (grupo I) observamos una reducción significativa del 61,40% en el número de nódulos subpleurales (p<0,001) (fig. 2, tabla 1).
El grupo tratado con diosmina e IFN a a la dosis de 1.200.000 UI (grupo VI) mostró una reducción significativa del 72,33% respecto al grupo I (p<0,001) y del 28,31% respecto al grupo tratado con diosmina y PBS (grupo IV) (no significativa). No obstante, aumentó de forma no significativa respecto al grupo tratado con etanol e IFN a a 1.200.000 UI (grupo III) en un 36,60% y respecto al grupo tratado con diosmina e IFN a a 600.000 UI (grupo V) en un 22,33% (no significativa) (fig. 2, tabla 1).
En el grupo tratado con diosmina e IFN a a la dosis de 600.000 UI (grupo V) encontramos una reducción del 77,38% respecto al grupo I (p<0,001), del 44,02% respecto al grupo tratado con IFN a a 600.000 UI (grupo II) (no significativa) y del 41,39% respecto al grupo tratado con diosmina y PBS (grupo IV) (no significativa) (fig. 2, tabla 1).
Por último, la mayor reducción en el número de nódulos metastásicos subpleurales se produjo en el grupo tratado con etanol e IFN a a la dosis de 1.200.000 UI (grupo III), con una disminución del 79,74% respecto al grupo I (p<0,001) y del 49,87% respecto al grupo tratado con etanol e IFN a a 600.000 UI (grupo II) (no significativa) (fig. 2, tabla 1).
DISCUSIÓN
El melanoma se considera el cáncer cutáneo más importante, debido a que provoca alrededor del 80% de las muertes por cáncer de piel (1). Gran parte de su importancia médica radica en que es una de las neoplasias que metastatiza con mayor frecuencia, causando la caída de la supervivencia hasta el 1-2% a los dos años en los casos con metástasis viscerales (5). Los pulmones son la segunda localización de metástasis más frecuente (15-36%), tras los ganglios linfáticos (4).
Por otra parte, existen pocos tratamientos del melanoma realmente eficaces. La Food and Drug Administration (FDA) estadounidense ha aprobado la utilización de la interleuquina 2 y el IFN a, ambos a dosis altas, para el tratamiento del melanoma metástasico, con resultados discretos y una toxicidad elevada (7). De ahí la importancia de la búsqueda de terapias alternativas más eficaces o que permitan reducir las dosis, y por tanto, la toxicidad, de las ya utilizadas en el tratamiento del melanoma metastático.
En nuestro estudio nos hemos basado en los resultados obtenidos por nuestro grupo de investigación sobre los efectos de diversos flavonoides y del IFN a en un modelo murino de melanoma metastásico pulmonar (24-26,30,31). Dichos trabajos demostraron que la diosmina era el flavonoide con mayor actividad antitumoral de todos los ensayados, con una respuesta semejante a la de las concentraciones más altas de IFN a administradas. Por ello, nos propusimos combinar ambos compuestos para estudiar su posible efecto sinérgico, seleccionando para ello las dos concentraciones de IFN a más altas, que dieron los mejores resultados en los estudios previos, y utilizando el mismo protocolo.
Para administrar la diosmina a los animales necesitamos disolverla en una concentración considerable de etanol (1,2%). Los estudios previos de nuestro grupo demostraron que en el grupo tratado con etanol aumentaba significativamente el número de metástasis subpleurales (86%) respecto de los animales sólo inoculados con las células (30). Otros autores han descrito este efecto del etanol sobre las metástasis pulmonares en las líneas B16F10 (32) y B16BL6 (33). Por ello, en nuestro estudio decidimos utilizar como referente para todos los grupos restantes el grupo que recibió etanol y PBS (grupo I).
En nuestro estudio el IFN a provocó una disminución del número de metástasis (59,59% y 79,74% con las dosis de 600.000 UI y 1.200.000 UI, respectivamente), similar a los resultados obtenidos previamente por Martínez y cols. (31), quienes encontraron una reducción del número de metástasis subpleurales del 50,06% (600.000 UI) y del 65,55% (1.200.000 UI).
Estos resultados podrían estar relacionados con lo descrito en diversos estudios han demostrado la capacidad de los interferones para inhibir la expresión de metaloproteasas de matriz [MMP-2 (34), MMP-9 (35, 36) y MMP-13 (11)] y su actividad antiproliferativa (9, 37, 38) y proapoptótica (9,38). También se ha relacionado la capacidad antitumoral del IFN a con su actividad antiagregante (39), ya que la agregación protege a las células tumorales de la acción de las células NK (40) y permite formar agregados en los vasos pulmonares que favorecen la formación de metástasis (41).
Por último, el efecto antitumoral del IFN a está relacionado con su efecto sobre la diferenciación de las células hematopoyéticas del hospedador (42): en pacientes con melanoma el tratamiento con IFN a aumenta la actividad de las células NK y los linfocitos Th y la infiltración de linfocitos T CD4+ en el tumor (15,43).
En nuestro estudio, el tratamiento con diosmina (grupo IV) provocó una reducción del número de metástasis subpleurales del 61,40%, similar a los resultados previos de Martínez y cols. (52%) (25). Es destacable que los valores del número de nódulos metastásicos de la diosmina son parecidos a los obtenidos con la dosis menor de IFN a (reducción respecto al control del 59,59%).
Varios autores han descrito que la diosmina aumenta el tono venoso y reduce la hiperpermeabilidad vascular y capilar (20-22), lo que podría dificultar la extravasación de las células tumorales. Además, reduce la viscosidad sanguínea y favorece la desagregación de los glóbulos rojos (44), dificultando así la formación de los agregados con componentes de la sangre necesarios para la protección de las células sanguíneas frente al sistema inmune y para la estasis del émbolo en los vasos (40,41). La diosmina también regula la expresión de moléculas de adhesión (45) lo que podría dificultar la unión de las células tumorales al endotelio, y, por tanto, el proceso de metástasis.
La diosmina reduce la inflamación in vivo porque inhibe la producción de las prostaglandinas E2 y F2 y del tromboxano A2 (21, 22). La prostaglandina E2 ha demostrado impedir la unión de células NK a células tumorales (46), por lo que el efecto de la diosmina podría potenciar la actividad citotóxica del sistema inmune.
En nuestro trabajo la combinación de diosmina e IFN a provocó la reducción significativa del número de nódulos subpleurales (77,38% en el grupo V y 72,33% en el grupo VI). Destacaba el hecho de que la acción antitumoral de la unión de la diosmina con la dosis menor de IFN a (grupo V) era significativamente menor que la originada por el tratamiento con diosmina (grupo IV) o con la dosis más baja de IFN a (grupo II) cuando se aplicaban de forma aislada, y similar, además, a la obtenida con la dosis más elevada de IFN a (grupo III). En este sentido, se ha descrito un efecto sinérgico semejante entre varios flavonoides y el IFN a en carcinoma cervical (47).
En el grupo VI (diosmina e IFN a a 100.000 UI/día) la actividad antitumoral era mayor que en el grupo IV, tratado con diosmina y PBS, pero menor que en el grupo tratado únicamente con IFN a (grupo III). Este efecto podría deberse a ciertos efectos antagónicos entre ambos compuestos. Así, la diosmina provoca la inhibición de la expresión de moléculas de adhesión, entre ellas ICAM-1 y VCAM (45), mientras que el IFN a la aumenta (48); aunque la disminución de las moléculas de adhesión al endotelio dificultaría la extravasación de las células tumorales, también afectaría a la actividad de las células dendríticas, muy importantes en el rechazo de los tumores (49). Además, el IFN a aumenta la expresión de la ciclooxigenasa 2 (Cox-2) y la síntesis de prostaglandina E2 (46) frente al efecto inhibitorio de la diosmina (21,22), afectando con ello al reconocimiento de las células tumorales por las células NK (46).
Aunque no hemos encontrado estudios con la diosmina, varios autores han demostrado que diversos flavonoides bloquean numerosas cascadas de transducción de señales (50-52) que son activadas por el IFN a (8).
En conclusión, nuestro trabajo ha confirmado la actividad antitumoral dosis-dependiente del IFN a, y corroborado las propiedades antitumorales de la diosmina, un compuesto natural no tóxico, cuya eficacia es equiparable a la del IFN a a la menor dosis estudiada. No obstante, el resultado más sorprendente correspondió a la potenciación del efecto de la dosis menor de IFN a al combinarlo con la diosmina, que demostró similar eficacia a la dosis más elevada de IFN a de forma individualizada.
AGRADECIMENTOS
Agradecemos por su asistencia técnica a Víctor Bolarín Lucas y Brad Muir, técnicos en Anatomía Patológica en la Cátedra de Anatomía Patológica, a Antonio Cano del Servicio de Animales de Laboratorio (SAI, UMU), a la Dra. María Teresa Castell del Servicio de Análisis de Imagen (SAI, UMU) y a los Drs. Antonia Bernabéu y José Muñoz y a Juana María García del Servicio de Cultivos Celulares (SAI, UMU).
BIBLIOGRAFÍA
Horn-Ross PL. Melanoma in the Greater San Francisco Bay Area 1988-2000. Northern California Cancer Center (serial online) (citado marzo 2003). Disponible en: URL: http://www.nccc.org/pdf/poc/melanoma_factsheet_88-2000.pdf.
Saenz S, Conejo-Mir J, Cayuela A. Melanoma epidemiology in Spain. Actas Dermosifiliogr 2005; 96: 411-8.
Weinstock MA. Progress and prospects on melanoma: the way forward for early detection and reduced mortality. Clin Cancer Res. 2006; 12(7 Pt 2): 2297s-300s.
Leiter U, Meier F, Schittek B, Garbe C. The natural course of cutaneous melanoma. J Surg Oncol 2004; 86: 172-8.
De Braud F, Khayat D, Kroon BB, Valdagni R, Bruzzi P, Cascinelli N. Malignant melanoma. Crit Rev Oncol Hematol 2003; 47: 35-63.
Sabel MS, Sondak VK. Pros and cons of adjuvant interferon in the treatment of melanoma. Oncologist 2003; 8: 451-8.
Pawlik TM, Sondak VK. Malignant melanoma. Current state of primary and adjuvant treatment. Crit Rev Oncol Hematol 2003; 45: 245-64.
Caraglia M, Marra M, Pelaia G, Maselli R, Caputi M, Marsico SA, et al. Alpha-interferon and its effects on signal transduction pathways. J Cell Physiol 2005; 202: 323-35.
Maellaro E, Pacenti L, Del Bello B, Valentini MA, Mangiavacchi P, De Felice C, et al. Different effects of interferon-alpha on melanoma cell lines: a study on telomerase reverse transcriptase, telomerase activity and apoptosis. Br J Dermatol 2003; 148: 1115-24.
Raffaella R, Gioia D, De Andrea M, Cappello P, Giovarelli M, Marconi P, et al. The interferon-inducible IFI16 gene inhibits tube morphogenesis and proliferation of primary, but not HPV16 E6/E7-immortalized human endothelial cells. Exp Cell Res 2004; 293: 331-45.
Ala-aho R, Johansson N, Grenman R, Fusenig NE, Lopez-Otin C, Kahari VM. Inhibition of collagenase-3 (MMP-13) expression in transformed human keratinocytes by interferon-gamma is associated with activation of extracellular signal-regulated kinase-1,2 and STAT1. Oncogene. 2000; 19: 248-57.
Abuzahra F, Heise R, Joussen S, Dreuw A, Merk H, Zwadlo-Klarwasser G, et al. Adjuvant interferon alfa treatment for patients with malignant melanoma stimulates transporter proteins associated with antigen processing and proteasome activator 28. Lancet Oncol 2004; 5: 250.
Menon Y, Cucurull E, Reisin E, Espinoza LR. Interferon-alpha-associated sarcoidosis responsive to infliximab therapy. Am J Med Sci 2004; 328: 173-5.
Yang H, Dithmar S, Grossniklaus HE. Interferon alpha 2b decreases hepatic micrometastasis in a murine model of ocular melanoma by activation of intrinsic hepatic natural killer cells. Invest Ophthalmol Vis Sci 2004; 45: 2056-64.
Belardelli F, Ferrantini M, Proietti E, Kirkwood JM. Interferon-alpha in tumor immunity and immunotherapy. Cytokine Growth Factor Rev 2002; 13: 119-34.
Gogas HJ, Kirkwood JM, Sondak VK. Chemotherapy for metastatic melanoma: time for a change?. Cancer 2007; 109: 455-64.
Martínez-Valverde I, Periago MJ, Ros G. Significado nutricional de los compuestos fenólicos en la dieta. Arch Latinoam Nutr 2000; 50: 5-18.
Panthong A, Supraditaporn W, Kanjanapothi D, Taesotikul T, Reutrakul V. Analgesic, anti-inflammatory and venotonic effects of Cissus quadrangularis Linn. J Ethnopharmacol 2007; 110: 264-70.
Bear WL, Teel RW. Effects of citrus flavonoids on the mutagenicity of heterocyclic amines and on cytochrome P450 1A2 activity. Anticancer Res 2000; 20: 3609-14.
Ramelet AA. Clinical benefits of Daflon 500 mg in the most severe stages of chronic venous insufficiency. Angiology 2001; 52 Suppl 1: S49-56.
Labrid C. Pharmacologic properties of Daflon 500 mg. Angiology 1994; 45(6 Pt 2): 524-30.
Bergan JJ, Schmid-Schonbein GW, Takase S. Therapeutic approach to chronic venous insufficiency and its complications: place of Daflon 500 mg. Angiology 2001; 52 Suppl 1: S43-7.
Sroka Z, Fecka I, Cisowski W. Antiradical and anti-H2O2 properties of polyphenolic compounds from an aqueous peppermint extract. Z Naturforsch [C] 2005; 60: 826-32.
Vicente Ortega V, Martínez Conesa C, Yáñez Gascón J, Alcaraz Baños M, Canteras Jordana M. Melanoma metastásico pulmonar: Efectos del etanol y de flavonoides. Rev Esp Pat 2003; 36: 425-32.
Martínez C, Vicente V, Yáñez J, Alcaraz M, Castells MT, Canteras M, et al. The effect of the flavonoid diosmin, grape seed extract and red wine on the pulmonary metastatic B16F10 melanoma. Histol Histopathol 2005; 20: 1121-9.
Martínez Conesa C, Vicente Ortega V, Yáñez Gascón MJ, Alcaraz Baños M, Canteras Jordana M, Benavente-García O, et al. Treatment of metastatic melanoma B16F10 by the flavonoids tangeretin, rutin, and diosmin. J Agric Food Chem 2005; 53: 6791-7.
Yang M, Tanaka T, Hirose Y, Deguchi T, Mori H, Kawada Y. Chemopreventive effects of diosmin and hesperidin on N-butyl-N-(4-hydroxybutyl) nitrosamine-induced urinary-bladder carcinogenesis in male ICR mice. Int J Cancer 1997; 73: 719-24.
Tanaka T, Kohno H, Mori H. Chemoprevention of Colon Carcinogenesis by Dietary Non-nutritive Compounds. Asian Pac J Cancer Prev 2001; 2: 165-77.
Browning AM, Walle UK, Walle T. Flavonoid glycosides inhibit oral cancer cell proliferation--role of cellular uptake and hydrolysis to the aglycones. J Pharm Pharmacol 2005; 57: 1037-42.
Martínez Conesa C, Vicente Ortega V, Yáñez Gascón MJ, García Reverte JM, Canteras Jordana M, Alcaraz Baños, M. Experimental model for treating pulmonary metastatic melanoma using grape-seed extract, red wine and etanol. Clin Transl Oncol 2005; 7: 115-21.
Martínez C, Vicente V, Yañez J, Garcia J, Canteras M, Alcaraz M. Experimental model of pulmonary metastasis treatment with IFNa. Cancer Lett 2005; 225: 75-83.
Wu WJ, Pruett SB. Ethanol decreases host resistance to pulmonary metastases in a mouse model: role of natural killer cells and the ethanol-induced stress response. Int J Cancer 1999; 82: 886-92.
Blank SE, Meadows GG. Ethanol modulates metastatic potential of B16BL6 melanoma and host responses. Alcohol Clin Exp Res 1996; 20: 624-8.
Wen Y, Yan DH, Wang B, Spohn B, Ding Y, Shao R, et al. p202, an interferon-inducible protein, mediates multiple antitumor activities in human pancreatic cancer xenograft models. Cancer Res 2001; 61: 7142-7.
Slaton JW, Karashima T, Perrotte P, Inoue K, Kim SJ, Izawa J, et al. Treatment with low-dose interferon-alpha restores the balance between matrix metalloproteinase-9 and E-cadherin expression in human transitional cell carcinoma of the bladder. Clin Cancer Res 2001; 7: 2840-53.
Ozawa S, Shinohara H, Kanayama HO, Bruns CJ, Bucana CD, Ellis LM, et al. Suppression of angiogenesis and therapy of human colon cancer liver metastasis by systemic administration of interferon-alpha. Neoplasia 2001; 3: 154-64.
Shyu RY, Su HL, Yu JC, Jiang SY. Direct growth suppressive activity of interferon-alpha and -gamma on human gastric cancer cells. J Surg Oncol 2000; 75: 122-30.
Yano H, Yanai Y, Momosaki S, Ogasawara S, Akiba J, Kojiro S, et al. Growth inhibitory effects of interferon-alpha subtypes vary according to human liver cancer cell lines. J Gastroenterol Hepatol 2006; 21: 1720-5.
Gutman H, Schachter J, Stopel E, Gutman R, Lahav J. Impaired platelet aggregation in melanoma patients treated with interferon-alpha-2b adjuvant therapy. Cancer 2002; 94: 780-5.
Palumbo JS, Talmage KE, Massari JV, La Jeunesse CM, Flick MJ, Kombrinck KW, et al. Platelets and fibrin(ogen) increase metastatic potential by impeding natural killer cell-mediated elimination of tumor cells. Blood 2005; 105: 178-85.
Im JH, Fu W, Wang H, Bhatia SK, Hammer DA, Kowalska MA, et al. Coagulation facilitates tumor cell spreading in the pulmonary vasculature during early metastatic colony formation. Cancer Res 2004; 64: 8613-9.
Solis M, Goubau D, Romieu-Mourez R, Genin P, Civas A, Hiscott J. Distinct functions of IRF-3 and IRF-7 in IFN-alpha gene regulation and control of anti-tumor activity in primary macrophages. Biochem Pharmacol 2006; 72: 1469-76.
Hakansson A, Gustafsson B, Krysander L, Hakansson L. Effect of IFN-alpha on tumor-infiltrating mononuclear cells and regressive changes in metastatic malignant melanoma. J Interferon Cytokine Res 1998; 18: 33-9.
Le Devehat C, Khodabandehlou T, Vimeux M, Kempf C. Evaluation of haemorheological and microcirculatory disturbances in chronic venous insufficiency: activity of Daflon 500 mg. Int J Microcirc Clin Exp 1997; 17 Suppl 1: 27-33.
Smith PC. Daflon 500 mg and venous leg ulcer: new results from a meta-analysis. Angiology 2005; 56 Suppl 1: S33-9.
Bostrom PJ, Uotila P, Rajala P, Nurmi M, Huhtaniemi I, Laato M. Interferon-alpha inhibits cyclooxygenase-1 and stimulates cyclooxygenase-2 expression in bladder cancer cells in vitro. Urol Res 2001; 29: 20-4.
Blank VC, Poli C, Marder M, Roguin LP. Antiproliferative activity of various flavonoids and related compounds: additive effect of interferon-alpha2b. Bioorg Med Chem Lett 2004; 14: 133-6.
Sundelin K, Roberg K, Grenman R, Hakansson L. Effects of cisplatin, alpha-interferon, and 13-cis retinoic acid on the expression of Fas (CD95), intercellular adhesion molecule-1 (ICAM-1), and epidermal growth factor receptor (EGFR) in oral cancer cell lines. J Oral Pathol Med 2007; 36: 177-83.
Hussein MR. Dendritic cells and melanoma tumorigenesis: an insight. Cancer Biol Ther 2005; 4: 501-5.
Matsuda H, Morikawa T, Ando S, Toguchida I, Yoshikawa M. Structural requirements of flavonoids for nitric oxide production inhibitory activity and mechanism of action. Bioorg Med Chem 2003; 11: 1995-2000.
Menegazzi M, Tedeschi E, Dussin D, De Prati AC, Cavalieri E, Mariotto S, et al. Anti-interferon gamma action of epigallocatechin-3-gallate mediated by specific inhibition of STAT1 activation. FASEB J 2001; 15: 1309-11.
Matsuda T, Ferreri K, Todorov I, Kuroda Y, Smith CV, Kandeel F, et al. Silymarin protects pancreatic beta-cells against cytokine-mediated toxicity: implication of c-Jun NH2-terminal kinase and janus kinase/signal transducer and activator of transcription pathways. Endocrinology 2005; 146: 175-85.