
Vol. 41, n.º 2, 2008
REVISTA
ESPAÑOLA DE
Vol. 41, n.º 2, 2008 |
CASUÍSTICA
Maddi Garmendia1, Ibon Rodríguez2, Cosme Ereño1, Francisco J. Bilbao1, José I. López1
Hospital de Basurto. Bilbao. Universidad del País
Vasco (EHU/UPV). Avda. Montevideo, 18. 48013 Bilbao.
1 Servicio de Anatomía Patológica.
2 Servicio de Cardiología.
joseignacio.lopez@ehu.es
RESUMEN
Introducción: La hipertrofia adiposa del septo interauricular es cada vez más frecuentemente reconocida gracias al desarrollo creciente de las técnicas de imagen no invasivas. Presentación del caso: Se presenta el caso de una paciente de 72 años de edad aquejada de angina de esfuerzo a la que en el estudio clínico se detectó una hiperplasia adiposa del septo interauricular. El estudio de la pieza de resección quirúrgica mostró la histología típica de esta entidad, con adipocitos maduros y lipoblastos entremezclados con fibras musculares cardiacas. Conclusiones: Aunque esta patología es relativamente frecuente, rara vez necesita ser corregida quirúrgicamente, motivo por el cual los patólogos la suelen diagnosticar en el estudio autópsico. Se revisa la literatura reciente en relación con las lesiones adiposas auriculares.
Palabras clave: Hipertrofia adiposa, corazón, tabique auricular, pseudotumor.
SUMMARY
Introduction: Lipomatous hypertrophy of the atrial septum is diagnosed more frequently after the use of non-invasive imaging techniques. Case presentation: A case of lipomatous hypertrophy of the atrial septum in a 72 year-old woman who consulted because of effort-related angina is reported. The study of the excised tissue fragments showed the typical histology, with mature adipocytes and lipoblasts intermingled with cardiac muscle fibres. Conclusions: This lesion is relatively frequent but surgical treatment is rarely needed. So, pathologists take contact with it mainly in the autopsy. The recent literature related to atrial lipomatous lesions is reviewed.
Keywords: Lipomatous hypertrophy, heart, atrial septum, pseudotumour.
INTRODUCCIÓN
La hipertrofia adiposa del septo interauricular es una lesión rara pero cada vez más frecuentemente reconocida (1) gracias al desarrollo creciente de las técnicas de imagen no invasivas. Fue descrita en 1964 por Prior durante un estudio postmortem y hasta el momento se han publicado alrededor de 200 casos en todo el mundo. De origen aún incierto, estas lesiones resultan asintomáticas en la mayoría de las ocasiones aunque se han relacionado con arritmias cardíacas y con muertes súbitas no filiadas. La incidencia de dicha lesión en pacientes vivos es de 2,2% (2), dato que probablemente irá en aumento gracias a los avances en las técnicas de imagen. Aunque el 1% de los mismos corresponden a hallazgos necrópsicos (3), se estima que su frecuencia real es mayor ya que hasta el 8% de los ecocardiogramas muestran engrosamientos anómalos del tabique interauricular (4). Las técnicas más apropiadas para su diagnóstico son la tomografía axial y la resonancia magnética (1). Cardiólogos, radiólogos y patólogos deben considerarlo dentro del diagnóstico diferencial del paciente sintomático, asintomático, o de las muertes súbitas de origen no filiado (1).
CASO CLÍNICO
Mujer de 72 años con insuficiencia renal crónica, obesa y diabética insulinodependiente que acude a su médico de atención primaria por angor de esfuerzo. Es derivada al Servicio de Cardiología, donde se realiza un cateterismo cardíaco que demuestra una marcada disminución de flujo sanguíneo en las arterias descendente anterior y circunfleja, con desarrollo de circulación colateral. Además, la ecografía y la tomografía axial demuestran dilatación del ventrículo izquierdo y presencia de una masa en ventrículo derecho, no captante de contraste, que parece depender de la pared interauricular, y que estenosa la desembocadura de la vena cava superior. Se interviene quirúrgicamente, practicándose triple derivación coronaria, resección del tumor y de parte de la aurícula derecha, y reconstrucción cardíaca mediante parche de pericardio bovino. La paciente evoluciona favorablemente en el postoperatorio y es dada de alta a los 30 días de la intervención quirúrgica.
La resección quirúrgica del septo atrial incluyó dos fragmentos de tejido graso de aspecto lobulado respectivamente de 4 y 3 cm. de longitud máxima, que estaban parcialmente recubiertos por una membrana lisa y brillante (fig. 1). El estudio microscópico mostró pared auricular parcialmente tapizada por endotelio que presentaba una proliferación de células adiposas maduras (fig. 2), de características benignas, mezcladas con haces de músculo estriado cardíaco (fig. 3) y con adipocitos multivacuolados de tipo fetal (fig. 4). No se objetivaron signos de malignidad en el material remitido para estudio histológico.
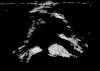
Fig. 1:
Imagen macroscópica de una de las piezas quirúrgicas que muestra un tejido
adiposo en relación directa con la superficie auricular.
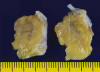
Fig. 2:
Imagen microscópica panorámica mostrando el tejido adiposo maduro situado por
debajo del endocardio auricular.
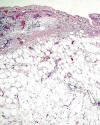
Fig. 3:
Tejido adiposo maduro disecando haces de miocardio.
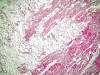
Fig. 4:
Detalle histológico mostrando adipocitos maduros y fetales mezclados con
miocitos.
DISCUSIÓN
Dentro del espectro de lesiones que afectan a la arquitectura del septo interauricular, la hipertrofia adiposa es la más frecuente (2). No existe un criterio estricto que defina la hipertrofia lipomatosa interatrial (1), aunque se considera anómalo el acúmulo de tejido adiposo que excede los 2 cm en la fosa ovalis (3,4). La primera descripción de esta lesión se hizo en un estudio postmortem en 1964 (1), el hallazgo antemortem es cada vez más habitual gracias al creciente desarrollo de las técnicas de imagen (1,3). La primera descripción antemortem se produjo en 1982 (1). Hoy en día, dicha lesión se detecta incidentalmente (3) en el 8% de los estudios ecocardiográficos y solamente en el 1% corresponde a hallazgos de autopsia (1,4).
El engrosamiento adiposo de la pared interauricular responde a un número anormalmente elevado (hiperplasia) de adipocitos tipo grasa parda que aparecen entrelazados con miocitos de origen cardíaco de gran tamaño (4). Varios estudios han relacionado la hipertrofia lipomatosa con la edad avanzada y la obesidad (1,4,7,8), ya que un tercio de los pacientes con esta patología son obesos, existiendo relación estadística entre el índice de masa corporal y el engrosamiento del septo interatrial (4). Asimismo resulta curiosa la relación existente entre la nutrición parenteral prolongada y la hipertrofia adiposa del septo interauricular (1), por lo que se baraja la posibilidad de que la lesión pueda ser debida a una alteración metabólica (4). No existen datos que muestren su relación con la anemia o la caquexia, lo cual resulta extraño, ya que estas patologías sí han sido relacionadas con el depósito de tejido graso pardo (4).
De naturaleza generalmente asintomática, puede debutar con arritmias cardíacas, obstrucción vascular, compromiso valvular o efecto masa que afecta preferentemente al lado derecho del corazón (1,2,6-8). Aparece más frecuentemente entre mujeres (2,3,8), y pacientes de edad avanzada, y aunque la enfermedad coronaria contribuye a la existencia de arritmias de tipo atrial, existen estudios que revelan que la causa de la arritmia es la hipertrofia lipomatosa por sí misma (4). No se ha podido constatar la existencia de factores que relacionen la hipertrofia adiposa del septo interatrial con la ateromatosis coronaria (4).
Al examen macroscópico el septo muestra acúmulo de tejido adiposo amarillento, no encapsulado, semejante al tejido graso epicárdico (2), que suele ser siempre mayor en la zona cefálica, por lo que el septo afecto adopta un aspecto de «campana» o «reloj de arena» (1-3). La mayoría de las veces la lesión se limita al atrio auricular y suele empujar hacia la cavidad cardíaca derecha (1,4) aunque existen casos documentados que revelan extensión hacia la pared libre del ventrículo izquierdo, tejido adiposo subepicárdico (1,3), raíz aórtica, pared lateral de la aurícula derecha y venas cavas (2). Cuando protruye hacia la aurícula el tejido suele estar recubierto en una de sus superficies por endocardio (2), como ocurre en este caso.
En el estudio histopatológico lo más característico resulta la mezcla entre adipocitos maduros, algunos de ellos de rasgos fetales, y células miocíticas de tipo cardíaco (2,4,6). Las células adiposas muestran ocasionalmente, citoplasma multivacuolado y núcleos localizados en la zona central, con llamativo aumento del número de mitocondrias (4). Estas células recuerdan al tejido adiposo pardo cuya función es principalmente energética generando calor durante el periodo postnatal precoz (5) y que puede encontrarse en el paciente mal nutrido o caquéctico (4). Además, entre el tejido adiposo, pueden observarse haces musculares estriadas compuestos por miocitos de tipo cardíaco, de tamaño anormalmente aumentado y de núcleos irregulares (4).
El diagnóstico diferencial incluye los sarcomas, especialmente los liposarcomas ya que los adipocitos multivacuolados pueden crear confusión con los lipoblastos (1,4,9). La diferencia reside en que, en contraste con los lipoblastos, las células de la hiperplasia lipomatosa del septo interatrial no suelen formar estructuras «en anillo de sello», ni contienen núcleos hipercromáticos (4). Los miocitos pueden confundir al patólogo ya que muestran características anormales, tanto en el tamaño como en el núcleo, planteándose en ocasiones la posibilidad de estar ante una lesión proliferativa (4).
Aunque la causa de la lesión no está del todo clara (8), algunas teorías intentan explicar su génesis en la existencia de células mesenquimales embrionarias en el septo interatrial que, tras ciertos estímulos, derivan en adipocitos (3).
Existen escasos casos diagnosticados mediante punción transvenosa. En tales casos y debido al escaso material que puede obtenerse, el hallazgo de tejido adiposo benigno concordante con clínica cardiópata son suficientes para el diagnóstico de hipertrofia lipomatosa cardíaca (4).
Debido al aumento del uso de técnicas de imagen, esta entidad se diagnostica cada vez más en pacientes vivos y de manera fortuita. Aunque esta patología puede objetivarse mediante ecografía transesofágica o por ecocardiografía, las técnicas más apropiadas son la tomografía axial y la resonancia magnética (1,2). Cuando la hipertrofia lipomatosa interatrial provoca clínica, el tratamiento que se plantea suele ser la escisión quirúrgica (4) con posterior reconstrucción de la pared por tejido sintético o de origen animal.
BIBLIOGRAFÍA
O´Connor S, Recavarren R, Nichols L, Parwani AV. Lipomatous Hypertrophy of the Interatrial Septum: an overview. Arch Pathol Lab Med 2006; 130: 397-9.
Cunningham KS, Veinot JP, Feindel CM, Butany J. Fatty Lesions of the Atria and Interatrial Septum. Human Pathology 2006; 37: 1245-51.
Burke A, Virmani R. Tumors of the Heart and Great Vessels. 16; 91-94. Atlas of Tumor Pathology, Series 3, Fascicle 16. Washington, DC: Armed Forces Institute of Pathology; 1995; 91-4.
Heyer CM, Kagel T, Lemburg S, Bauer TT, Nicolas V. Lipomatous hypertrophy of the interatrial septum: a prospective study of incidence, imaging findings and clinical symptoms. Chest 2003; 124: 2068-73.
Wheater PR, Burkitt HG, Daniels VG, editores. Functional histology: A text and colour atlas. Edinburgh: Churchill Livingstone; 1987; 60.
Fletcher CDM. Diagnostic Histopathology of Tumors. 2nd edition. Vol I. London: Churchill-Livingstone; 2000; 24-5.
Ayan K, Boeck B, Schaap AJ, Cramer MJ. Lipomatous hypertrophy of the interatrial septum. Int J Cardiovasc Imaging 2005; 21: 659-61.
Xanthos T, Giannakopoulos N, Papadimitriou L. Lipomatous hypertrophy of the interatrial septum: a pathological and clinical approach. Int J Cardiol 2007; 121: 4-8.
Riva L, Banfi C, Gaeta R, Vigano M. Lipomatous hypertrophy of the interatrial septum. Description of a clinical case and literature review. Minerva Cardioangiol 2006; 54: 789-92.