
Vol. 41, n.º 3, 2008
REVISTA
ESPAÑOLA DE
Vol. 41, n.º 3, 2008 |
ORIGINALES
Maddi Garmendia, Ayman Gaafar, Carmen Etxezarraga, Aitziber Ugalde, José I. López1
Servicio de Anatomía Patológica, Hospital de
Basurto.
1 Departamento de
Anatomía Patológica. Hospital de Cruces. Universidad del País Vasco (EHU/UPV),
Bilbao. Plaza Cruzes-Gurutzeta, 12, 48902 Barakaldo.
joseignacio.lopez@osakidetza.net
RESUMEN
Antecedentes: La invasión de las vesículas seminales es un dato histológico de mal pronóstico en el cáncer de próstata. En la mayor parte de los casos es un hallazgo accidental ya que los pacientes con signos clínicos o histológicos de enfermedad extraprostática no se tratan mediante cirugía en la mayor parte de protocolos al uso. Nuestra intención es cuantificar este hallazgo histológico en una serie homogénea de prostatectomías radicales y correlacionarlo con los hallazgos en las biopsias previas. Métodos: Durante un periodo de 8 años (1998-2005), 363 pacientes con cáncer de próstata fueron tratados mediante prostatectomía radical en el Hospital de Basurto. Los pacientes fueron seleccionados para la cirugía en función de la combinación de la estadificación clínica, niveles de PSA sérico y datos obtenidos de la biopsia previa. Los datos obtenidos en las prostatectomías se correlacionaron (rho de Spearman) con varios hallazgos histológicos procedentes de las biopsias. Resultados: Se detectó invasión seminal en 37 pacientes (10,2%). La invasión microscópica de las vesículas seminales se correlacionó con los milímetros totales de cáncer (media 20 mm, r=0,397), con el número de focos de tumor (media 3,8, r=0,383), con la invasión de ambos lados prostáticos (r=0,256), con el índice de Gleason >7 (r=0,306), con la invasión perineural (r=0,318), y con el PIN de alto grado (r=0,142) en las biopsias, y con el índice de Gleason >7 (r=0,357), con el PIN de alto grado (r=0,211), con la extensión extraprostática (r=0,480), y con la invasión de márgenes quirúrgicos (r=0,287), invasión perineural (r=0,847), y afectación del ápex (r=0,307), en las prostatectomías. Conclusiones: La invasión de las vesículas seminales es un hallazgo frecuente en las piezas de prostatectomía radical, incluso después de una selección correcta de pacientes para cirugía. Este hallazgo histológico se correlaciona con parámetros de volumen tumoral, con la invasión bilateral, y con otros parámetros de mal pronóstico en el cáncer de próstata.
Palabras clave: Cáncer de próstata, invasión seminal, biopsia, prostatectomía radical, pronóstico.
SUMMARY
Background: Seminal vesicle invasion is a finding of bad prognosis in prostate cancer. Its discovery in radical prostatectomies is accidental in most cases because patients with clinical or histological evidence of extraprostatic disease are not surgically treated in most clinical protocols. Our aim is to quantify this finding in a homogeneous series of radical prostatectomies and to correlate it with core biopsy findings. Methods: Over an 8-year period (1998-2005), a total of 363 patients with prostate cancer underwent radical prostatectomy at Basurto Hospital. The combination of clinical staging, PSA levels and core biopsy data indicated the candidates for surgery. Data obtained in prostatectomies were correlated (Spearman’s rho) with several histological parameters in biopsies. Results: Radical prostatectomies showed seminal vesicle invasion in 37 cases (10.2%). Microscopic seminal vesicle invasion correlated with total millimetres of cancer (average 20 mm, r=0.397), number of tumour foci (average 3.8, r=0.383), bilateral invasion (r=0.256), Gleason Index (GI) >7 (r=0.306), perineurial invasion (r=0.318), and high grade PIN (HGPIN) (r=0.142) in biopsies, and with GI >7 (r=0.357), HGPIN (r=0.211), extraprostatic extension (r=0.480), and margin (r=0.287), perineurial (r=0.847), and apex (r=0.307) invasions, in prostatectomies. Conclusions: Seminal invasion is a frequent finding in prostatectomies, even after a correct selection of patients for surgery. This finding correlates to tumour volume parameters, bilateral invasion, and other morphologic parameters of bad prognosis in prostate cancer.
Keywords: Prostate cancer, seminal vesicle invasion, core biopsy, radical prostatectomy, prognosis.
INTRODUCCIÓN
El cáncer de próstata es el tumor maligno más frecuente entre la población masculina de los Estados Unidos de Norteamérica (1) y constituye un problema sanitario de primer orden en el mundo desarrollado para el cual se han diseñado múltiples modalidades terapéuticas (2-4). La elección de una de esas terapias depende en gran medida de la extensión tumoral en el momento del diagnóstico. La invasión de las vesículas seminales por el cáncer de próstata es un dato que sin ninguna duda ensombrece el pronóstico de los pacientes que la sufren. Por esta razón, se ha dedicado un gran esfuerzo a intentar descubrirla con fiabilidad antes de tomar cualquier decisión terapéutica (5-7). De hecho, se han desarrollado varios nomogramas clínicos que tratan de identificar los pacientes con avanzado estadio tumoral en el momento del diagnóstico (8,9).
La práctica clínica actualmente en boga distingue a los pacientes con cáncer de próstata en grupos de bajo y alto riesgo de comportamiento agresivo en función de varios parámetros clínicos e histológicos (10), que incluyen los niveles séricos de PSA, el índice de Gleason, el volumen tumoral, la extensión extraprostática y la invasión de las vesículas seminales. Dentro de espectro de terapias potenciales, la prostatectomía radical es la primera elección en los pacientes con enfermedad confinada al órgano. Sin embargo, a pesar del refinamiento progresivo que se está alcanzando en los últimos años en la estadificación del cáncer de próstata (11), la realidad demuestra que la invasión de las vesículas seminales aparece de manera inesperada en un número significativo de pacientes. Las cuantificación de este hecho es muy variable, oscilando en la literatura entre el 2% y el 22% (5,12-27) y permanece casi inalterable a pesar de la selección estricta de los criterios quirúrgicos.
Este trabajo pretende evaluar la incidencia y significado de la invasión de las vesículas seminales en una serie prospectiva de pacientes tratados de manera homogénea.
MATERIAL Y MÉTODOS
A lo largo de un periodo de 8 años, entre 1998 y 2005, en el Hospital de Basurto se realizaron 363 prostatectomías radicales siguiendo estrictos criterios consensuados en el Comité de Tumores Urológicos (tabla 1) (28). En todos los pacientes se realizó tacto rectal, se determinaron los niveles séricos de PSA, y se cuantificó el índice de Gleason en la biopsia transrectal como método de estadificación clínica previa a la terapia. Se practicó gammagrafía ósea a todos los pacientes asintomáticos con índice de Gleason >6 y con PSA sérico >10 ng/ml. A aquellos pacientes que presentaron PSA sérico >20 ng/ml se les realizó, además, radiografía de tórax y TAC abdomino-pélvico. En casos muy seleccionados, se realizó resonancia magnética con antena endorrectal para descartar rotura de la cápsula prostática o invasión de las vesículas seminales.

A todos los pacientes se les practicó entre 6 y 8 biopsias transrectales para llegar al diagnóstico, las cuales se remitieron en dos frascos, etiquetadas como lados derecho e izquierdo, al Laboratorio de Anatomía Patológica. Las biopsias se obtuvieron sin ayuda ecográfica muestreando la zonas periférica, transicional y central dependiendo de los hallazgos exploratorios y radiológicos previos. La longitud media de los cilindros obtenidos fue de 10 mm. Siguiendo recomendaciones previas (29), los cilindros de los lados derecho e izquierdo se procesaron de manera independiente en dos casetes. En cada caso se realizaron entre 24 y 36 cortes histológicos. La evaluación histológica de este material incluyó, entre otros parámetros, el índice de Gleason, el volumen tumoral, la bilateralidad de la afectación neoplásica, la invasión perineural, y el PIN de alto grado. El índice de Gleason se agrupó en 4 categorías (<7, 3+4, 4+3, >7). El volumen tumoral se cuantificó mediante la determinación del número de focos tumorales y mediante la suma total de milímetros de cáncer encontrados en todo el material remitido. En el caso de que un cilindro de próstata tuviera dos focos tumorales, se consideró como uno solo y se midió en conjunto desde los extremos de ambos.
Las piezas quirúrgicas de prostatectomía radical se remitieron en fresco y se procesaron siguiendo las recomendaciones del Colegio Americano de Patólogos (30). La evaluación histológica incluyó, entre otras variables, la estadificación (pT) de acuerdo a la edición de 2002 del American Joint Committee on Cancer (AJCC) (31), el índice de Gleason, el PIN de alto grado, la extensión extraprostática, la invasión de las vesículas seminales, el estado de los márgenes quirúrgicos, y la presencia de invasión perineural o del ápex. Siguiendo a Epstein y colaboradores (32), sólo se consideró invasión de las vesículas seminales la penetración neoplásica de la capa muscular propia de las mismas.
Los datos obtenidos fueron analizados mediante correlaciones de Spearman (SPSS 10.0 para Windows, Chicago, USA).
RESULTADOS
Un total de 37 pacientes (10,2%) mostraron invasión de las vesículas seminales en las piezas de prostatectomía radical. En 4 pacientes no se contó con el diagnóstico en las biopsias previas y la prostatectomía radical se realizó en base a criterios clínicos y radiológicos obvios. La edad media de los pacientes incluidos en la serie fue de 64 años (rango, 53-74).
La tabla 2 muestra los principales datos histológicos de estos pacientes obtenidos en las biopsias transrectales. La media de volumen tumoral estimado en número de focos tumorales fue de 3,813 (rango, 1-7) y la media de milímetros totales de cáncer, de 20 mm (rango, 3-58). Dichas cifras mostraron correlación (Spearman) de mediana intensidad con la invasión de las vesículas seminales en las prostatectomías radicales (r=0,397 y r=0,383, respectivamente). La comparación entre la media de volumen tumoral de pacientes con y sin invasión de vesículas seminales en la serie total de 363 casos también fue significativa (número de focos: 3,8 versus 2,1, p=0,024 y milímetros totales de tumor: 20 mm versus 8,4 mm, p=0,01). Otras correlaciones (Spearman) de mediana intensidad en relación con la invasión de las vesículas seminales incluyen la invasión bilateral del tumor (r=0,256), el índice de Gleason >7 (r=0,306), y la invasión perineural (r=0,318). El PIN de alto grado mostró una correlación de baja intensidad (r=0,142).
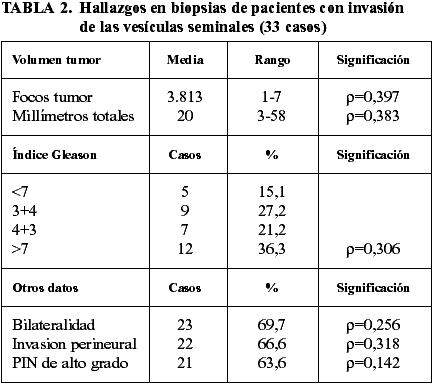
La tabla 3 muestra los principales datos de estos pacientes en la prostatectomía radical. Se observó correlación (Spearman) de alta intensidad entre la invasión de las vesículas seminales in la invasión perineural (r=0,847). La correlación fue de media intensidad entre la invasión de las vesículas seminales y la extensión extraprostática (r=0,480), el índice de Gleason >7 (r=0,357), el PIN de alto grado (r=0,211), y la invasión de los márgenes quirúrgicos (r=0,287) y del ápex (r=0,307). La correlación con la invasión vascular no fue significativa. La vaina estromal intraprostática del conducto eyaculador estaba invadida en 3 casos. Se realizó linfadenectomía de ganglios obturatrices en 19 casos (51,35%) y ninguno de ellos mostró siembra metastásica.
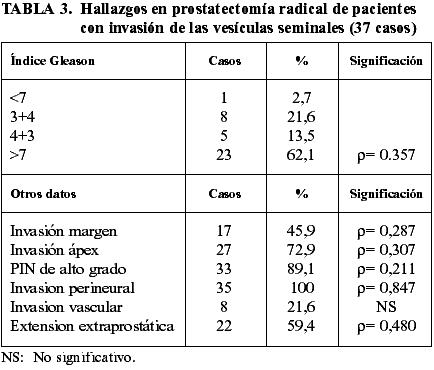
DISCUSIÓN
Los dos hallazgos que con mayor fiabilidad predicen la posibilidad de remisión en el cáncer de próstata son los márgenes negativos y la confinación al órgano del tumor. Existen de hecho múltiples estudios dirigidos a seleccionar a este grupo de pacientes antes de la toma de decisiones terapéuticas (5-7,9,12,13,16). Sin embargo, un número significativo de casos que presentan a priori enfermedad localizada y por lo tanto buen pronóstico muestran invasión ganglionar, extensión extraprostática, márgenes positivos y/o invasión de las vesículas seminales tras la cirugía. Estos hallazgos ominosos pueden no ser detectados incluso con las mejores técnicas diagnósticas y pueden aparecer en algún caso incluso tras una selección correcta de los pacientes para la cirugía. La tabla 4 muestra los datos disponibles en la literatura sobre la incidencia de la invasión de las vesículas seminales en las piezas de prostatectomía radical.
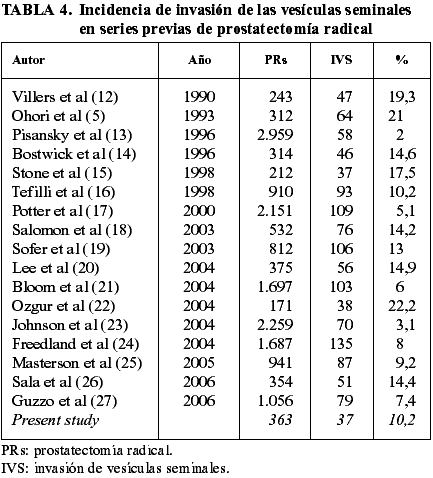
El primer paso para la identificación de una posible invasión de las vesículas seminales en el cáncer de próstata es clínico. El nivel sérico de PSA es probablemente el dato predictivo de invasión seminal más fiable. De hecho, Guzzo y cols (27), Salomón y cols (18), y Ozgur y cols (22) apoyan en trabajos recientes una opinión que ya estaba postulada por Pisansky y cols (13) desde hace más de una década en una serie de casi tres mil casos. Aunque algunos autores no están de acuerdo (23), la mayoría opina que las cifras de PSA sérico son también un parámetro muy fiable para detectar progresión tumoral en pacientes con invasión seminal en prostatectomías (19,21,33,34). Otros datos clínicos como edad, peso y estadio clínico no alcanzan significación estadística para este propósito según algunos autores (18).
Las técnicas de imagen han supuesto una aproximación reciente al dilema que supone la estadificación preoperatoria del cáncer de próstata (11,35,36). Los objetivos son variados, y cubren aspectos diagnósticos, pronósticos, y terapéuticos. Así, Sala y cols (26) han demostrado muy recientemente la exactitud de la resonancia magnética con antena endorrectal a la hora demostrar invasión seminal en una serie de 354 pacientes. Nguyen y cols (10), por otra parte, analizan el impacto que tiene la invasión seminal en la evolución de los niveles de PSA en 250 pacientes tratados con radioterapia externa. Sin embargo, no existe aún un método fiable de estadificación clínica del cáncer de próstata debido a que la invasión seminal puede ser en muchos casos muy sutil y focal.
Los datos histológicos obtenidos en las biopsias transrectales previas son también un elemento predictivo de invasión seminal de primer orden en la mayor parte de las series publicadas y el asunto es, en estos momentos, un tema de continuo debate entre patólogos (37). Varios estudios consideran al índice de Gleason (13,14,18,21, 23,24,38) y a las diferentes formas de medir el volumen tumoral (12,14,18,19,27,38) como los parámetros predictivos más fiables. Sin embargo, existe una gran controversia sobre su significado pronóstico y sobre cuáles de ellos, por separado o en combinación, son realmente indicativos de mal pronóstico (23,33).
Ohori y cols (5) en 1993 definió 3 tipos diferentes de invasión de las vesículas seminales y concluyó que este hallazgo puede no ser no uniformemente ominoso. El primer tipo (fig. 1A) es la extensión directa del cáncer a las vesículas seminales rompiendo la «capsula» prostática, lo cual está asociado a riesgo alto de metástasis ganglionares linfáticas y a mal pronóstico. El segundo tipo lo constituye la invasión seminal por vía interna, a través de la vaina estromal del ducto eyaculador (fig. 1B), lo cual parece estar asociado a un mejor pronóstico. Por fin, el tercer tipo corresponde a depósitos aislados de cáncer en las vesículas seminales sin evidencia de continuidad con el cáncer intraprostático (fig. 1C). El tema es confuso y está sujeto a controversias y debate en la literatura. Los ductos eyaculadores constituyen el así llamado espacio extraprostático invaginado dentro de la próstata (39) y su importancia en la diseminación del cáncer de esta glándula ha sido ya reconocida en la literatura radiológica (40). El tema ha sido recientemente contemplado desde el punto de vista anatomopatológico por Amin y cols (41).
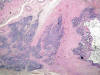
Fig. 1A:
Invasión seminal directa en la que el adenocarcinoma de próstata penetra en la
capa muscular de la vesícula seminal partiendo del tejido conectivo
periprostático (hematoxilina-eosina, x40).
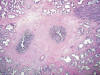
Fig. 1B:
Invasión marginal del manguito estromal del conducto eyaculador como paso previo
a la invasión seminal por vía interna (hematoxilina-eosina, x40).

Fig. 1C:
Invasión aislada y en pequeños nidos de la vesícula seminal sin evidencia de
extensión directa o interna asociada (hematoxilina-eosina, x40).
Masterson y cols (25) sostienen que la presencia de depósitos aislados de cáncer en las vesículas seminales no representa una verdadera invasión de las mismas ya que se necesita para ello una extensión extraprostática previa. Sin embargo, otros (41-43) han demostrado que la vía de extensión que utiliza el tejido estromal que rodea al conducto eyaculador es bastante común, llegando a ser la responsable exclusiva de invasión seminal en hasta el 9% de los casos según Amin y cols (43). Según estos mismos autores (41,43), los tumores que asientan en el tejido periuretral o en la banda anterior de la próstata son particularmente proclives a mostrar este tipo de diseminación. La importancia clínica de este tipo de invasión reside en su dificultad para ser detectado incluso con las técnicas radiológicas más finas y sensibles. Por otra parte, el patólogo debe tener en cuenta esta posibilidad y analizar «ex profeso» las piezas de prostatectomía radical (39).
En todo caso, la invasión seminal en el cáncer de próstata parece ser heterogénea en términos de comportamiento biológico. Muy probablemente sea conveniente subestratificar en el futuro la diseminación neoplásica fuera de la glándula en función de la ruta de invasión seminal y de la existencia o no de invasión ganglionar o de otros parámetros histológicos, al objeto de afinar más a la hora de emitir un pronóstico para este grupo de pacientes (5-7,16,24,25,44).
La búsqueda intencionada de la invasión seminal realizando biopsias transrectales de las vesículas es un proceder controvertido. Algunos autores (45) consideran útil esta estrategia. En nuestra opinión, esta manera de actuar puede ser recomendable para confirmar la invasión seminal en aquellos casos en los que exista sospecha clínica o radiológica.
CONCLUSIONES
La invasión de las vesículas seminales en el cáncer de próstata constituye un subgrupo heterogéneo de casos dentro de la categoría de enfermedad no confinada al órgano. Existen varios parámetros histológicos detectables en las biopsias transrectales que se ha demostrado que predicen la invasión seminal en las piezas de prostatectomía radical. En nuestra experiencia, el índice de Gleason, la medición del volumen tumoral, la afectación bilateral, la invasión perineural y el PIN de alto grado son parámetros relacionados con la invasión seminal.
BIBLIOGRAFÍA
Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2006. CA Cancer J Clin 2006; 56: 106-30.
Lu-Yao GL, McLerran D, Wasson J, Wennberg JE. An assessment of radical prostatectomy. Time trends, geographic variation, and outcomes. The Prostate Patient Outcomes Research Team. JAMA 1993; 269: 2633-6.
Chin JL, Downey DB, Onik G, et al. Three-dimensional prostate ultrasound and its application to cryosurgery. Tech Urol 1996; 2: 187-93.
Bolla M, Gonzalez D, Warde P, et al. Improved survival in patients with locally advanced prostate cancer treated with radiotherapy and goserelin. NEJM 1997; 337: 295-300.
Ohori M, Scardino PT, Lapin SL, et al. The mechanisms and prognostic significance of seminal vesicle involvement by prostate cancer. Am J Surg Pathol 1993; 17: 1252-61.
Debras B, Guillonneau B, Bougaran J, Chambon E, Vallencien G. Prognostic significance of seminal vesicle invasion on the radical prostatectomy specimen. Rationale for seminal vesicle biopsies. Eur Urol 1998; 33: 271-7.
Epstein JI, Partin AW, Potter SR, Walsh PC. Adenocarcinoma of the prostate invading the seminal vesicle: Prognostic stratification based on pathologic parameters. Urology 2000; 56: 283-8.
Ross RL, Scardino MW, Kattan A. A catalog of prostate cancer nomograms. J Urol 2001; 165: 1562-8.
López JI, Etxezarraga C. The combination of millimeters of cancer and Gleason index in core biopsy is a predictor of extraprostatic disease. Histopathology 2006; 48: 663-7.
Nguyen PL, Whittington R, Koo S, et al. Quantifying the impact of seminal vesicle invasion identified using endorectal magnetic resonance imaging on PSA outcome after radiation therapy for patients with clinically localized prostate cancer. Int J Radiat Oncol Biol Phys 2004; 59: 400-5.
Sanchez-Chapado M, Angulo JC, Ibarburen C, et al. Comparison of digital rectal examination, transrectal ultrasonography, and multicoil magnetic resonance imaging for preoperative evaluation of prostate cancer. Eur Urol 1997; 32: 140-9.
Villers A, McNeal JE, Redwine EA, Freiha FS, Stamey TA. Pathogenesis and biological significance of seminal vesicle invasion in prostatic adenocarcinoma. J Urol 1990; 143: 1183-7.
Pisansky TM, Blute ML, Suman VJ, et al. Correlation of pretherapy prostate cancer characteristics with seminal vesicle invasion in radical prostatectomy specimens. Int J Radiat Oncol Biol Phys 1996; 36: 585-91.
Bostwick DG, Qian J, Bergstralh E, et al. Prediction of capsular perforation and seminal vesicle invasion in prostate cancer. J Urol 1996; 155: 1361-7.
Stone NN, Stock RG, Parikh D, Yeghiayan P, Unger P. Perineural invasion and seminal vesicle involvement predict pelvic lymph node metastasis in men with localized carcinoma of the prostate. J Urol 1998; 160: 1722-40.
Tefilli MV, Gheiler EL, Tiguert R, et al. Prognostic indicators in patients with seminal vesicle involvement following radical prostatectomy for clinically localized prostate cancer. J Urol 1998; 160: 802-6.
Potter SR, Mangold LA, Shue MJ, et al. Molecular and immunohistochemical staging of men with seminal vesicle invasion and negative pelvic lymph nodes at radical prostatectomy. Cancer 2000; 89: 2577-86.
Salomon L, Porcher R, Anastasiadis AG, et al. Introducing a prognostic score for pretherapeutic assessment of seminal vesicle invasion in patients with clinically localized prostate cancer. Radiotherapy Oncol 2003; 67: 313-9.
Sofer M, Savoie M, Kim SS, Civantos F, Soloway MS. Biochemical and pathological predictors of the recurrence of prostatic adenocarcinoma with seminal vesicle invasion. J Urol 2003; 169: 153-6.
Lee HM, Solan MJ, Lupinacci P, et al. Long-term outcome of patients with prostate cancer and pathologic seminal vesicle invasion (pT3b): effect of adjuvant radiotherapy. Urology 2004; 64: 84-9.
Bloom KD, Richie JP, Schultz D, Renshaw A, Saegaert T, D’Amico AV. Invasion of seminal vesicles by adenocarcinoma of the prostate: PSA outcome determined by preoperative and postoperative factors. Urology 2004; 63: 333-6.
Ozgur A, Onol FF, Turkeri LN. Important preoperative prognostic factors for extracapsular extension, seminal vesicle invasion and lymph node involvement in cases with radical retropubic prostatectomy. Int Urol Nephrol 2004; 36: 369-73.
Johnson CW, McKiernan JM, Anastasiadis AG, et al. Prognostic indicators for long term outcome following radical retropubic prostatectomy for prostate cancer involving the seminal vesicles. Urol Oncol 2004; 22: 107-11.
Freeland SJ, Aronson WJ, Presti JC Jr, et al. Predictors of prostatic-specific antigen progression among men with seminal vesicle invasion at the time of radical prostatectomy. Cancer 2004; 100: 1633-8.
Masterson TA, Pettus JA, Middleton RG, Stephenson RA. Isolated seminal vesicle invasion imparts better outcomes after radical retropubic prostatectomy for clinically localized prostate cancer: Prognostic stratification of pT3b disease by nodal and margin status. Urology 2005; 66: 152-5.
Sala E, Akin O, Moskowitz CS, et al. Endorectal MR imaging in the evaluation of seminal vesicle invasión: diagnostic accuracy and multivariate feature analysis. Radiology 2006; 238: 929-37.
Guzzo TJ, Vira M, Wang Y, et al. Preoperative parameters, including percent positive biopsy, in predicting seminal vesicle involvement in patients with prostate cancer. J Urol 2006; 175: 518-21.
López JI, Abad T, Carrandi J, et al. La protocolización de la actividad asistencial: cáncer de próstata. Rev Urología 2004; 5: 117-20.
van der Kwast TH, Lopes C, Santonja C, et al. Guidelines for processing and reporting of prostatic needle biopsies. J Clin Pathol 2003; 56: 336-40.
Henson DE, Hutter RV, Farrow G. Practice protocol for the examination of specimens removed from patients with carcinoma of the prostate gland. Arch Pathol Lab Med 1994; 118: 779-83.
American Joint Committee on Cancer. AJCC Cancer Staging Manual, 6th edition, New York: Springer; 2002. p. 309-13.
Epstein JI, Carmichael M, Walsh PC. Adenocarcinoma of the prostate invading the seminal vesicles: definition and relation of the tumor volume, grade and margins of resection to prognosis. J Urol 1993; 149: 1040-5.
Ahlering TE, Skarecky DW, McLaren CE, Weinberg AC. Seminal vesicle involvement in patients with D1 disease predicts early prostate specific antigen recurrence and metastasis after radical prostatectomy and early androgen ablation. Cancer 2002; 94: 1648-53.
D’Amico AV, Whittington R, Malkowicz SB, et al. A multivariate analysis of clinical and pathological factors that predict for prostate specific antigen failure after radical prostatectomy for prostate cancer. J Urol 1995; 154: 143-4.
Jager GJ, Severens JL, Thornbury JR, et al. Prostate cancer staging: Should MR imaging be used? A decision analytic approach. Radiology 2000; 215: 445-51.
Okihara K, Kamoi K, Lane RB, et al. Role of systematic ultrasound-guided staging biopsies in predicting extraprostatic extension and seminal vesicle invasion in men with prostate cancer. J Clin Ultrasound 2002; 30: 123-31.
Egevad L, Allsbrook WC Jr, Epstein JI. Current practice of diagnosis and reporting of prostate cancer on needle biopsy among genitourinary pathologists. Hum Pathol 2006; 37: 292-7.
Epstein JI, Amin M, Boccon-Gibod L, et al. Prognostic factors and reporting of prostate carcinoma in radical prostatectomy and pelvic lymphadenectomy specimens. Scand J Urol Nephrol Suppl 2005; 216: 34-63.
Lopez JI. Anatomía microscópica de los conductos eyaculadores. Implicaciones clínicas en el cáncer de próstata. Res Esp Patol 2007; 40: 182-7.
Lee F, Torp-Pedersen ST, McLeary RD. Diagnosis of prostate cancer by transrectal ultrasound. Urol Clin North Am. 1989; 16: 663-73.
Amin MB, de Peralta-Venturina M, Killeen TC, et al. Pathologic significance of the invaginated extraprostatic space involvement by prostate carcinoma. A study of 79 cases of stage T3b prostatic carcinomas (Abstract). Mod Pathol 2005; 18: 579
Billis A, Stelini RF, Teixeira DA, et al. Seminal vesicle invasion in radical prostatectomies: which is the most common route of invasion? (Abstract). Lab Invest 2006; 86: 596.
Amin MB, Venturina M, Goldstein N, et al. The incidence and significance of the invaginated extraprostatic space (IES) involvement by prostatic carcinoma (PCA) in a series of 310 radical prostatectomies (Abstract). Lab Invest 2006; 86: 583.
Salomon L, Anastasiadis AG, Johnson CW, et al. Seminal vesicle involvement after radical prostatectomy: Predicting risk factors for progression. Urology 2003; 62: 304-9.
Deliveliotis CH, Varkarakis J, Trakas N, et al. Influence of preoperative vesicle biopsy on the decision for radical prostatectomy. Int Urol Nephrol 1999; 31: 83-7.