
Vol. 41, n.º 3, 2008
REVISTA
ESPAÑOLA DE
Vol. 41, n.º 3, 2008 |
CASUÍSTICA
Francisco Javier Velasco Albendea1, M.ª del Mar Berenguel Ibáñez1, Purificación Aguilera Sánchez2, Francisco Manuel Ramos Pleguezuelos1, José Manuel Velasco Albendea3
1 Servicio de
Anatomía Patológica. Complejo Hospitalario Torrecárdenas. Paraje de
Torrecárdenas, s/n, 04009 Almería.
2 Servicio de Pediátria y Áreas Específicas. Complejo Hospitalario
Torrecárdenas. Almería.
3 Unidad de Medicina Familiar y Comunitaria del Centro de Atención
Primaria «Village Practice». Doncaster, Inglaterra.
fjvelasco@ono.com
RESUMEN
Introducción: La calcificación arterial idiopática de la infancia (CAII) es una entidad congénita extremadamente rara de curso evolutivo casi invariablemente fatal. Caso clínico: Presentamos un caso de estudio de autopsia clínica en recién nacido varón, pretérmino, de cuatro días de vida con un cuadro de hidrops fetal asociado simultáneamente a un síndrome de Down y a una calcificación arterial oclusiva generalizada y difusa, con desarrollo secundario de cardiomiopatía hipertrófica e isquemia miocárdica con fallo cardíaco congestivo refractario, necrosis isquémica transmural yeyunal con perforación y atrofia renal izquierda. Discusión: Se realiza correlación clínico-patológica y se describen los hallazgos más relevantes del estudio de necropsia.
Palabras clave: Calcificación arterial idiopática, síndrome de Down e hidrops fetal.
SUMMARY
Introduction: The idiopathic arterial calcification of the infancy is a congenital entity extremely rare whose evolutive course is invariably fatal. Case report: We present a study case of a clinical autopsy in a male preterm newborn of 4 days of life with hydrops fetalis simultaneously associated with Down’s syndrome and generalised diffuse occlusive arterial calcification with secondary development of hypertrophic cardiomyopathy and myocardial ischaemia with refractory congestive cardicac failure, transmural jejunal ischaemic necrosis with perforation and left renal atrophy. Discussion: Clinical-pathological correlation is performed and the most relevant findings of the necropsy are described.
Keywords: Idiopathic arterial calcification, Down’s syndrome, hydrops fetalis.
INTRODUCCIÓN
La calcificación idiopática de la infancia (CAII) es una patología congénita inusual, descrita por Bryant y White en 1901 (1,2), encontrando aproximadamente 160 casos descritos en la literatura científica hasta el año 2006 (1-10). Su etiología sigue siendo controvertida, implicándose principalmente, una alteración metabólica en relación a la elastina y a los pirofosfatos inorgánicos (2,3). El diagnóstico se realiza generalmente en estudios de autopsia, detectándose una calcificación arterial oclusiva difusa de vasos de tamaño mediano y grande con compromiso isquémico multivisceral, con especial relevancia en el daño isquémico cardíaco como causa principal de la muerte que, en la mayoría de los casos, acontece antes de los 6 meses (4,5,8). Numerosos casos revisados se asocian a hidrops fetal (4,9), como sucede en el caso que presentamos. Sin embargo, la coexistencia y / o asociación de la CAII con un Síndrome de Down no aparece recogida en la literatura.
CASO CLÍNICO
Recién nacido varón pretérmino de 33 semanas de edad gestacional con hidrops fetal. Madre multípara de 38 años con Diabetes Mellitus controlada, fórmula obstétrica (G-A-V): 2-0-2, ambos hijos sanos, grupo O Rh (–), con test de Coombs indirecto positivo, identificando anti D (título 1/8) y anti A (título 1/16). Estaba vacunada con anti D porque uno de los hijos fue Rh (+). Se realizaron ecografías a las 8 y 12 semanas de gestación sin detectar ningún problema. La madre rechazó la amniocentesis recomendada por la edad y no realizó su siguiente control ecográfico hasta las 32 semanas, que es cuando detectaron un feto macrosoma con sospecha de origen hidrópico. No se observó cardiopatía estructural ni disfunción biventricular en la ecocardiografía fetal efectuada una semana previa al nacimiento.
El parto fue con cesárea programada previo tratamiento esteroideo con 2 dosis de betametasona. El líquido amniótico era claro y el Test de Apgar de 4/7, realizando intubación en paritorio inmediata al nacimiento (reanimación tipo IV). Los exámenes complementarios posnatales en UCI-Pediátrica revelaban los siguientes resultados: Serología TORCH, CMV y Parvovirus B19: negativas. Cariotipo: Trisomía 21 primaria (47, XY, + 21). Hemograma: 70000 leucocitos con formula normal (10% de reticulocitos en frotis periférico), hemoglobina de 13 gr/dl y 125000 plaquetas, estudio de coagulación alterado con Tiempo de Protrombina de 29 seg., Actividad de Protrombina de 40% y TPTA normal. Grupo sanguíneo A Rh (+) con Test de Coombs directo negativo. Proteínas totales de 2,54 g/dl, GOT 757 y GPT 176 con bilirrubina total de 5, 94 y BD de 1,87. La ecocardiografía demostró cámaras derechas muy dilatadas con función contráctil conservada, sin obstrucción al tracto de salida de ventrículo izquierdo ni del ventrículo derecho, aorta sin datos de coartación, arteria pulmonar dilatada, derrame pericárdico leve sin datos de compromiso hemodinámico y presión pulmonar aumentada de 30-35 mmHg. La ecografía abdominal confirmó abundante ascitis intraabdominal y edema en partes blandas, apreciándose una ecogenicidad vascular alterada que sugería un engrosamiento de la pared de aorta abdominal y sus ramas. El riñón izquierdo estaba disminuido de tamaño con hiperecogenicidad cortical.
La evolución fue hacia insuficiencia respiratoria, insuficiencia renal con anuria permanente, hipotensión arterial, hipoproteinemia, hipoglucemia, anemia que precisó transfusión de concentrado de hematíes con deterioro brusco al 4.º día, desaturación importante, bradicardia y fracaso cardiorrespiratorio que no remontó con maniobras de reanimación básica y avanzada.
HALLAZGOS NECRÓPSICOS
Examen externo y apertura de cavidades
Recién nacido varón de 3.250 gramos («P > 90»), 44 cm de longitud vértex-talón, 33 cm de longitud vértex-cóccix, 33 cm de perímetro craneal y 6,5 cm de longitud plantar con ligero tinte ictérico, y edema masivo y generalizado del tejido celular subcutáneo (espesor de 1,5 cm).
Cuello corto, hendiduras palpebrales inclinadas hacia arriba, pliegue epicántico ligeramente pronunciado, orejas de implantación baja y lóbulos de la orejas pequeños con antehélix prominente. El surco simiesco palmar y la separación del primer y segundo dedos del pie, quedaban atenuados y mal definidos por el intenso edema.
A la apertura de cavidades se reconocen derrames intensos serosos en pleura, pericardio y cavidad peritoneal.
El corazón mostraba cardiomegalia (peso del corazón 22,5 gramos [condición normal 10,2 ± 2 gr al las 33 semanas]), con hipertrofia ventricular derecha (pared de ventrículo derecho de 0,8 cm [condición normal a término: 0,5-0,6 cm]) y dilatación de arteria pulmonar. Existía concordancia atrio-ventricular y ventrículo-vascular, con ausencia de anomalías estructurales valvulares y del tabique IV. El foramen ovale y el ducto arterioso se encontraban permeables con drenaje venoso de venas pulmonares dentro de la normalidad.
Se observó engrosamiento vascular mural desde la arteria aorta y sus principales ramas hasta la bifurcación de arterias ilíacas con rigidez, crepitación, irregularidad de la superficie interna con extensos depósitos de apariencia cálcica laminares y variable compromiso luminal (fig. 1). Las arterias coronarias eran netamente prominentes en la superficie cardiaca (fig. 2), visualizándose ostium coronario derecho e izquierdo.

Fig. 1:
Silueta calcificada del árbol arterial pulmonar, aorta y ramas coronarias.
Imagen radiológica obtenida con posterioridad a la disección posmortem y tallado
patológico.
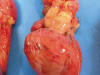
Fig. 2:
Visión ventral del corazón y grandes vasos. Cardiomegalia con ramas principales
de arterias coronarias prominentes en la superficie cardíaca.
En intestino delgado se identificó una perforación reciente de 4 mm ubicada en yeyuno de bordes evertidos y asociada a un segmento intestinal de coloración pardo-rojiza y apariencia isquémica con reacción peritoneal y salida de material meconial (fig. 3).
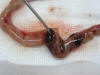
Fig. 3:
Segmento de intestino delgado yeyunal con isquemia y perforación.
Hígado aumentado de tamaño (98,3 gr [condición normal: 58 ± 17 gramos en 33 semanas]) tenso y congestivo.
El timo y el riñón izquierdo eran de pequeño tamaño y atróficos (timo de 2,3 gramos [condición normal: 4,8 ± 1,5 gramos en 33 semanas]) y (riñón de 3,8 gr. [condición normal: 15,3 ± 5,1 de peso combinado renal a las 33 semanas]). El riñón izquierdo mostró un área de infarto sin cambios de transformación quística macroscópica y ligera dilatación del sistema pielocalicial homolateral. El riñón derecho, los uréteres y la vejiga eran normales.
El cerebro era blando, ligeramente edematoso (297 gr. [condición normal: 216 ± 51 a las 33 semanas]), con circunvoluciones poco pronunciadas, ausencia de cierre de ínsula y mala definición entre sustancia gris y blanca. Las estructuras vasculares del polígono de Willis no presentaron alteraciones destacables.
Estudio histológico
El estudio histológico mostró una lesión que afectaba a las arterias elásticas (aorta y pulmonar, y sus ramas), a las arterias musculares principales y a las intraviscerales de la mayoría de los órganos, excepto las del sistema nervioso central.
El sustrato morfológico consistía en engrosamiento, fibrosis y esclerosis de la íntima con refuerzo fibroso de capa media en los distintos tipos de arterias. Adicionalmente, se identificó fragmentación y calcificación extensa circunferencial o parcelar de la lámina elástica interna y externa en arterias musculares (fig. 4), de la lámina elástica interna en arterias intraviscerales y grandes arteriolas, así como, desorganización, rotura y calcificación grosera de las láminas fenestradas de elastina de la capa media de arterias elásticas (fig. 5). Aisladamente se observaron células gigantes multinucleadas y escasa respuesta inflamatoria asociada en relación a las fibras elásticas (fig. 6).
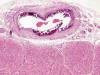
Fig. 4:
Sección transversal de arteria coronaria con calcificación mural circunferencial
y oclusión luminal (HE x25).
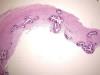
Fig. 5:
Calcificación grosera de la pared de una arteria elástica (HE x25).
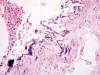
Fig. 6:
Calcificación y
fragmentación de lámina elástica interna arterial con presencia de una célula
gigante multinucleada sin respuesta inflamatoria añadida (HE x40).
Se identificaron focos de necrosis miocárdica coagulativa con miocitólisis y presencia de polinucleares neutrófilos marginales (fig. 7), necrosis isquémica-hemorrágica yeyunal transmural y segmentaria con perforación, y lesiones isquémicas e infartos renales evolucionados.
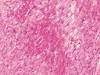
Fig. 7:
Isquemia miocárdica con
foco de necrosis coagulativa miocárdica y miocitólisis (HE x40).
El grado de desarrollo pulmonar era correlacionable con un estadio sacular (24-35 semanas), observando vasos de paredes gruesas con marcada calcificación circunferencial (fig. 8), focos de atelectasia y rotura de paredes de sacos alveolares, sin evidencia de formación de membranas hialinas ni focos de neumonía.
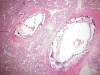
Fig. 8:
Intensa calcificación de
paredes de vasos arteriales en parénquima pulmonar (HE x10).
El grado de desarrollo renal fue concordante con la edad de gestación con formación de glomérulos y persistencia de zona nefrogénica parcheada, con notable atrofia córtico-medular isquémica en riñón izquierdo. Además, focalmente, en ambos riñones se evidenció dilatación del espacio de Bowman configurando numerosos gloméruloquistes (fig. 9).
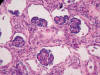
Fig. 9:
Glomeurloquistosis renal
(HE x40).
Hígado con notable hematopoyesis extramedular, signos de congestión pasiva crónica con dilatación sinusoidal, isquemia centrolobulillar y colestasis.
El timo mostraba calcificación de los corpúsculos de Hassall en mayor cuantía de lo habitual —hallazgo usual en trisomía 21—, y presencia de ocasionales microabscesos.
En sistema nervioso central, los vasos arteriales estaban indemnes, observando una lámina elástica interna íntegra y no calcificada.
DISCUSIÓN
La CAII es una entidad congénita muy rara que parece seguir un patrón de herencia autosómico recesivo (2,4), y en cuanto a su etiopatogenia, se han propuesto alteraciones en el metabolismo de la elastina y la existencia de una deficiencia de pirofosfatos inorgánicos (2), otorgándole a estos últimos, un papel regulador en el desarrollo de una CAII (4), y también, se han referido alteraciones en el metabolismo del hierro (2).
El diagnóstico en la mayoría de los casos se obtiene en estudios posmortem, siendo extraordinario su diagnóstico prenatal por imagen, y muy difícil atendiendo exclusivamente a su expresión clínica o a los datos de laboratorio, generalmente inespecíficos (4,5,10).
En el caso que describimos, la ecografía abdominal posnatal, indicaba una imagen de hiperecogenicidad de la pared de la aorta abdominal y sus ramas, pero el resto de datos clínicos aportados eran de poca utilidad para orientarnos hacia una CAII.
Su asociación a parto prematuro e hidrops fetal esta descrita (2,4,9), mostrando la CAII mayor expresión morfológica y consecutivamente clínica cuanto menor es el niño/a (10), explicando quizás de esta manera, algunas de las muertes intrauterinas de causa desconocida que no son remitidas para estudio anatomopatológico, y que podrían aumentar la casuística de esta patología. La muerte acontece usualmente antes de los 6 meses, y muy pocos sobrepasan el año (2,4) como consecuencia de isquemia miocárdica, insuficiencia respiratoria, hipertensión y fallo cardíaco refractario (2-4,7,8,10), coincidente con los hallazgos manifestados en nuestro caso.
La afectación isquémica multivisceral, con la excepción del territorio vascular del sistema nervioso central, esta recogida en la literatura (2,10), sin quedar especialmente claro el mecanismo por el cual, en la mayoría de los casos, no existe una alteración y calcificación de la lámina elástica en los vasos arteriales cerebrales.
Los glomeruloquistes detectados en ambos riñones sin traducción macroscópica son similares a los que aparecen en ciertos desordenes esporádicos o hereditarios, como en algunos ejemplos de riñones displásicos, en etapas iniciales de la enfermedad renal poliquística autosómica dominante, trisomía 13 y 18, esclerosis tuberosa, síndrome cerebrohepatorrenal de Zellweger y otros síndromes complejos (11,12). En nuestro caso podrían relacionarse con el síndrome de Down, una vez descartadas las otras patologías con datos clínico-morfológicos, familiares y genéticos, o quizás simplemente, considerar los quistes glomerulares en el contexto de una enfermedad glomeruloquística esporádica sin mayor trascendencia.
En cuanto al hidrops fetal, hay que plantear un origen multifactorial y complejo al concurrir varias patologías. La insuficiencia cardíaca derecha asociada a la CAII parece ser la causa principal. La situación de hipoproteinemia puede atribuirse a una disfunción hepática intraútero de naturaleza isquémica asociada a la CAII o consecutiva al fallo cardiaco —lo que podría justificar la hipertransaminasemia y las alteraciones en las pruebas de coagulación detectadas al nacer—, concediendo en este sentido a la disminución de proteínas, una participación causal en el hidrops. También hay que tener en cuenta en nuestro caso la trisomía 21, ya que es una cromosomopatía con asociación frecuente al hidrops, aunque sin una explicación patogénica clara (13-15). Y finalmente, aunque todo apuntaba a un hidrops no inmune, existía adicionalmente una incompatibilidad materno-fetal ABO y de Rh con anti A y anti D. Ciertamente, por un lado, la madre estaba vacunada con anti D y, por otro lado, la incompatibilidad ABO y Rh coincidente usualmente protege frente a la inmunización Rh (16), por lo que fue asumible una inmunización anti A materna con algún grado de hemólisis, como indicaron las cifras de bilirrubina y de hemoglobina. Además, parte de las cifras celulares de la leucocitosis podían corresponder a formas inmaduras de serie roja, como demostró la reticulocitosis en sangre periférica, registrándose erróneamente como leucocitos, y descartando inicialmente, la posibilidad de una reacción leucemoide asociada al Síndrome de Down. La hematopoyesis extramedular fetal pudo contribuir a mantener cifras de hematíes normales si la hemólisis era ligera, y aunque el test de Coombs directo en el niño fue negativo, en isoinmunización anti A puede serlo, por su menor sensibilidad, y no descarta la hemólisis. Todo lo anterior nos hace pensar que también hubo un componente inmune en el hidrops, aunque no determinante. La anemia que se desarrolló en la etapa posnatal con componente hemolítico —no infrecuente en la prematuridad— agravó el hidrops.
La CAII y la trisomía 21 se han relacionado al hidrops fetal de forma independiente (2,4,9,13-15), sin embargo, y esto es lo excepcional y lo interesante de nuestro caso, la presencia simultanea de la CAII y la trisomía 21 no esta referida en la literatura, quedando pendiente para estudios posteriores, si existe asociación entre ellas, o por el contrario y con mayor probabilidad, se trata de la coexistencia casual e incidental de estas dos entidades.
BIBLIOGRAFÍA
Bryan JH, White WH. A case of calcification of the arteries and obliterative endarteritis, associated with hydronephrosis in a child age six months. Guys Hosp Rep 1901; 55: 17.
Rodríguez LM, Álvaro E, Nieves C, Gómez MJ, García de la Fuente J. Calcificación arterial idiopática de la infancia: diagnostico posmortem de un recién nacido. An Esp Pediatr 2000; 52: 62-4.
Glatz AC, Pawel BR, Hsu DT, Weinberg P, Chrisant MR. Idiopathic infantile arterial calcification: two case reports, a review of the literature and a role for cardiac transplantation. Pediatr Transplant 2006; 10: 225-33.
Nagar AM, Hanchate V, Tandon A, Thakkar H, Chaubal NG. Antenatal detection of idiopathic arterial calcification with hydrops fetalis. J Ultrasound Med 2003; 22: 653-9.
Samson LM, Ash KM, Murdison KA: Aorto-pulmonary calcification: an unusual manifestation of idiopathic calcification of infancy evident antenatally. Obstet Gynecol 1995; 85: 863-5.
Kirchner SG, Heller RM, Kasselberg AG. Idiopathic arterial calcification of infancy. South Med J 1979; 72: 1328-30.
Morton R. Idiopathic arterial calcification in infancy. Histopathology 1978; 2: 423-32.
Moran JJ. Idiopathic arterial calcification of infancy: a clinicopathologic study. Pathol Annu 1975; 10: 393-417.
Jones DE, Pritchard KI, Gioannini CA, Moore DT, Bradford WD. Hydrops Fetalis associated with Idiopathic Arterial Calcification. Obstet Gynecol 1972; 39: 435-40.
Castro V, Vidal T, Domenech E, Martín-Herrera AI. Calcificación arterial idiopática de la infancia. Patología 1994; 27: 149-52.
Bernstein J, Risdon RA, Gilbert-Barness E. Renal System. In: Gilbert-Barness E, Editor. Potter´s Pathology of the fetus and Infant. St Louis: Mosby, 1997; 880-8.
Moragas A, Ballabriga A, Vidal MT. Riñón. En: Atlas de histopatología neonatal. Barcelona: Salvat, 1974; 95-119.
Machin GA. Hydrops, cystic hygroma, hydrothorax, pericardial effusions, and fetal ascites. In: Gilbert-Barness E, Editor. Potter´s Pathology of the fetus and Infant. St Louis: Mosby, 1997; 163-82.
Warsof SL, Nicolaides KH, Roedeck C. Immune and non immune hydrops. Clin Obstet Gynecol 1986; 29: 533.
Holzgrene W, Curry JR. Non immune hydrops fetalis: diagnosis and management. Semin Perinatol 1985; 9: 52.
Kumar V, Maitra A. Enfermedades de la infancia. En: Patología estructural y funcional. 7ª Ed. Madrid. Elsevier, 2005; 473-513.