
Vol. 41, n.º 4, 2008
REVISTA
ESPAÑOLA DE
Vol. 41, n.º 4, 2008 |
ORIGINALES
Pilar Soriano Sarrió, Ana Calatayud Blas, Franz Gunthner1, Samuel Navarro
Departamento de Patología. Universitat de
Valencia. Hospital Clínico Universitario.
1 Servicio de Urología.
pilarsoriano10@yahoo.es
RESUMEN
Antecedentes: Los tumores de células de Leydig son poco frecuentes (3% de las neoplasias testiculares). Presentan dos picos de incidencia, el 20% en niños y el 80% en adultos. Es bilateral en el 3% de los casos. Es frecuente asociarlo a criptorquídia, atrofia testicular e infertilidad. Material y métodos: Presentamos un estudio histopatológico, immunohistoquímico y clínico de siete casos de tumores de células de Leydig de testiculo diagnosticados en un periodo de 9 años (1998-2007). Resultados: La edad de presentación clínica de nuestros casos fue variable: 22 a 67 años (media 35). Debutando como orquiepididimitis (2), hidrocele (2), infertilidad (1), ginecomastia bilateral (1) o Sindrome adrenogenital. La mayoria de los tumores estaban localizados en teste izquierdo (5/7). Los marcadores tumorales en sangre fueron negativos aunque se detectaron importantes alteraciones en los niveles hormonales sobre todo de la testosterona así como de los estrógenos y la progesterona. En TAC no se observaron lesiones metastásicas ni adenomegalias. Como patologías importantes asociadas relacionadas con su etiopatogenia están: Sd. adrenogenital (1), déficit cortical primario (por enf de Addison o hiperplasia congénita adrenal) (1) y mielolipomas adrenales bilaterales (1). Histologicamente eran tumores muy semejantes excepto uno que presentaba un patrón hipernefroide. Immunohistoquímicamente expresaron vimentina, inhibina y melan A, apreciandose una expresión variable frente a marcadores neuroectodérmicos; tampoco expresaron marcadores hormonales. Conclusiones: El interés de estos casos es mostrar la complejidad de alteraciones clínicas asociadas a estos tumores, así como establecer un diagnóstico diferencial histológico con otros tumores.
Palabras clave: Tumor de células de Leydig, tumor de estroma testicular, ginecomastia, tumor benigno testicular, infertilidad, pubertad precoz.
SUMMARY
Background: Leydig cell tumors are infrequent (3% of testis neoplasms). There are two peaks of incidence: 20% developed in childhood and 80% in the adult life. They are bilateral in 3% of cases. Frequently they are associated to cryptorquidism, testicular atrophy and infertility. Material and methods: We present a histopathologic, immunohistochemical and clinical study of 7 cases of Leydig cell tumor of the testis diagnosed in a period of 9 years (1998-2007). Results: Age of presentation was variable: 22 to 67 years (mean 35). Clinically the presentation was orchyepididymitis (2), hydrocele (2), infertility (1), bilateral gynecomastia (1), and adrenogenital syndrome. The majority of tumors were located in left testis (5/7); tumor markers were negative, although important alterations of hormonal levels (testosterone, estrogens and progesterone) were detected. TC scanner did not reveal metastatic deposits or adenomegalies. Pathologic diseases related to the tumors were: adrenogenital syndrome (1), primary adrenal cortical defect due to Addison disease or congenital adrenal hyperplasia (1) and bilateral adrenal myelolipoma (1). Histopathologically, the pattern was similar in all cases except one, that present hypernefroid pattern. Immunohistochemically, the tumors expressed vimentin, inhibin and melan A, as well as a variable expression of neuroectodermal markers. Hormonal receptors were negative. Conclusions: The interest of this paper is to show the complex pattern of clinical presentation of these tumors, and to establish the differential diagnosis with other testicular tumors.
Keywords: Leydig cell tumor, stromal tumor of the testis, gynecomastia, benign testis tumor, infertility, precocious puberty.
INTRODUCCIÓN
Los tumores de células de Leydig son poco frecuentes (3% de las neoplasias testiculares) (1-7). Presentan dos picos de incidencia, el 20% en niños (5-10 años) (8) y el 80% en adultos (20-60 años) (2). En los niños suelen ser tumores más pequeños pues la detección clínica precoz de la producción androgénica se manifiesta por la pseudoprecocidad sexual (2). Es bilateral en el 3% de los casos (1,9). Es mas frecuente en criptorquidia, atrofia testicular e infertilidad y es casi exclusivo de la raza blanca (12). También se ha descrito antecedentes de historia familiar. En niños suelen debutar como pseudoprecocidad sexual (13) por producción androgénica (14), ginecomastia (10%) o virilización. En los adultos se suelen presentar como masa testicular o ginecomastia (30%) (2,16,17).
MATERIAL Y MÉTODOS
Presentamos un estudio clínico, histopatológico e immunohistoquímico de siete casos de tumores de células de Leydig de testículo diagnosticados en un periodo de 9 años (1998-2007) con un amplio seguimiento clínico. En todos los casos se realizó orquiectomía unilateral con tumorectomía y orquiectomía bilateral (en los dos casos de bilateralidad, respectivamente).
Las piezas quirúrgicas se fijaron con solución de formaldehído al 10% y se incluyeron en parafina obteniéndose cortes de 4 µ que se tiñeron con HE. El estudio inmunohistoquímico se realizó por método avidina biotina-peroxidasa (ABC) empleando anticuerpos monoclonales o policlonales contra vimentina, inhibina, melan A, receptores de andrógenos, receptores de progesterona, receptores de estrógenos, fosfatasa alcalina placentaria, citoqueratina AE1-AE3, antígeno de membrana epitelial, HNK-1, proteína S-100, cromogranina (Crom) y Ki 67 (tabla 1).
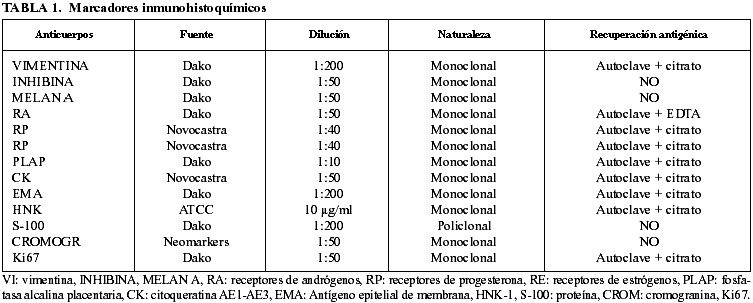
RESULTADOS
La edad de presentación clínica de nuestros casos fue variable: 22 a 67 años (media 35 a.). Debutando como orquiepididimitis (2), hidrocele (2), infertilidad (1), ginecomastia bilateral (1) o síndrome adrenogenital (1). La mayoría de los tumores estaban localizados en teste izquierdo (5/7), los dos restantes se localizaron en testículo derecho, siendo dos de ellos bilaterales. El tamaño tumoral oscilaba entre 4 y 0,5 cm (media 1,8 cm). En todos los casos, los marcadores tumorales fueron negativos aunque en todos ellos se detectaron importantes alteraciones en los niveles hormonales en sangre (generalmente hiperestrogenismo con testosterona en limites bajos, con cociente estrógenos/progesterona bajo). En TAC no se observaron lesiones metastásicas ni adenopatías de un tamaño significativo. Como patologías importantes asociadas relacionadas con su etiopatogenia están: síndrome adrenogenital (1), déficit cortical primario (por enfermedad de Addison o hiperplasia congénita adrenal) (1) y mielolipomas adrenales bilaterales (1).
Macroscópicamente son nódulos entre 0,5-4 cm bien circunscritos homogéneos, a veces lobulados, de consistencia carnosa, coloración amarilla o parduzca. Histológicamente son tumores muy semejantes mostrando población homogénea de células poligonales de citoplasma amplio eosinófilo denso de límites imprecisos con núcleo redondo central con nucleolo poco prominente excepto uno que presentaba un patrón hipernefroide mostrando células de amplio citoplasma claro granular. Immunohistoquímicamente todos ellos expresaron vimentina, inhibina y melan A, apreciándose una expresión variable frente a marcadores neuroectodérmicos, siendo el índice proliferativo bajo (1%-2%); tampoco expresaron marcadores hormonales a pesar de las evidentes alteraciones hormonales hematológicas (tabla 2). Se observó expresión de CK o S-100 en uno de nuestros casos, hecho que no invalida el diagnóstico.
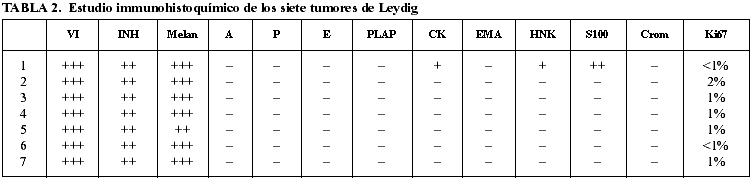
DISCUSIÓN
El interés de estos casos es mostrar tanto la escasa frecuencia de estos tumores como la complejidad de alteraciones clínicas asociadas a estos (2,7) y por último establecer un diagnóstico diferencial histológico con otras neoplasias o lesiones pseudotumorales como son: la hiperplasia de células de Leydig (usualmente es difusa y generalmente es un proceso no destructivo que preserva los túbulos seminíferos); tumor de células de Sertoli calcificante de células grandes (generalmente es bilateral, multifocal y frecuentemente asociado a calcificaciones, también puede mostrar crecimiento intratubular); la malacoplaquia (tiene infiltrados de histiocitos eosinófilos y calcificaciones citoplasmáticas que no son vistas en el tumor de células de Leydig), el seminoma (se suele asociar a neoplasia intratubular de células germinales y suele presentar el característico infiltrado linfoide y la reacción granulomatosa, ambos ausentes en el tumor de células de Leydig); la metástasis por un carcinoma prostático (la inmunotinción para PSA y fosfatasa alcalina puede ayudar en el diagnostico diferencial) y el tumor de células de Leydig maligno (suele ser un tumor grande con mas de 3 mitosis/10 campos de gran aumento, atipia nuclear, invasión vascular, bordes infiltrativos y necrosis). Esta última entidad requiere linfadenectomía retroperitoneal, con una supervivencia de 4 años pudiendo dar metástasis incluso 10 años después del diagnóstico, siendo la quimioterapia como la radioterapia ineficaces (18).
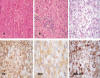
Fig. 1:
A, B y C: estudio histológico de HE (400x) mostrando el patrón habitual
del tumor de células de Leydig con ocasional presencia de lipofucsina
citoplasmática, ocasional presencia de agregados linfoides y patrón
hipernefroide respectivamente. VI, INH Y MELAN: intensa expresión
inmunohistoquímica citoplasmática de estos tumores para vimentina, inhibina y
melan A (400x).
El tratamiento de los tumores de células de Leydig suele ser quirúrgico, generalmente orquiectomía, ya que no hay criterios ecográficos que permitan diferenciar los tumores de células de Leydig benignos de los malignos. Wegner y colaboradores en 1997 compararon resultados del tipo de tratamiento quirúrgico, bien tumorectomía o bien orquiectomía (19), concluyendo que en tumores pequeños se podría realizar enucleación dada la escasa recurrencia de estos tumores.
CONCLUSIONES
El interés de estos casos es mostrar que a pesar de ser tumores benignos presentan una gran complejidad de alteraciones clínicas asociadas, sobre todo debido a las alteraciones hormonales provocadas y destacar también la nula expresión de receptores hormonales en los propios tumores, al menos en nuestros casos. También se debe establecer un diagnóstico diferencial histológico con otros tumores o lesiones pseudotumorales como son la hiperplasia de células de Leydig, tumor de células de Sertoli calcificante de células grandes, la malacoplaquia, el seminoma y la metástasis por un carcinoma prostático.
BIBLIOGRAFÍA
Conkey DS, Howard GC, Grigor KM, et al. Testicular sex cord-stromal tumours: the Edinburgh experience 1988-2002, and a review of the literature. Clin Oncol 17; 2005: 322-7.
Kim I, Young RH, Scully RE. Leydig cell testicular tumors of the testis: analysis of 40 cases and review of the literature. Am J Surg Pathol 1985; 9: 177-92.
Mati W, Lam G, Dahl C, Thorup Andersen J, Balslev E. Leydig cell tumour- a rare testicular tumour. Int Urol Nephrol 2002; 33: 103-5.
Rao SR, Mistry RC, Parikh DM. Leydig cell tumor: a case report and review of literature. Tumori 2002; 88: 75-6.
Mottola A, di Celo V, Saltutti C, et al. Leydig cell tumor of the testis. Therapeutic and anatomopathologic clinical study of 2 new cases. Arch Esp Urol 1989; 42: 433-5.
Roth LM, Anderson MC, Govan AD, et al. Sertoly-leydig cell tumors: a clinicopathologic study of 34 cases. Cancer 1981; 48: 187-97.
Kalfon A, Abram F, Kirsch-Noir F, et al. Leydig cell testicular tumors. A series of 10 observations. Prog Urol 1999; 9:299-304.
Dilworth JP, Farrow GM, Oesterling JE. Non germ cell tumors of testis. Urology 1991; 37: 399-417.
Slama A, Elleuch A, Yacoubi MT, et al. Bilateral Leydig cell tumor of the testis: a case report. Ann Urol 2003; 37: 213-6.
Heidenreich A, Moul JW, Srivastava S, et al. Synchronous bilateral testicular tumor: nonseminomatous germ cell tumours and contralateral benign tumours. Scand J Urol Nephrol 1997; 31: 389-92.
Abe T, Takaha N, Tsujimura A, et al. Leydig cell tumor of the testis presenting male infertility: a case report. Hinyokika Kilo 2003; 49: 39-42.
Dieckmann K-P, Loy V. Metachronous germ cell and Leydig cell tumor of the testis: do testicular germ cell tumors and Leydig cell tumors share common etiologic factors. Cancer 1993; 72: 1305-7.
Wilson BE, Netzloff ML. Primary testicular abnormalities causing precocious puberty leydig cell tumor, leydig cell hiperplasia and adrenal rest tumor. Ann Clin Lab Sci 1983; 13: 315-20.
Kirsch Aj, Bastian W, Cohen HL, et al 1993. Precocious puberty in a child with unilateral Leydig cell tumor of testis following orchiopexy. J Urol 1993; 150:1483-5.
Emory TH, Charborneau Jw, Randall RU, et al. Occult testicular intersticial-cell tumor in a patient with gynecomastia: ultrasonic lesion. Radiology 1984; 151: 474.
Bercovici JP, Tater D, Khoury s, et al. Leydig cell tumor with gynecomastia: hormonal effects of a estrogen-producing tumor. J Clin Endocrinol Metab 1981; 53: 1291-6.
Bertola G, Giambona S, Balza G, et al. An uncommon cause of gynecomastia: testicular Leydig cell tumor. Hormonal profile before and after orquiectomy. Recenti Prog Med 2006; 97: 85-8.
Urban MD, Lee Pa, Plotnick LP, et al. The diagnosis of leydig cell tumors. Surgical issues 1991; 67: 429-33.
Wegner HE, Dieckmann Kp, Herbst H, et al. Leydig cell tumor- comparasion o results of radical and testis- sparing surgery in a single center. Urol Int 1997; 59: 170-3.