
Vol. 41, n.º 4, 2008
REVISTA
ESPAÑOLA DE
Vol. 41, n.º 4, 2008 |
ORIGINALES
M.ª Asunción Arrechea Irigoyen1, Alicia Córdoba Iturriagagoitia1, Miren Vicuña Arregui2, José M.ª Martínez-Peñuela Virseda1
Hospital de Navarra. Pamplona.
1 Servicio de Anatomía Patológica.
2 Departamento de Digestivo.
mirenar@mixmail.com
RESUMEN
Antecedentes: Los perineuriomas en el tracto gastrointestinal se describieron por primera vez en el año 2005 como un subtipo especial de pólipos. Actualmente hay 15 casos descritos en la literatura con esta denominación. Material y métodos: Presentamos cuatro casos (tres mujeres y un hombre de edades comprendidas entre los 47 y 80 años) a los que les detectaron pólipos sésiles mediante colonospia y cuyo diagnóstico histológico fue de perineurioma. Resultados: El tamaño de los pólipos remitidos oscilaba entre 0,3 y 0,5 cm. Los pólipos mostraban una proliferación de células fusiformes, sin atipias, que se disponían en un patrón fascicular y en el epitelio presentaban cambios hiperplásicos. Las células expresaban EMA, Glut-1, claudina 1 y vimentina y mostraban negatividad para S100, c-kit, cromogranina, desmina y actina alfa músculo lisa. En dos de los casos, se obtuvieron muestras del material en parafina para estudio de ultraestructura observándose las características típicas del perineurioma. Discusión: Los perineuriomas gastrointestinales se presentan como pólipos, generalmente sésiles, que suelen ser detectados durante colonoscopias de cribado en pacientes asintomáticos. Se localizan preferentemente en colon y se observan con más frecuencia en mujeres. Teniendo en cuenta los criterios actuales de perineurioma, cabe suponer que muchos pólipos intestinales diagnosticados previamente como pólipos fibroblásticos y neurofibromas eran realmente perineuriomas. Se asocian con cambios hiperplásicos en el epitelio adyacente. Se desconoce si esta asociación es coincidencia o si el perineurioma induce la proliferación epitelial.
Palabras clave: Perineurioma, tracto gastrointestinal, colon, tumor de vaina nerviosa periférico.
SUMMARY
Introduction: Gastrointestinal perineuriomas were first described in 2005 as a special subtype of polyps. Currently, there are 15 cases described in the medical literature with such denomination. Material and methods: We present four cases, three females and one male, from 47 to 80 years, who had sessile polyps detected during colonoscopy, diagnosed histologically as intestinal perineuriomas. Results: The polyps ranged from 0.3 to 0.5 cm. Microscopically, they were composed of uniform, bland spindle cells with a fascicular growth pattern and they exhibited hyperplastic changes in the epithelium. Cells were positive for epithelial membrane antigen (EMA), Glut-1, claudin 1 and vimentin and negative for S-100 protein, C-kit, chromogranin and smooth-muscle actin. Electron microscopy was performed in two cases, revealing typical features of perineurioma. Discussion: Gastrointestinal perineurioma is a distinctive type of polyp frequently detected during screening colonoscopy as sessile lesions in asymptomatic patients. It appears they are most frequently seen in the colon and are more common in women. Taking into account the current criteria of perineurioma, it seems likely that many intestinal polyps previously diagnosed as fibroblastic polyps and neurofibromas are actually perineuriomas. They are frequently associated with hyperplastic changes in the adjacent epithelium. It is not known if this association is a coincidence or if the perineurioma induces the epithelial proliferation.
Keywords: Perineurioma, gastrointestinal tract, colon, peripheral nerve sheath tumour.
INTRODUCCIÓN
Los perineuriomas, descritos por primera vez por Lazarus y Trombetta en 1978 (1), son tumores benignos de la vaina nerviosa periférica compuestos exclusivamente por células perineuriales. Se caracterizan por presentar características inmunohistoquímicas y ultraestructurales semejantes a las de las células perineuriales normales. Los perineuriomas pueden ser intra o extraneurales. Los intraneurales se encuentran limitados a los nervios periféricos. Los extraneurales son más frecuentes que los intraneurales y se clasifican, a su vez, en esclerosante (2), reticular (3) y de partes blandas (4). La mayor parte aparecen en el tejido subcutáneo de tronco y extremidades. También se han descrito casos, menos frecuentemente, en dermis (5), partes blandas, retroperitoneo (6), cerebro (7), riñón (8,9) e intestino (10,11).
En el tracto gastrointestinal los perineuriomas son muy poco frecuentes y actualmente hay tan sólo 15 casos publicados con dicha denominación (10,11). En este artículo, presentamos cuatro nuevos casos y analizamos sus características morfológicas, inmunohistoquímicas y ultraestructurales.
DESCRIPCIÓN DE LOS CASOS
Casos clínicos
Las características clínicas se resumen en la tabla 1.
Caso 1
Mujer de 49 años, asintomática, con antecedentes familiares de carcinoma de colon. Es remitida a consulta de digestivo para cribado de carcinoma colorrectal. En la colonoscopia se resecan seis pólipos (dos pólipos hiperplásicos, un pólipo adenomatoso, dos lipomas subcutáneos y un pólipo fibroblástico). Una revisión posterior del pólipo fibroblástico con técnicas de inmunohistoquímica demostró que en realidad se trataba de un perineurioma de mucosa intestinal.
Caso 2
Varón de 47 años con antecedentes de resección de pólipos hiperplásicos y adenomatosos tubulovellosos. Acude a revisión refiriendo encontrarse asintomático. En la colonoscopia, se resecan tres pólipos (dos pólipos hiperplásicos y un perineurioma de mucosas).
Caso 3
Mujer de 59 años, que ingresa para estudio de diarreas. La colonoscopia muestra una mucosa con inflamación crónica inespecífica. Se reseca un pólipo de 0,3 cm con diagnóstico de perineurioma de mucosa intestinal.
Caso 4
Mujer de 80 años con antecedentes de cirrosis enólica, remitida a consulta de Digestivo por rectorragia intermitente de escasa cantidad y antecedentes de hemorroides. En la colonoscopia se detectan cuatro pólipos de 0,5 cm cada uno (dos pólipos hiperplásicos, un pólipo adenomatoso tubular y un perineurioma).
Material y métodos
Las muestras endoscópicas fueron fijadas de forma rutinaria en formol tamponado al 10%. Los bloques de parafina se cortaron a 4 micras y posteriormente se tiñeron con hematoxilina y eosina. Las técnicas de inmunohistoquímica se realizaron sobre cortes de parafina tras recuperación antigénica. Se utilizaron los siguientes anticuerpos diluidos: antígeno de membrana epitelial (EMA), claudina 1, Glut-1, actina alfa músculo lisa, desmina, vimentina, S100, c-kit, cromogranina, ki-67 y calponina (tabla 2). En dos de los casos, se obtuvieron muestras del material en parafina para estudio de ultraestructura.
Estudio histológico y ultraestructural
El tamaño de los pólipos resecados oscila entre 0,3 y 0,5 cm. Histológicamente, los cuatro casos muestran características histológicas semejantes (fig. 1). Muestran una proliferación de células fusiformes bipolares con núcleos redondeados u ovoides de bordes romos que se disponen en un patrón fascicular o arremolinado (fig. 2). No se observa atipia citológica ni mitosis (fig. 3). Las células expresan EMA de forma focal y vimentina, Glut 1, claudina 1 y calponina de forma difusa. El índice de proliferación con ki-67 es bajo (figs. 4 a 6). La proteína S100, el c-kit, la cromogranina, desmina y actina son negativos. En los cuatro, se observan cambios hiperplásicos en el epitelio tanto en el epitelio superficial como en las criptas atrapadas en la lesión (fig. 7).
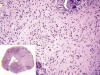
Fig. 1:
Proliferación de células fusiformes con núcleos
ovoides de bordes redondeados. (HE x200). En el margen inferior izquierdo, foto
panorámica del caso 1 (HE x20).
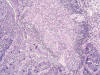
Fig. 2:
Células fusiformes bipolares con núcleos ovoides
que se disponen en un patrón fascicular o arremolinado (caso 4) (HE x100).
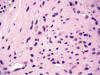
Fig. 3:
No se observa atipia citológica ni mitosis
(HEx400).

Fig. 4:
Las células expresan EMA de forma focal y
vimentina y calponina de forma difusa. El índice de proliferación es bajo.
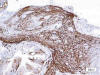
Fig. 5:
Las células expresan Glut 1 de forma difusa
(x200).
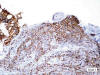
Fig. 6:
Las células expresan claudina 1 de forma difusa
(x200).
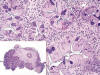
Fig. 7:
Cambios hiperplásicos en el epitelio de
superficie y en las criptas atrapadas en la lesión (HE x200). En el margen
inferior izquierdo, foto panorámica del caso 2 (HE x20).
En los dos casos en los que se obtuvo material para estudio electrónico, se observan abundantes vesículas de pinocitosis, procesos citoplasmáticos bipolares y lámina externa continua (fig. 8).

Fig. 8:
El estudio de ultraestructura muestra abundantes
vesículas de pinocitosis, procesos citoplasmáticos bipolares y lámina elástica
interna.
DISCUSIÓN
Los perineuriomas son tumores benignos, poco frecuentes, que derivan de las células perineuriales de la vaina nerviosa. En la literatura, hay muy pocos perineuriomas gastrointestinales descritos. Los diez primeros casos fueron descritos en el año 2005 por Hornick y colaboradores (10). Posteriormente, en el año 2006, Zamecnick (11) describió cinco nuevos casos. Basándonos en estos 15 casos y en los 4 descritos en este estudio, parece que la mayor parte de los perineuriomas intestinales se detectan durante colonoscopias de cribado en pacientes asintomáticos. Se observan con más frecuencia en mujeres de edad media y se localizan preferentemente en colon. Suelen presentarse como pólipos, generalmente sésiles, de pequeño tamaño (entre 0,2 y 0,6 cm), localizados sobre todo en la mucosa intestinal, aunque también pueden aparecer en submucosa. Histológicamente, están constituidos por una proliferación de células fusiformes, con citoplasmas pálidos y núcleos alargados u ovoides con bordes romos. No se observa atipia citológica, pleomorfismo celular, mitosis ni necrosis. De forma muy frecuente, se asocian con cambios hiperplásicos en el epitelio adyacente. Se desconoce si esta asociación es coincidencia (ya que los pólipos hiperplásicos son muy frecuentes) o si el perineurioma induce la proliferación epitelial (o viceversa) (10).
Tanto los estudios de inmunohistoquímica como los ultraestructurales resultan necesarios en el diagnóstico de los perineuriomas intestinales. Los perineuriomas tienen un inmunofenotipo semejante al de las células perineuriales normales. La mayoría muestran inmunorreactividad con en antígeno de membrana epitelial (EMA), colágeno tipo IV, laminina y vimentina y negatividad con S-100 (12). El EMA es un antígeno caracterizado de forma incompleta, presente en la superficie de diferentes células epiteliales. La expresión de EMA refleja los procesos citoplasmáticos de las células tumorales y, dado que estos procesos son muy finos, en muchas ocasiones, puede ser difícil de demostrar. Incluso con concentraciones de EMA superiores a las normalmente utilizadas, la tinción puede ser focal y/o débil (13). En la literatura, hay casos bien documentados de perineuriomas confirmados ultra estructuralmente que muestran negatividad con EMA (4,9). Es por ello por lo que recientemente se ha despertado un cierto un interés en el desarrollo de nuevos marcadores de diferenciación perineurial. Dos marcadores de diferenciación perineurial recientemente descritos son el Glut-1 (14) (transportador de glucosa eritrocitaria humana 1) y la claudina 1 (15). Y, aunque no son totalmente específicas de diferenciación perineurial, merece la pena añadir estas proteínas al panel en el estudio de tumores mesenquimales de aspecto neural, sobre todo en los casos en que el diagnóstico resulta difícil.
El Glut-1 es una proteína de transmembrana que facilita el transporte de glucosa y se expresa tanto en las células perineuriales de los nervios periféricos normales como en los perineuriomas (14). Se expresa además en muchas células normales, como linfocitos, eritrocitos y células del túbulo renal y también en diferentes tipos de carcinomas y sarcomas epitelioides. Hirose y colaboradores (14) estudiaron el patrón de expresión del Glut-1 y demostraron que la mayoría de los perineuriomas presentan una fuerte positividad. En cambio, se expresa sólo en la cápsula de los schwannomas y en muy ocasionales células de los neurofibromas.
Las claudinas son una familia de 20 proteínas homólogas que tienen una gran importancia funcional y estructural en las uniones estrechas. Las distintas claudinas se expresan de forma diferente en los tejidos; la claudina 3 se expresa de forma primaria en el epitelio pulmonar y hepático mientras que la claudina 5 se expresa principalmente en las células endoteliales (15). La expresión de la claudina 1 queda limitada a las células que forman uniones estrechas como epitelio, endotelio y células perineuriales y no está presente en otros tejidos mesenquimales. Recientemente, se ha demostrado la expresión de diferentes claudinas en tumores sólidos, como el carcinoma de ovario (16) y el sarcoma sinovial (17). La expresión de claudina 1 parece ser muy sensible y relativamente específica de los perineuriomas y se observa en más del 90% de los perineuriomas. Es un marcador de membrana y su expresión en los perineuriomas es más intensa y difusa que el EMA. También suele detectarse focalmente en la periferia de los neurofibromas y en la cápsula y células perivasculares de los schwannomas (15).
Ultraestructuralmente, los perineuriomas muestran células fusiformes con núcleos alargados y procesos citoplasmáticos bipolares, numerosas vesículas de pinocitosis, lámina basal discontinua y numerosas uniones celulares, incluyendo uniones estrechas (2,9). Los estudios genéticos moleculares y citogenéticos tienen todavía un valor limitado en el diagnóstico de los perineuriomas aunque pueden ser útiles para excluir otros diagnósticos diferenciales. Los estudios citogenéticos han demostrado que tanto los perineuriomas intra como extraneurales muestran alteraciones a nivel del cromosoma 22, sobre todo monosomía o delección de las bandas 22q11~q13.1 (18). Estudios recientes han mostrado alteraciones en el cromosoma 10q en perineuriomas esclerosantes (19).
El diagnóstico diferencial de los perineuriomas intestinales depende de la localización de los mismos. El diagnóstico diferencial de los perineuriomas gastrointestinales intramucosos debe establecerse con ganglioneuromas, neurofibromas, leiomiomas de la mucosa muscularis y pólipos fibroblásticos (10,11). Los ganglioneuromas están compuestos por células de Schwann S100 positivas, células ganglionares y axones. Expresan la proteína neurofilamento que es negativa en los perineuriomas intramucosos. Pueden presentarse como lesiones polipoides únicas, múltiples o difusas. Al igual que los perineuriomas intramucosos, suelen estar mal delimitados y proliferan entre las criptas colónicas. Los neurofibromas son poco frecuentes en el tracto gastrointestinal y generalmente se asocian a neurofibromatosis tipo 1. Están compuestos por células de Schwann, fibroblastos y células perineuriales que crecen entre las criptas de forma similar a los ganglioneuromas. Las células de Schwann se tiñen con S-100, que es negativo en los perineuriomas intramucosos. Los leiomiomas colorrectales son tumores del músculo liso que se originan en la muscularis mucosae. A diferencia de los perineuriomas intramucosos, los leiomiomas se encuentran bien delimitados, no atrapan criptas y contienen células fusiformes con citoplasma intensamente eosinófilo que se disponen en fascículos. Inmunohistoquímicamente, los leiomiomas son positivos para actina alfa músculo liso y desmina que son negativos en los perineuriomas intramucosos (6,10).
Los pólipos fibroblásticos benignos fueron recientemente descritos por Eslami-Varzaneh y colaboradores como proliferaciones de células fusiformes intramucosas que morfológicamente son muy parecidas a los perineuriomas. En estos casos, es importante la utilización de marcadores de diferenciación perineurial para llegar a un correcto diagnóstico. De hecho, hay casos descritos en la literatura, diagnosticados inicialmente como pólipos fibroblásticos (11) que, en realidad, utilizando técnicas de inmunohistoquímica y ultraestucturales han resultado ser perineuriomas intestinales. Uno de los casos que hemos descrito fue en principio diagnosticado como pólipo fibroblástico. En los pólipos fibroblásticos el EMA suele ser negativo (11). La ultraestructura también resulta útil en estos casos; la presencia de filamentos intermedios y la ausencia de lámina basal, cuerpos densos o vesículas de pinocitosis orientan el diagnóstico hacia pólipo fibroblástico (20,21).
Los principales diagnósticos diferenciales de los perineuriomas submucosos son los tumores de estroma gastrointestinal (GIST) y los schwannomas. Los GIST son más frecuentes en estómago y en intestino delgado pero también se pueden observar en otros lugares del tracto gastrointestinal, incluyendo colon. La negatividad del c-kit ayuda a diferenciar los perineuriomas de los GISTS. Los schwannomas intestinales son poco frecuentes. A diferencia de los schwannomas periféricos, los gastrointestinales (GI) no están encapsulados, son de la variedad celular y carecen de zonas de Antoni A y B y de los cuerpos de Verocay. A menudo están rodeados por un infiltrado inflamatorio, lo cual no es una característica de los perineuriomas. Inmunohistoquímicamente, los schwannomas GI son positivos con S100 y proteína glial ácida fibrilar mientras que los perineuriomas son EMA positivos y S100 negativos. Por otra parte, ultraestructuralmente las células de Schwann difieren de las células perineuriales en sus procesos celulares interdigitantes, formación de mesoaxones, lámina basal continua, ausencia de vesículas de pinocitosis y ausencia de uniones celulares (10).
Cabe suponer que, en el pasado, muchos casos diagnosticados como pólipos fibroblásticos, neurofibromas o pólipos hiperplásicos con reacción fibrosa adyacente eran realmente perineuriomas intestinales. El diagnóstico correcto de los perineuriomas intestinales es importante para evitar tratamientos innecesarios. Para ello a veces es necesaria la utilización de marcadores perineuriales (incluyendo Glut-1 y claudina 1) y un estudio ultraestructural que apoye el diagnóstico histológico de perineurioma intestinal. Por lo general, los perineuriomas GI no suelen recidivar una vez extirpados (10,11).
AGRADECIMIENTOS
A D.ª Julia Lorda Arteta y a D.ª Reyes Larumbe Valencia, Técnicos en Anatomía Patológica del Hospital de Navarra por su colaboración y asistencia técnica.
BIBLIOGRAFÍA
Lazarus SS, Trombetta LD. Ultrastructural identification of a benign perineurial cell tumor. Cancer 1978; 41: 1823-9.
Fetsch JF, Miettinen M. Sclerosing perineurioma: a clinicopathologic study of 19 cases of a distinctive soft tissue lesion with a predilection for the fingers and palms of young adults. Am J Surg Pathol 1997; 21: 1433-42.
Graadt van Roggen JF, McMenamin ME, Belchis DA, Nielsen GP, Rosenberg AE, Fletcher CD. Reticular perineurioma: a distinctive variant of soft tissue perineurioma. Am J Surg Pathol 2001; 25: 485- 93.
Giannini C, Scheithauer BW, Jenkins RB, et al. Soft-tissue perineurioma: evidence for an abnormality of chromosome 22, criteria for diagnosis, and review of the literature. Am J Surg Pathol 1997; 21: 164-73.
Robson AM, Calonje E. Cutaneous perineurioma: a poorly recognized tumour often misdiagnosed as epithelioid histiocytoma. Histopathology 2000; 37: 332-9.
Hornick JL, Fletcher CDM. Soft tissue perineurioma: clinicopathologic analysis of 81 cases including those with atypical histologic features. Am J Surg Pathol 2005; 29: 845-58.
Giannini C, Scheithauer BW, Steinberg J, Cosgrove TJ. Intraventricular perineurioma: case report. Neurosurgery 1998; 43: 1478-81.
Val-Bernal JF, Hernando M, Garijo MF, Villa P. Renal perineurioma in childhood. Gen Diagn Pathol 1997; 143: 75-81.
Kahn DG, Duckett T, Bhuta SM. Perineurioma of the kidney. Report of a case with histologic, immunohistochemical and ultrastructural studies. Arch Pathol Lab Med 1993; 117: 654-7.
Hornick JL, Fletcher CDM. Intestinal perineuriomas: clinicopathologic definition of a new anatomic subset in a series of 10 cases. Am J Surg Pathol 2005; 29: 859-65.
Zamecnik M, Chlumska A. Perineurioma versus fibroblastic polyp of the colon. Am J Surg Pathol 2006; 30: 1337-9.
Macarenco RS, Ellinger F, Oliveira AM. Perineurioma: A Distinctive and Underrecognized Peripheral Nerve Sheath Neoplasm. Arch Pathol Lab Med 2007; 131: 625-36.
Ariza A, Bilbao JM, Rosai J. Immunohistochemical detection of epithelial membrane antigen in normal perineurial cells and perineurioma. Am J Surg Pathol 1988; 12: 678-83.
Hirose T, Tani T, Shimada T, Ishizawa K, Shimada S, Sano T. Immunohistochemical demonstration of EMA/Glut1-positive perineurial cells and CD34-positive fibroblastic cells in peripheral nerve sheath tumors. Mod Pathol 2003; 16: 293-8.
Folpe AL, Billings SD, McKenney JK, Walsh SV, Nusrat A. Expression of claudin-1, a recently described tight junction-associated protein, distinguishes soft tissue perineurioma from potential mimics. Am J Surg Pathol 2002; 26: 1620-6.
Rangel LB, Agarwal R, D’Souza T, et al. Tight junction proteins claudin-3 and claudin-4 are frequently overexpressed in ovarian cancer but not in ovarian cystadenomas. Clin Cancer Res 2003; 9: 2567-75.
Billings SD, Walsh SV, Fisher C, Nusrat A, Weiss SW, Folpe AL. Aberrant expression of tight junction-related proteins ZO-1, claudin-1 and occludin in synovial sarcoma: an immunohistochemical study with ultrastructural correlation. Mod Pathol 2004; 17: 141-9.
Emory TS, Scheithauer BW, Hirose T, Wood M, Onofrio BM, Jenkins RB. Intraneural perineurioma: a clonal neoplasm associated with abnormalities of chromosome 22. Am J Clin Pathol 1995; 103: 696-704.
Brock JE, Perez-Atayde AR, Kozakewich HP, Richkind KE, Fletcher JA, Vargas SO. Cytogenetic aberrations in perineurioma: variation with subtype. Am J Surg Pathol 2005; 29: 1164-9.
Eslami-Varzaneh F, Washington K, Robert ME, Kashgarian M, Goldblum JR, Jain D. Benign fibroblastic polyps of the colon: a histologic, immunohistochemical, and ultrastructural study. Am J Surg Pathol 2004; 28: 374-8.
Groisman GM, Polak-Charcon S, Appelman HD. Fibroblastic polyp of the colon: clinicopathological analysis of 10 cases with emphasis on its common association with serrated crypts. Histopathology 2006; 48: 431-7.