
Vol. 41, n.º 4, 2008
REVISTA
ESPAÑOLA DE
Vol. 41, n.º 4, 2008 |
CASUÍSTICA
Francisco Javier Torres Gómez1, Francisco Javier Torres Olivera2, Amelia Torres Gómez1
1 Servicio de
Anatomía Patológica del Hospital de Alta Resolución de Utrera (Sevilla).
2 Servicio de Anatomía Patológica del Hospital Universitario Virgen
Macarena (Sevilla).
javiertorresgomez@yahoo.es
RESUMEN
Antecedentes: Los cordomas son lesiones neoplásicas recidivantes para cuyo diagnóstico raramente se recurre a la punción aspiración con aguja fina (PAAF). Métodos: Presentamos un caso de cordoma sacrocoxígeo haciendo hincapié en sus características citológicas. Resultados: Una adecuada correlación clínico-citológica asistida por los pertinentes estudios de imagen conducirán a un correcto diagnóstico en la mayoría de las ocasiones. Conclusiones: La citología presenta una efectividad diagnóstica similar a la histología en los casos típicos de cordoma.
Palabras clave: Cordoma, sacrocoxígeo, células fisalíferas.
SUMMARY
Introduction: Chordomas are neoplastic recurrent lesions barely diagnosed by fine needle aspiration (FNA). Material and methods: We report a case of sacrococcygeal chordoma addressing the cytological features. Results: Clinical and cytological correlation beside a good image study drive to a correct diagnosis in most cases. Conclusions: Cytology and histology have similar effectiveness in the diagnosis of typical chordomas.
Keywords: Chordoma, sacrococcygeal location, physaliferous cells.
INTRODUCCIÓN
Los cordomas son tumores relativamente infrecuentes (0,2% de los tumores del SNC, 2-4% de las neoplasias primarias de hueso) originados a partir de restos notocordales, que en humanos se localizan a nivel de cuerpos vertebrales y discos intervertebrales. Se trata de lesiones de crecimiento lento desarrolladas a nivel sacrocoxígeo (situación más habitual) o bien a nivel esfenooccipital representando ambas localizaciones los extremos de la columna vertebral y por tanto los lugares de más tardía regresión notocordal. Las localizaciones cervical, torácica y lumbar son hallazgos sumamente infrecuentes.
Se trata de neoplasias que no muestran predilección por uno u otro sexo y cuya edad de aparición se sitúa en torno a las décadas cuarta y quinta si bien han sido descritos en un amplio intervalo de edades.
Los cordomas de localización sacra-presacra generalmente son palpables en la exploración rectal siendo infrecuente la formación de una masa de tejidos blandos palpable en la exploración lumbar, situación descrita en tumores que alcanzan gran tamaño. Desde el punto de vista radiográfico, se trata de una lesión ósea lítica, frecuentemente calcificada, que se extiende a los tejidos blandos circundantes.
La localización lesional y las características radiológicas de la misma generalmente dirigen tanto el diagnóstico como el tratamiento. Sin embargo, en ocasiones se realiza, como en nuestro caso, una punción con el fin de resolver dudas diagnósticas.
CASO CLÍNICO
Paciente varón de 79 años al que se le realizó una punción a nivel sacrocoxígeo debido a la presencia de una lesión de varios meses de evolución cuyo estudio radiológico la caracterizó como osteolítica y heterogénea.
En los extendidos citológicos, teñidos con MGG, se pudieron observar múltiples células con amplios citoplasmas, muchos de ellos multivacuolados, con núcleo central sin atipias. Dicha población celular mostraba gran falta de cohesión, pudiéndose observar aislados grupos bidimensionales de moderado tamaño si bien predominaban las células sueltas en un fondo rico en matriz mixoide- mucoide basófila que no parecía estar en relación directa con las células (figs. 1, 2, 3, 4, 5 y 6). Estos hallazgos, junto a las características clínicas y radiológicas de la lesión, permitieron realizar el diagnóstico de cordoma. El paciente fue intervenido quirúrgicamente remitiéndose al Servicio de Anatomía Patológica una lesión mal delimitada, de contornos irregulares y un aspecto heterogéneo donde alternaban áreas de aspecto gelatinoso con otras de aspecto hemorrágico. La frecuente infiltración del hueso por la neoplasia había dificultado una completa exéresis quirúrgica.
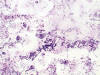
Fig. 1:
Cordoma. Células fisalíferas. Imagen panorámica
del frotis. Giemsa 200X.

Fig. 2:
Cordoma. Células fisalíferas. Imagen panorámica
del frotis. Pap 200X.

Fig. 3:
Cordoma. Detalle de las áreas más celulares.
Giemsa 200x.
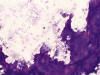
Fig. 4:
Cordoma. Interfase entre áreas celulares y matriz
mixoide acelular. Giemsa 200x.
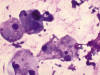
Fig. 5:
Cordoma. Detalle celular. Giemsa 400x.

Fig. 6:
Cordoma. Células y matriz. Detalle 400x.
El estudio histológico demostró la presencia de cordones y nidos celulares inmersos en un estroma de aspecto mixoide. Gran parte de las células mostraban gran tamaño y una morfología poligonal, con citoplasmas eosinofílicos intensamente vacuolados y un núcleo central de tamaño variable y cromatina vesicular. Estas células son conocidas como fisalíferas y se ha demostrado que son ricas en glucógeno intracitoplasmático. Asimismo se observó una segunda población celular de menor tamaño, igualmente poligonales (fig. 7). En el seno del estroma mixoide se observaron múltiples focos hemorrágicos así como áreas de diferenciación pseudo cartilaginosa si bien no se observaron verdaderos focos cartilaginosos que nos permitieran subclasificar la lesión como cordoma condroide (más frecuente a nivel occipital y asociado a un supuesto mejor pronóstico).
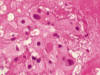
Fig. 7:
Cordoma. Imagen histológica. HE 400x.
El estudio inmunohistoquímico demostró positividad de las células tumorales para S100, citoqueratinas y EMA. En la literatura se han descrito igualmente positividades para catepsina K y para E-caderina siendo dispares los resultados obtenidos para el CEA (1,2).
DISCUSIÓN
Los cordomas son neoplasias infrecuentes descritas por Virchow en 1857, asignándoles la denominación de «encondrosis fisalífera» en virtud del gran parecido que poseen con tumores cartilaginosos. De hecho, pensó que era el cartílago el origen de los mismos. Sin embargo fue Ribbert en 1895 quien asignó un origen notocordal tras compararlos con el núcleo pulposo del disco intervertebral.
Como hemos observado, los cordomas son lesiones neoplásicas con personalidad propia cuyo diagnóstico definitivo puede ser alcanzado sin excesivas dificultades siempre que se realice un estudio escalonado y sistematizado. Al tratarse de lesiones infrecuentemente puncionadas, muchos patólogos no están familiarizados con los hallazgos citológicos obtenidos por PAAF y es por ello por lo que consideramos nuestro caso interesante. Hemos realizado extensiones simples que se han teñido con MGG, técnica tintorial con la que tenemos experiencia. Si bien el cuadro citológico que hemos obtenido es sumamente característico, en ocasiones existe un predominio de células eosinófilas que puede despistar; lo mismo ocurre con aquellos casos en los que predomina el componente mixoide o el de células claras, situaciones en las que a veces debemos ampliar el rango de diagnósticos diferenciales (3,4). Hoy día puede recurrirse, en aquellos centros que tengan acceso a ella, a la citología líquida para el estudio de este material, obteniendo extensiones a las que se pueden aplicar con facilidad técnicas inmunohistoquímicas que faciliten la caracterización lesional. En nuestro caso no contábamos con las mismas y por tanto no podemos facilitar imágenes a este respecto. Es conveniente en este caso recurrir al estudio histológico como paso preoperatorio o terapéutico.
Las peculiares características de la población tumoral, la localización y el curso localmente agresivo exhibido por la misma condicionan un diagnóstico diferencial principalmente con las metástasis de carcinoma renal (células claras), condrosarcoma con y sin células claras, adenocarcinoma con células en anillo de sello de distintos orígenes y ependinoma mixopapilar. El estudio histológico exhaustivo de la lesión junto al auxilio de las técnicas inmunohistoquímicas, teniendo en cuenta la peculiar localización, permitirán alcanzar el diagnóstico sin grandes inconvenientes.
Como ya ha sido detallado en la introducción, las células neoplásicas muestran positividad inmunocitoquímica e inmunohistoquímica para S100, citoqueratinas, EMA, catepsina K y E-cadherina. La positividad para S100 permite realizar el diagnóstico con carcinomas, negativos para este marcador; la positividad para citoqueratinas permitirá hacer lo propio con el condrosarcoma. En el caso de meningiomas de células claras o ependimomas es conveniente completar el panel. También habrá que tener en cuenta la característica tinción con PAS de las células fisalíferas así como la tinción Azul Alcián, mucicarmín o Azul de Toloudina de la matriz tumoral, complemento fundamental para alcanzar el diagnóstico.
Debido a sus peculiaridades, los cordomas muestran una alta tasa de recidivas; en parte ello se debe a la exéresis incompleta, habitual en las lesiones que afectan al hueso en esta localización. Parece ser que la expresión de marcadores pronósticos tales como p53 y ki67 se relaciona directamente con una mayor tasa de recurrencias (5). En ocasiones, las células neoplásicas adquieren en las recidivas una morfología fusocelular, pleomórfica o sarcomatoide que consecuentemente dificultan el diagnóstico si bien una correcta anamnesis o el conocimiento de los antecedentes médicos y quirúrgicos permitirán en la mayoría de los casos obviar este obstáculo diagnóstico (6).
La tasa de supervivencia a los cinco años se estima en torno al 50%. A los diez años cae hasta el 35%. Como hemos visto la agresividad principalmente se manifiesta a nivel local.
Por último quisiéramos destacar el papel que la PAAF ha jugado en el diagnóstico de cordomas extraesqueléticos, lesiones que en la mayoría de los casos presentan frotis muy similares a los descritos en nuestro caso (7,8).
BIBLIOGRAFÍA
Kontozoglou T, Oizilbash AH, Sianos J, Otead R. Chordoma: cytologyc and immunocytochemical study of four cases. Diagn Cytopathol 1986; 2: 55-61.
Plaza JA, Ballestin C, Perez Barrios A, Martinez MA, de Agustin P. Cytologic, cytochemical, immunocytochemical and ultrastuctural diagnosis of a sacrococcygeal chordoma in a fine needle aspiration biopsy specimen. Acta Cytol 1989; 33: 89-92.
Nijhawan VS, Rajwanshi A, Das A, Jayaram N, Gupta SK. Fine-needle aspiration cytology of sacrococcygeal chordoma. Diagn Cytopathol 1989; 5: 404-7.
Walaas L, Kindblom LG. Fine-needle aspiration biopsy in the preoperative diagnosis of chordoma: a study of 17 cases with application of electron microscopic, histochemical and immunocytochemical examination. Hum Pathol 1991; 22: 22-8.
Naka T, Boltze C, Kuester D, Schulz TO, Schneider-Stock R, Kellner A, et al. Alterations of G1-S checkpoint in chordoma: the prognostic impact of p53 overexpression. Cancer 2005; 104: 1255-66.
Saiz A, de Agustín P, Barrios AP, Alberti N. Fine needle aspiration of a chordoma and its recurrente 19 years after. Diagn Cytopathol 2006; 34: 663-4.
Bouvier D, Raghuveer CV. Aspiration cytology of metastatic chordoma to the orbit. Am J Ophthalmol 2001; 131: 279-80.
Koybasioglu F, Simsek GG, Onal BU, Han U, Adabag A. Oropharyngeal chordoma diagnosed by fine needle aspiration: a case report. Acta Cytol 2005; 49: 173-6.