
Vol. 42, n.º 2, 2009
REVISTA
ESPAÑOLA DE
Vol. 42, n.º 2, 2009 |
ORIGINALES
César Lacruz Pelea, Marta Muñoz Fernández de Legaria
Servicio de Anatomía Patológica, Hospital General Universitario Gregorio Marañón. C/. Dr. Esquerdo, 46. 28007 Madrid.
RESUMEN
Objetivos: El propósito de este estudio ha sido determinar la prevalencia de los tipos de virus del papiloma humano (VPH) implicados en lesiones de cérvix uterino en la Comunidad de Madrid, con dos finalidades: valorar el beneficio que proporcionará la próxima implantación de la vacuna anti-VPH tetravalente (tipos: 6, 11, 16 y 18) y tratar de establecer prioridades para el desarrollo de una segunda generación de vacunas. Material y métodos: Se incluyeron en el estudio 1026 biopsias con lesión de cérvix, recogidas en un periodo de tres años (2005-2007), de las cuales se seleccionaron los casos que cumplieron 3 requisitos: demostración histológica de lesión escamosa intraepitelial (SIL) o carcinoma invasor, presencia de ADN viral por reacción en cadena de polimerasa (PCR) y tipificación de al menos un tipo viral de VPH. Resultados: De los 331 casos que cumplían estos 3 requisitos, en el 86% se aislaron virus de alto riesgo y en el 14% de bajo riesgo. Los virus de alto riesgo prevalentes fueron: 16 (34%), 31 (12%), 58 (10%), 33 (8%), 52 (8%), 18 (7%), 66 (6%) y 53 (6%) y los de bajo riesgo: 6 (58%) y 11 (36%). No se observaron variaciones significativas en la distribución de los tipos virales durante los tres años del periodo de estudio. Conclusiones: Sin tener en cuenta la posibilidad de reacciones de inmunización cruzadas, la implantación de la vacuna tetravalente en nuestro medio protegería frente al 94% de las lesiones causadas por genotipos de bajo riesgo y frente al 41% de las causadas por genotipos de alto riesgo. Para que la vacunación tenga un fuerte impacto en la carga de la enfermedad y poder prescindir del cribado se necesitarán nuevas vacunas con propiedades mejoradas.
Palabras clave: Lesión de cérvix, virus del papiloma humano, prevalencia, vacunas, cribado ginecológico.
SUMMARY
Objectives: The object of the current study was to determine the prevalence of human papillomavirus (HPV) types associated with uterine cervical lesions in the metropolitan area of Madrid for two reasons: to assess the benefit of impending implementation of the anti-HPV tetravalent vaccine (6, 11, 16 and 18 types) and to attempt to establish priorities for the future development of second generation vaccines. Materials and Methods: From a total of 1026 biopsies from cervical lesions collected in a three year period (2005-2007), 331 specimens were selected that fulfilled the following 3 requirements: histological evidence of squamous intraepithelial lesions (SIL) or invasive carcinoma, presence of viral DNA by polymerase chain reaction (PCR) and the presence of at least one HPV type. Results: It was found that high-risk types were present in 86% of cases, whereas a low-risk type was detected in the remaining 14%. The more prevalent types of high-risk viruses were: 16 (34%), 31 (12%), 58 (10%), 33 (8%), 52 (8%), 18 (7%), 66 (6%) and 53 (6%). Low-risk types were: 6 (58%) and 11 (36%). No significant variations in the distribution of viral type during the three year period of the study were observed. Concusions: It was concluded that, not considering potential cross immunizing reactions, implementation of the tetravalent vaccine in our community would protect 94% and 41% of women against lesions caused by low risk and high-risk genotypes respectively. Therefore, if the purpose of vaccination is to make a strong impact on cervical cancer and avoid screening, new, improved vaccines will be required.
Keywords: Cervical lesions, human papillomavirus, prevalence, vaccines, gynaecological screening.
INTRODUCCIÓN
El virus del papiloma humano (VPH) representa una de las infecciones de transmisión sexual más comunes. La gran familia de los VPH cuenta con más de 120 tipos virales de los cuales alrededor de 40 están relacionados con lesiones de mucosas ano-genitales. En función de su capacidad oncogénica estos virus se clasifican en tipos de bajo y alto riesgo (1). Los virus de bajo riesgo se detectan en lesiones intraepiteliales de bajo grado (condiloma y CIN I), encontrándose rara vez en lesiones neoplásicas. Los de alto riesgo se encuentran tanto en lesiones intraepiteliales de bajo y alto grado (CIN II/III) como en cáncer invasivo, pero se aíslan preferentemente en lesiones de alto grado y carcinoma (2). Es difícil establecer el volumen de portadoras de la infección y las lesiones asociadas a ellas. Se considera que un 10% de las mujeres de los países desarrollados muestra infección viral con técnicas moleculares de alta sensibilidad y es ligeramente superior, alrededor de un 15%, en los países en vías de desarrollo (3). La gran mayoría de estas infecciones va a curar espontáneamente gracias a la respuesta inmune inducida, aunque un pequeño porcentaje, por razones no suficientemente aclaradas, se convierten en persistentes. Este pequeño porcentaje de mujeres con infección persistente, menos del 3% de la población, es el auténticamente beneficiado por las campañas de prevención secundaria mediante cribado citológico, ya que representa el grupo de riesgo real para desarrollar lesión intraepitelial de alto grado y cáncer. Recientemente, como mecanismo de prevención primaria, se han sintetizado dos vacunas de tipo profiláctico frente al VPH. Dichas vacunas son eficaces antes del inicio de las relaciones sexuales por lo que se recomienda que la vacunación se realice en torno a los 12 años. Las dos vacunas comercializadas son: Gardasil®; vacuna tetravalente frente a los tipos 6, 11, 16 y 18 (Sanofi PasteurMSD, Europa); y Cervarix®; vacuna bivalente frente a los tipos 16 y 18 (GlaxoSmithKline, Gran Bretaña) (5,6). Estudios previos han demostrado que ambas vacunas son altamente inmunogénicas y no causan infección, ya que están constituidas por caparazones vacíos de proteínas virales (Virus like particles-VLP’s) sin ADN (7,8). Recientemente, la Comunidad de Madrid ha aprobado una partida de 9,2 millones de euros para adquirir un total de 32.500 viales de la vacuna tetravalente Gardasil® (9) y comenzar a vacunar a las adolescentes de 14 años en 2008. La campaña de vacunación continuará en años sucesivos vacunándose la franja de adolescentes que alcance esta edad. Todo ello va a suponer un gran esfuerzo económico por parte de la Sanidad Pública, por lo que es importante intentar valorar cuan eficaz va a ser su aplicación en nuestra población. Para ello se han estudiado un total de 1.026 biopsias de lesiones de cérvix recogidas, entre abril del 2005 y diciembre del 2007, en el Hospital General Universitario Gregorio Marañón de Madrid. En este grupo de muestras se ha obtenido, mediante técnicas moleculares, la distribución de los diferentes tipos de VPH implicados y de sus variaciones interanuales con dos finalidades: valorar la cobertura que proporcionará la implantación de esta vacuna en nuestro medio y determinar si dicha cobertura sería suficiente para poder prescindir del cribado citológico.
MATERIAL Y MÉTODOS
Hemos estudiado un total 1026 biopsias ginecológicas con lesiones de cérvix recibidas en el Servicio de Anatomía Patológica del Hospital General Universitario Gregorio Marañón de Madrid. Nuestro centro cubre una gran área sanitaria, el Área 1, que atiende a 750.000 habitantes aproximadamente. El Área 1 tiene 29 zonas básicas de salud agrupadas en 4 distritos: Arganda, Moratalaz, Retiro y Vallecas, y en ella vive el 12,68% de la población regional y el 1,62% de la nacional (10). La procedencia de las muestras es múltiple: consultas de colposcopia y citología del hospital, ambulatorios del área, centros de planificación familiar y centros de E.T.S. Todo ello asegura que estas muestras son ampliamente representativas de la población de nuestra Comunidad. Se seleccionaron los casos que cumplieron los tres requisitos siguientes: diagnóstico histológico de lesión cervical intraepitelial o infiltrante (condiloma-CIN I, CIN II-III o carcinoma), aislamiento de VPH mediante PCR y tipificación de al menos un tipo viral con técnica de hibridación reversa con sondas específicas. Ambas técnicas moleculares se realizaron con el ADN extraído del propio material biópsico para asegurar que la relación entre lesión histológica y tipo/s de VPH aislado/s fuera causal y no una mera coexistencia temporal. El estudio abarca biopsias obtenidas entre abril del 2005 y diciembre de 2007 para comparación interanual de resultados.
Procedimiento técnico
El ADN se obtuvo a partir de secciones de tejido fijado en formalina tamponada e incluido en parafina ( Kit para extracción de ADN. Máster Diagnóstica S. L. Granada).
Este ADN se usó como molde para detectar la presencia de ADN del VPH mediante amplificación por PCR usando cebadores Gp5-6 específicos de la región consenso L1 (Kit para screening de VPH. Máster Diagnóstica S. L. Granada). El resultado de la amplificación se visualizó mediante electroforesis en gel de agarosa y tinción con bromuro de etidio en un transiluminador de luz ultravioleta, considerándose el caso como positivo si aparecía una banda de 150 pb.
En los casos que resultaron positivos para VPH se llevó a cabo la identificación del tipo de virus mediante un kit que permite la detección de 16 tipos específicos de VPH de alto riesgo (16, 18, 31, 33, 35, 39, 45, 51, 52, 53, 56, 58, 59, 66, 68, 81) y 5 bajo riesgo (6, 11, 42, 43, 44). Esta identificación se realiza mediante amplificación por PCR de un fragmento de 450 pb de la región consenso L1 e hibridación reversa con sondas específicas para cada tipo (Kit VPH-GenoArray. Master Diagnóstica S. L. Granada).
RESULTADOS
• De los 1026 casos estudiados, en 260 no se pudo aislar VPH mediante PCR, probablemente por degradación del ADN debido a la fijación en formalina. 435 casos fueron positivos para VPH mediante la misma técnica, pero no se pudieron tipificar. Esto puede ser debido a que el tipo de papilomavirus no esté incluido en el Kit, aunque en la mayoría de casos esta negatividad se explica porque el fragmento de ADN necesario para tipificar (450 pb) es mayor que el de detección (150 pb), y por lo tanto la probabilidad de degradación del ADN también es mayor. Finalmente, 331 casos fueron positivos para VPH con PCR, pudiéndose tipificar uno o varios tipos de virus. Fueron estos 331 casos con lesión histológica, en los que se llegó a determinar la presencia de al menos un genotipo viral, en los que se centró el estudio.
• Del total de 331 casos positivos para VPH, 274 fueron positivos para uno o varios tipos de VPH de alto riesgo, 46 casos fueron positivos para uno o varios tipos de VPH de bajo riesgo y 11 casos mostraron coinfección por genotipos de alto y bajo riesgo. Esto representa el 83%, 14% y 3%, respectivamente, de la muestra estudiada (fig. 1).

Fig. 1:
Relación de VPH de alto y bajo riesgo.
• Se comprobó que de los 285 casos positivos para VPH de alto riesgo, en 218 se trataba de un único tipo de virus, 56 mostraron coinfección por más de un genotipo de alto riesgo y 11, como ya se ha comentado, mostraron coinfección por genotipos de alto y bajo riesgo.
• La distribución individual de tipos de alto riesgo fue la siguiente:
– 115 casos por VPH 16 (34%), 41 por VPH 31 (12%), 35 por VPH 58 (10%), 27 por VPH 33 (8%), 26 por VPH 52 (8%), 25 por VPH 18 (7%), 20 por VPH 66 (6%), 19 por VPH 53(6%), 9 por VPH 56(3%), 7 por VPH 39 (2%), 7 por VPH 45(2%), 7 por VPH 68 (2%), 6 por VPH 59 (2%), 2 por VPH 51 (0,60%) y 2 por VPH 35 (0,60%) (fig. 2).
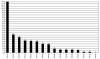
Fig. 2:
Casos de VPH de alto riesgo. Obsérvese que debido
a la existencia de infecciones múltiples el número de casos de virus tipificados
es mayor que el número de casos de la figura 1.
– Del total de casos de infección por VPH de alto riesgo, la suma de los tipos 16 y 18 representó un 41%.
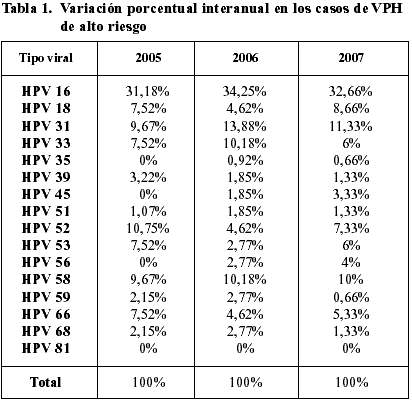
– No se observaron variaciones significativas interanuales de estas cifras, por lo que se pueden considerar estables a lo largo del periodo de estudio (tabla 1).
• De los 57 casos en los que se aislaron tipos de bajo riesgo, 45 eran monoinfecciones, en 1 caso había infección múltiple por tipos de bajo riesgo y los 11 restantes mostraron coinfección bajo-alto riesgo (fig. 1)
• La distribución individual de tipos de bajo riesgo fue la siguiente:
– 35 casos por VPH 6 (58%), 22 por VPH 11 (36%), 2 por VPH 43 (3%) y 2 por VPH 44 (3%) (fig. 3).

Fig. 3:
Casos de VPH de bajo riesgo. Obsérvese que debido
a la existencia de infecciones múltiples el número de casos de virus tipificados
es mayor que el número de casos de la figura 1.
– Del total de casos de infección por VPH de bajo riesgo, la suma de los tipos 6 y 11 representó un 94%.
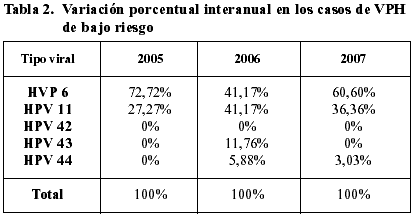
– No se observaron variaciones significativas interanuales de estas cifras, al igual que en los casos de alto riesgo, por lo que se pueden considerar estables a lo largo del periodo de estudio (tabla 2).
DISCUSIÓN
La implantación de las vacunas frente al VPH en nuestra Comunidad va a suponer una gran oportunidad para la Sanidad Pública que es necesario evaluar. Estas vacunas son casi 100% efectivas en la prevención de lesiones intraepiteliales de alto grado cervicales, vaginales y vulvares, asociadas a los VPH 16 y 18, en mujeres no expuestas previamente al virus. Así mismo, Gardasil® ha puesto de manifiesto su eficacia para prevenir las verrugas genitales (condilomas) asociadas a los VPH 6 y 11. Así pues, según los datos de nuestro estudio y sin tener en cuenta otro tipo de consideraciones, la vacuna tetravalente tendría un efecto preventivo sobre el 94% de las lesiones asociadas a VPH de bajo riesgo y sobre el 41% de las lesiones asociadas a VPH de alto riesgo. El primer porcentaje se puede considerar excelente, pero el segundo, más importante por referirse a VPHs oncogénicos, los prevalentes en nuestra población (11), es bastante pobre. Contrasta fuertemente, además, con la protección frente al cáncer cervical estimada con la introducción de la vacuna que es muy superior, alrededor del 70%. Hay varias razones que podemos considerar para explicar esta discrepancia. La primera es que nuestra serie comprende todo tipo de lesiones cervicales, no solamente las invasivas, y que de todos los tipos de VPH oncogénicos, el 16 y el 18 son los de mayor riesgo de persistencia y progresión. De hecho, la distribución mundial de los tipos de VPH en biopsias de cáncer y en biopsias de lesión intraepitelial publicadas en 2003 (12), son las siguientes:
– Cáncer: 16 (58,1%); 18 (15,7%); 33 (4,4%); 31 (4,0%); 45 (2,9%).
– H-SIL : 16 (45,3%); 31 (8,6%); 33 (7,3%): 58 (7,0%); 18 (6,9%)
Como se puede observar hay una desviación porcentual importante a favor del 16 y 18 si comparamos lesiones invasivas con no invasivas. Se puede argumentar, también, que las vacunas han mostrado cierto grado de protección cruzada frente a otros tipos de VPH relacionados filogenéticamente con los tipos 16 y 18, lo que podría contribuir a incrementar su espectro con otros tipos no vacunales. Pero, pese a estos argumentos, es obvio que la eficacia de la vacuna se encuentra limitada por varios factores. En primer lugar, esta protección cruzada frente a otros tipos de VPH no incluidos en la vacuna, no es ni tan intensa ni tan duradera como la tipo específico y serían necesarios, además, estudios adicionales independientes que confirmen los datos comunicados por los fabricantes. En segundo lugar, y como es conocido, en la génesis de los carcinomas de cérvix, vulva y vagina, hay muchos otros tipos de VPH implicados aparte del 16 y el 18. Una publicación reciente analiza los datos de una serie de estudios coordinados por la Agencia Internacional de Investigación sobre el Cáncer (IARC) en 25 países (13). En un total de 3.607 casos de cáncer cervical recogidos, los 15 genotipos de VPH más comúnmente aislados, en orden descendente de frecuencia, fueron: 16, 18, 45, 31, 33, 52, 58, 35, 59, 56, 39, 51, 73, 68 y 66. Si comparamos esta lista con la de los 15 tipos de VPH de alto riesgo prevalentes en nuestra serie: 16, 31, 58, 33, 52, 18, 66, 53, 56, 39, 45, 68, 59, 51 y 35, comprobamos que, aunque con distinto orden, son los mismos. Esto quiere decir que todos ellos son potencialmente oncogénicos, y a las pacientes no les va a tranquilizar demasiado el hecho que el tipo o tipos de VPH que están provocando su lesión, tengan menos probabilidades estadísticas de originar un cáncer que los dos contra los que se ha vacunado. En otro meta-análisis realizado en China en el que se recogen un total de 1.555 casos de cáncer cervical (14), se llega a la conclusión que en el desarrollo de vacunas profilácticas de segunda generación debería considerarse la inclusión, tras los tipos 16 y 18, de los tipos 58, 52, 33 y 31; exactamente los 4 tipos que se encuentran en orden de frecuencia entre el 16 y el 18 en nuestra serie. Por otra parte, tampoco debemos obviar el hecho que en nuestra población, y aunque no todos los casos acaben en cáncer, se han aislado otros tipos diferentes al 16 o el 18 en el 59% de las lesiones cervicales asociadas a VPH oncogénicos. Por lo tanto es de esperar que, pese a las campañas de vacunación, esta mayoritaria y eficiente labor patógena de los virus no incluidos en la vacuna continúe, originando elevada morbilidad, problemas sanitarios y gran desconcierto en las pacientes vacunadas. Comprobamos, pues, que por lo que respecta a la cobertura de genotipos oncogénicos, con las vacunas actuales el tema no queda resuelto. Adicionalmente, todavía no se ha determinado si la elevada eficacia contra lesiones intraepiteliales de alto grado asociadas a los VPH 16 y 18 demostrada por la vacuna, puede ampliarse a la prevención de cánceres verdaderos y a la mortalidad por cáncer. Por lo tanto, con el estado actual de cosas, será necesario continuar con el cribado pese a las campañas de vacunación. Por otra parte, y por lo que respecta a las vacunas profilácticas, el desarrollo de nuevos avances en cuanto a la cobertura de tipos es un objetivo claramente deseable. En este sentido, una vacuna multivalente basada en 12 tipos de VPH podría prevenir, con pocas variaciones geográficas en todo el mundo, frente al 95% de las lesiones causadas por genotipos oncogénicos. Una alternativa a la poco probable sustitución de las vacunas profilácticas ya comercializadas, sería la de seguir con ellas, ya que parecen mostrar buenos resultados frente a los dos genotipos más peligrosos, y desarrollar una vacuna complementaria que incluya los otros tipos oncogénicos prevalentes que no son ni el 16 ni el 18. Esto último permitiría, de manera adicional, «revacunar» y ampliar la cobertura de tipos a las mujeres vacunadas con la primera generación de vacunas. Será entonces, quizás, cuando podamos hablar del «principio del fin» y no ahora como, de forma demasiado optimista o interesada, se esta haciendo en muchos medios de comunicación originado falsas expectativas y no poca confusión en la opinión pública. Se puede argumentar que esto encarecería el coste de la vacunación aún más, pero probablemente no demasiado puesto que la tecnología necesaria ya está establecida. Además, con esta mejora se podría ahorrar la mayoría del gasto sanitario generado por el diagnóstico, tratamiento y seguimiento de lesiones preinvasivas e invasivas, con lo que la relación coste-efectividad sería muy favorable con toda seguridad. Por otra parte, seria un error contar tan solo, como ya han comentado voces autorizadas, con dos grandes fabricantes de países desarrollados para producir vacunas de segunda generación. Muchas vacunas, seguras y efectivas, se fabrican en países de desarrollo intermedio menos restringidos por intereses comerciales. Este hecho significaría que millones de mujeres de todo el mundo, especialmente las de los países con escasos recursos, donde el cáncer cervical es un grave problema sanitario, pudieran beneficiarse de los logros científicos que actualmente y de forma deplorable no tienen a su alcance.
AGRADECIMIENTOS
A las 1026 mujeres que han hecho posible este estudio y a Dolores Carneros por la cuidadosa realización de las técnicas moleculares.
BIBLIOGRAFÍA
Pfister H. Human papillomaviruses and genital cancer. Adv Cancer Res 1987; 48: 113-47.
Gross G, Barrasso R (eds) Human papillomavirus infection. A clinical atlas. Wiesbaden: Ullstein-Mosby; 1997. Wieland U, Pfister H. Papillomavirus in human pathology: epidemiology, pathogenesis and oncogenic role; p. 1-18.
De Sanjosé S, Diaz M, Castellsagué X, Clifford G, Bruni L, Muñoz N et al. Worldwide prevalence and genotype distribution of cervical human papillomavirus DNA in women with normal cytology: a meta-analysis. Lancet Infect Dis 2007 453-9.
Schiller JT, Lowy DR. Papillomavirus-like particles and HPV vaccine development. Semin Cancer Biol 1996; 7(6): 373-82.
Zhou J, Sun XY, Stenzel DJ, Frazer IH. Expression of vaccine recombinant HPV 16 L1 and L2 ORF proteins in epithelial cells is sufficient for assembly of HPV virion-like particles. Virology 1991; 185(1): 251-7.
Kirnbauer R, Chandrachud LM, O’Neil BW, Wagner ER, Grindlay GJ, Armstrong A et al. Virus-like particles of bovine papillomavirus type 4 in prophylactic and therapeutic immunization. Virology 1996; 219: 37-44.
Schiller JT, Lowy DR. Papillomavirus-like particles and HPV vaccine development. Semin Cancer Biol 1996; 7: 373-82.
European Public Assessment Report. (EPAR) (02.11.06). Disponible en: http://www.emea.europa.eu/humandocs/ humans/EPAR/gardasil/gardasil.htm
Campaña de vacunación contra el virus del papiloma humano. Madrid: Portal de Salud de la Comunidad de Madrid; c2008. Disponible en: http://www.madrid.org/cs/Satellite?pagename=ComunidadMadrid/Home
Área Sanitaria del Hospital General Universitario Gregorio Maranón. Madrid: Portal de Salud de la Comunidad de Madrid. Disponible en: http://www.madrid.org/cs/Satellite?cid=1142398500791&language=es&pagename=HospitalGregorioMaranon%2FPage%2FHGMA_contenidoFinal.
Lacruz Pelea C, Di Martino B, Alvarez Fernández E. Incidencia de los diferentes tipos de papiloma virus humano (VPH) en las lesiones escamosas del cérvix uterino. Rev Esp Patol 2003; 36: 79-84.
Muñoz N, Bosch FX, de Sanjosé S, Herrero R, Castellsagué X, Shah KV et al; International Agency for Research on Cancer Multicenter Cervical Cancer Study Group. Epidemiologic Classification of Human Papillomavirus Types Associated with Cervical Cancer. N Engl J Med 2003; 348: 518-27.
Garland SM, Hernández-Avila M, Wheeler CM, Pérez G, Harper DM, Leodolter S et al. Females United to Unilaterally Reduce Endo/Ectocervical Disease (FUTURE) Investigators. Quadrivalent vaccine against human papillomavirus to prevent anogenital diseases. N Engl J Med 2007; 356: 1928-43.
Bao YP, Li N, Smith JS, Qiao YL; ACCPAB members. Human papillomavirus type distribution in women from Asia: a meta-analysis. Int J Gynecol Cancer 2008; 18: 71-9.