
Vol. 42, n.º 3, 2009
REVISTA
ESPAÑOLA DE
Vol. 42, n.º 3, 2009 |
REVISIONES
Olga Ferrer-Roca
Cátedra UNESCO de Telemedicina. Facultad de
Medicina. Universidad de La Laguna. 38071 Tenerife. Canarias.
catai@teide.net;
http://www.teide.net/catai;
http://catai.net/blog
RESUMEN
Los avances tecnológicos en el campo de la visión microscópica de las imágenes o la capacidad diagnostica de una gran variedad de técnicas ópticas, obligan a analizar y re-ubicar el papel del anatomopatólogo en la medicina. Ni los microscopios, ni la tinción, ni el procesado de tejidos son hoy en día imprescindibles para diagnosticar una lesión en aquellos campos en los que se esta implantado la biopsia óptica. Se hace necesario contar con publicaciones morfológicas que permitan aprender el estándar-oro de acuerdo con la técnica empleada de estas biopsias in vivo o biopsias ópticas no disruptivas. Este cometido ha de estar en manos del patólogo.
El artículo introduce en las técnicas de diagnostico óptico y en las técnicas de visión microscópica no invasiva mostrando los niveles diagnósticos de cada una.
Palabras clave: Biopsia óptica, OCT, superresolución, microendoscopia, histoendoscopia, inmunomicroendoscopia.
SUMMARY
Technological advances in optical microscopy and the diagnostic capacity of a wide variety of optical techniques call for a reappraisal of the role of the pathologist. Today, neither microscopes nor tissue staining and processing are essential for diagnosis. However, in order to set the gold standard for these techniques, more publications on the morphology of in vivo biopsies and noninvasive optical biopsies are needed. This should be the responsibility of pathologists. The present article introduces the techniques of optical microscopy and non invasive microscopy and demonstrates their diagnostic capacity.
Keywords: Optical biopsy, OCT, super-resolution, microendoscopy, histoendoscopy, immunomicroendoscopy.
INTRODUCCIÓN
Una biopsia óptica (BO) (1) es una forma no invasiva de diagnóstico con un sistema óptico que realiza un análisis del tejido en superficie o en profundidad usando una de las técnicas siguientes: láser, OCT, infrarrojo, fluorescencia, espectroscopia etc. Es decir, no extrae el tejido del organismo y diagnostica sin una biopsia intrusiva. Al tejido a analizar se accede a través de la superficie del cuerpo, incluido el análisis de la propia piel, o por vía endoscópica.
En Anatomía Patológica el «estándar de oro» es la histología del tejido sano fijado. En las técnicas de BO las imágenes se obtienen en tiempo real y van acompañadas de una considerable información complementaria que permite evaluar la enfermedad in vivo, sin que tengamos todavía un estándar oro.
Desde el punto de vista técnico los métodos de biopsia óptica se dividen en dos grandes grupos:
a) Métodos basados en imágenes entre los que se encuentran todas las imágenes de luz coherente del tipo de la: OCT o Tomografía de coherencia óptica, Imágenes de coherencia óptica (OCI), Imágenes de holografía digital (DHI), etc. Las de iluminación estructurada como la endomicroscopía confocal o las mixtas como la microscopia foto-acústica o PAM.
En la figura 1 puede observarse el rango de resolución que alcanzan las técnicas de imagen hoy en día.

Fig. 1:
Resolución espacial (círculos) y penetración
axial (eje Y) de los sistemas de imágenes medicas. Las aplicaciones lumínicas
tienen 1-2 órdenes de magnitud superior de resolución espacial (HR-CT=high
resolution computer tomography, MRI=Magnetic resonance, el resto de
las siglas en el texto).
b) Métodos no asociados a imágenes: que incluye la espectroscopia de los tejidos (fluorescencia, reflectancia, dispersión fotónica elástica…) con luz coherente o no coherente. Es decir el análisis espectral del tejido de gran ayuda en biología, química o fisiología.
De hecho el término de Biopsia óptica se acuñó para estos últimos, que quedan lejos del área de acción de los anatomopatólogos, a pesar de que una de sus finalidades sea evitar los retardos diagnósticos de malignidad, permitiendo un tratamiento inmediato.
Si utilizamos como definición de biopsia óptica aquella que utiliza energía óptica para obtener información de la estructura y función de los tejidos sin ser disruptiva para los mismos, se encuentra incluida cualquiera de las técnicas no invasivas de obtención de imágenes de alta resolución mediante cortes ópticos.
Esta definición está cerca de la competencia de un anatomopatólogo por su formación ya que el diagnóstico se basa o bien en las modificaciones de la histología normal o en la morfología de las células y el tejido.
La constante evolución del microscopio ha conseguido romper el límite de la resolución óptica con numerosas técnicas microscópicas sin especificidad física o química basadas en iluminación estructurada, interferometría u holografía. Mientras que las técnicas espectroscópicas como de fluorescencia, infrarroja-IR o Raman, detectan las características físicas y químicas de los espécimenes por lo que algunos las llaman patología espectral.
Para llegar a las técnicas ópticas no lineales con luz coherente de elevada energía en la que la señal reflejada no está relacionada con la que entra (dobla la frecuencia incidente) y nos da información sobre la estructura o interacción intermolecular. Por eso estos sistemas reciben el nombre de microscopios químicos y permiten detectar cambios moleculares en superficie (SH o segundo armónico y la SG o generación de sumas de frecuencias) o en la orientación y distribución molecular (THG o generación del tercer harmónico, el CARS o dispersión coherente Raman anti-Stokes y el TPEF o la fluorescencia de dos fotones y TTEF o de tres fotones).
Todas ellas se han miniaturizado utilizando nuevos materiales y MEM1s, y se han introducido en los sistemas de endoscopia convirtiéndolos en micro-endoscopios morfológicos o químicos.
Al permitir el análisis de los tejidos in vivo, tienen una enorme proyección en Genómica, Proteómica y Metabolómica e influyen directamente en cirugía, telemedicina, diagnóstico de cáncer, terapias personalizadas y enfermedades cardiovasculares (2).
SUPER-RESOLUCIÓN
En este articulo vamos a estudiar las técnicas ligadas a la Biopsia Óptica en su sentido amplio (espectrales y de imágenes) haciendo especial mención a las basadas en imágenes en su mayoría en el campo de la super-resolución.
Por lo general las imágenes de BO son imágenes con una resolución óptica superior a la teoría de Abbe cuyo limite viene impuesto por l/2NA e igualmente superior a la ley de Rayleigh 0.61*l/NA que considera que dos puntos pueden resolverse si el centro de la función de dispersión-PSF (point spread function) de uno cae dentro del primer cero (first zero) de la PSF centrada en el segundo punto, siempre que ambos puntos tengan un contraste superior al 26% ya que la resolución lateral depende de la luminosidad y del contraste del objeto (fig. 2).

Fig. 2:
Según la ley de Rayleigh, dos objetos son
visibles si están a una distancia de 0.61
l/NA
y tienen un contraste del 26%, ya que la resolución lateral depende de la
luminosidad y contraste del objeto.
Un sistema alcanza el nivel de super-resolución cuando ve objetos que están por encima de este límite y por lo tanto:
La fórmula de la super-resolución N es tal que l/2NNA sea el límite posible de resolución, siendo N*resolución l/2NA.
La resolución óptica del sistema se ve limitado por la técnica de muestreo y captura de la imagen. En las cámaras CCD, la ley de Rayleigh debe adaptarse a la teoría del muestreo de Nyquist, de forma que para poder distinguir un objeto, este debe estar separado entre 2,3 a 3 veces el aumento del microscopio (M) por la resolución óptica del sistema óptico (Dd ) dividido por el tamaño del píxel de la cámara (Dx)
D
d * M / Dx = 2,3 – 3O lo que es lo mismo el límite de resolución espacial debe muestrearse como mínimo con dos píxeles. A este efecto se añade el tamaño del píxel (el más pequeño en chips de 2/3» es 2,7 µ (3) y que las cámaras mono-chip para obtener el color realizan una integración de los píxeles sensibles al color (RGB) con lo que la densidad de muestreo se reduce (fig. 3).
Fig. 3:
Sistema óptico 15x con NA de 0,75, y pixel de 2.7 µm de lado. Imagen Raw (A) y
su transformación RGB (B). En la primera es visible el mosaico 2G-R-B del chip.
Igualmente el uso de la teoría de la información es decir el análisis de imagen y reconocimiento de patrones contribuye a la capacidad de detección de una imagen llevándola al límite de super-resolución. Desde la disminución del ruido de los aparatos de captura con el promediado de imágenes, pasando por el contraste adaptativo, en que se detectan los bordes y luego se le aplican funciones ponderadas para disminuir la información de la región interna, hasta llegar a la técnica TSOM (Trough focus scanning optical microscope) (4) en la que podemos tener 3 nm de resolución.
TÉCNICAS
A continuación estudiaremos las tecnologías que nos permiten una biopsia óptica. Las diferenciamos en microscopía o espectroscopia según se utilicen a nivel morfológico o espectrográfico.
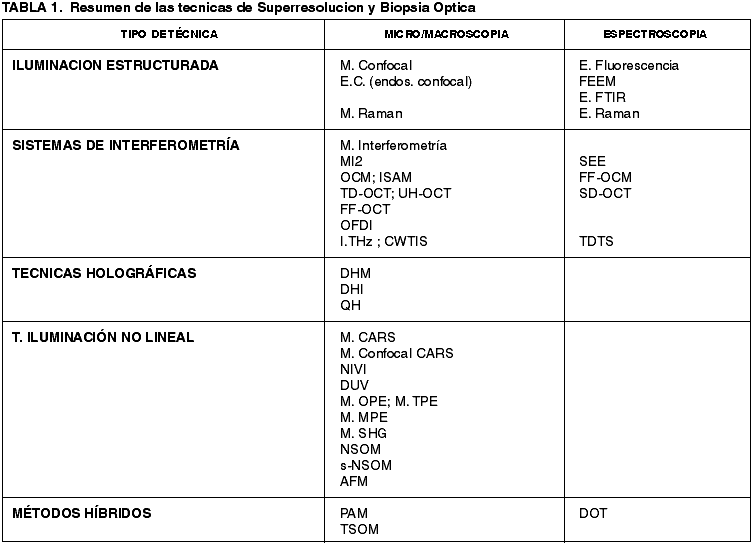
Los sistemas más populares de super-resolución, especialmente la fluorescencia, utilizan una iluminación estructurada, como la del microscopio confocal con un punto luminoso en el límite de la difracción óptica. Otros como el de dos fotones o imágenes del tercer armónico usan sistemas ópticos no lineales con puntos luminosos todavía más pequeños. La proyección de las bandas de interferencia en un objeto es otro de los métodos. Y por último las aplicaciones más sofisticadas correlacionan la imagen obtenida con la esperada en técnicas holográficas y de procesado de imagen, en las que cuando ambas imágenes son muy parecidas las diferencias son de una alta resolución (tabla 1).
A continuación analizaremos cada una detalladamente.
1. Iluminación estructurada
Toda molécula excitada tiende a volver a su nivel de energía de vibración inicial. Si los fotones que emite son de la misma energía y longitud de onda tenemos una dispersión Rayleigh. La fracción que al desexcitarse sale con un estado de vibración distinta, produce la dispersión Raman. Si el retorno es a una longitud de onda mayor se produce el efecto-«Stokes» y si lo hace a una menor un efecto-«anti-Stokes», predominando siempre el primero.
Espectroscopia de Fluorescencia
La espectroscopia de fluorescencia determina las propiedades de un tejido, examinando la intensidad y la longitud de onda emitida por el objeto fluorescente o auto-fluorescente mediante excitación ultravioleta-UV, cercana al infrarrojo-NIR (640-850 nm) y LIF (Laser induced fluorescence) compactos o tuneables2.
Estas técnicas concentran fundamentalmente dos metodologías la LSS (Light scattering spectroscopy) para imágenes microscópicas y el FastEEM (Fast excitation emission matrix) sobre áreas microscópicas usando fibra óptica. Con ellas se obtienen tres tipos de información TMS (tri-model spectroscopy): la fluorescencia intrínseca, la reflectancia y la dispersión elástica de la luz.
1. LSS o espectroscopia de reflexión luminosa, que no requiere iluminación estructurada (fig. 4).
Fig. 4: LSS-espectroscopia de reflexión
luminosa que muestra un área LOF (Loss of Fluorescence) sospechosa de
malignidad. Sacado de
http://www.genomebc.ca/whatnew_press/upcoming_events/2006/documents/CalumMacAuleyPresentation.pdf
Además de los sistemas hechos «en casa» hay sistemas comerciales. Este es el caso del VELscope® (Visual Enhanced Lesion scope) de LED Dental Inc., para cavidad oral. El PMTI® (Photonic Molecular Tissue Imager) de Mediscience Technologies que usa UV-320 nm y luz amarilla a 580 nm en la detección de cáncer (CD-ratiometer™) y el escaneado del virus del papiloma (HPV) en el cérvix uterino, o el LUMA® (Cervical imaging system) de MediSpectra Inc, adquirida posteriormente por SprectraScience que utiliza UV y luz visible entre los 360 y 720 nm.
El HSDITM (HyperSpectral Diagnostic Imaging System) de STI Medical systems, Hawai, utiliza lo que ha registrado con el término de Biopsia Virtual (fig. 5), que es la captura y análisis automático por CAD (computer-aid-diagnosis) de la imagen directa, por fluorescencia y reflectancia de luz blanca, que clasifica y localiza las zonas por riesgo de malignidad.
![]()
Fig. 5:
HSDI-Virtual Biopsy® marcadas HSIL y LSIL. Sacado de
http://www.sti-hawaii.com/research.html
Más simple es el DySISTM (Dynamic Spectral Imaging System) de Forth-photonics® que muestra pseudo-color después de limpiar el área colposcópica con ácido acético diluido (5).
El OncoLIFE® (light-induced fluorescence endoscope) de Xillix utiliza luz azul (425-455 nm) de una lámpara de xenón y un endoscopio. La fluorescencia recogida en el CCD es analizada con un filtro verde (480-580 nm) y rojo (620-720 nm).
2. FastEEM-matriz emisión-excitación rápida (6)
Tiene una iluminación estructurada porque la fluorescencia se excita con un láser pulsado (308-480 nm) y dos pulsos de luz blanca a través de una sonda de fibra óptica (270-800 nm). Se recoge a través de una rejilla de difracción, enviándose a un intensificador CCD. Un espectrógrafo analiza la difracción de primer orden y elimina la de segundo orden (>540 nm) con un filtro de paso alto.
El sistema WavSTAT® (7) desarrollado por SpectraScience utiliza LIF tuneado a 410 nm. La sonda LIF de fibra óptica puede integrarse en un colposcopio-MIS (Multispectral Imaging system) o en un endoscopio a través del canal para biopsias.
Todos estos sistemas permiten «cervicogramas-tejidogramas» es decir imágenes colposcópicas o tisulares MIS que pueden ser almacenadas y consultadas a distancia. De hecho si el término no estuviera registrado por STI Medical Systems, debería llamarse Biopsia Virtual (fig. 5).
Mas adelante veremos una técnica mejorada con sistemas de respuesta no lineales en la región de ultravioleta profundo (DUV= Deep ultra-violet) o de endoscopía multifotónica.
Espectroscopia FTIR
La FTIR (Fourier transform Infrared espectroscopy) como toda la IR es un proceso de absorción que se analiza en el dominio de la frecuencia óptica.
La fluorescencia y el FTIR son los métodos más sensibles y populares de biopsia óptica. En el carcinoma de cérvix uterino el FTIR tiene una sensibilidad y especificidad del 98,6% y 98,8%. Con unos valores predictivos positivos y negativos del 99,5% y 96,5% respectivamente, cuando el PAP tiene valores del 95,9% y del 72,3%.
Espectroscopía Raman
La espectroscopía Raman abarca: la resonancia, la dispersión superficial mejorada-SERS (surface-enhanced Raman scattering), y la micro-espectroscopía (fig. 6).
![]()
Fig 6:
Espectroscopio Raman portátil.
El fenómeno Raman ocurre con cualquier tipo de luz incidente pero las sondas difícilmente pueden distinguir la distribución espacial de la muestra entre otras cosas porque la dispersión es muy baja y se confunde con la fluorescencia del fondo.
En medicina, la espectroscopía Raman cercana al infrarrojo (Raman-NIR) se utiliza para detectar lesiones cutáneas preneoplásicas, identificar tejidos gastrointestinales por endoscopia (ver mas abajo VCE), identificar cambios vasculares asociados a la ateromatosis, así como de ayuda terapéutica detectando el límite tumoral durante una intervención quirúrgica o monitorizando determinadas terapias. También se emplea como análisis no invasivo de sangre y fármacos.
La iluminación estructurada se consigue con la modalidad Raman-HOF (hollow optical fiber) cuya fibra óptica no genera ruido porque la luz se limita al centro. La sonda no necesita filtros y posee varias longitudes de onda; en una sola fibra se puede conducir la luz de excitación y recoger la luz de dispersión; el espectro Raman así obtenido posee una elevada señal/ruido (SNR=signal to noise ratio) y no necesita corrección del fondo.
Microscopio Raman
La espectroscopía Raman se ha integrado en la microscopía normal (fig. 7) y con la microscopía confocal. En esta última se generan imágenes microscópicas 3D de alta resolución que estudian las propiedades Raman de los tejidos biológicos a nivel subcelular, de gran valor como microscopio químico.
Fig. 7:
Espectroscopía Raman del cáncer de cérvix.
Una versión mejorada que utiliza técnicas paramétricas de iluminación no lineal es el denominado CARS, que veremos más adelante.
Microscopia confocal
Se basa en la iluminación estructurada. Utiliza dos aperturas o agujeros puntiformes (pinholes) en planos conjugados (confocal), uno frente la luz de excitación y otro frente el detector. Con ello la fluorescencia fuera de foco se elimina ya que la apertura confocal solo permite la luz del plano focal y mejora la resolución óptica lateral y axial.
La resolución axial permite la sección óptica del objeto enfocando un plano focal cada vez y reconstruyendo las imágenes electrónicamente.
La reciente miniaturización de la tecnología láser confocal ha dado lugar a la técnica de endomicroscopía o microscopia por endoscopia (fig. 8):
![]()
Fig. 8:
Endomicroscopia Láser Confocal.
http://www.endomicroscopy.org/learningcenter/technique_principles.htm
(A) Endoscopio conteniendo un microscopio láser confocal. La luz laser azul-488
nm (B) se introduce en la mucosa.
Los endoscopios confocales usan láseres pulsados ultracortos y controlan la dispersión cromática y la auto-modulación de la fase con microlentes en forma de paralelepípedo o lentes GRIN (gradient reflactile index). Estos endomicroscopios eran inicialmente de 0,9 mm de diámetro, con 30 Kfibras unidas directamente a lentes GRIN (1 mm diámetro) de 4,8 aumentos (baja NA=0,2), lo que hace un diámetro total de 1,2 mm. El espacio entre fibras es de 3 µm lo que limita el muestreo del área a una resolución lateral de 0,6 µm (8).
El exponente más clásico es el Optiscan® (Optiscan, Australia) (9) (figs. 8 y 9) integrado en la punta de un colonoscopio convencional (Pentax EC3870K; Pentax, Tokio, Japón) que permite una biopsia óptica de la superficie epitelial y de la lamina propia durante la endoscopia. Durante el proceso puede utilizarse contraste como la fluoresceína sódica endovenosa o el azul de metileno, convirtiéndose en una microendoscopia confocal multiespectral MIS que puede incluso detectar marcajes inmunológicos (por ejemplo el anti-CD44V6 para criptas aberrantes) es decir en una inmuno-micro-endoscopía (15).
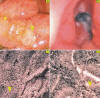
Fig. 9:
Endomicroscopía de una neoplasia colo-rectal. Imagen macro y microscópicas,
sacado de
www.endomicroscopy.com.
Mauna Kea Technologies ha creado el Cellvizio®, una familia de sondas confocales microscópicas sobre objetivos miniaturizados compatibles con cualquier colonoscopio, gastroscopio, y broncoscopio, que permite colangioscopias y alveoloscopias (fig. 10). Alcanza una resolución lateral de 1 µm y axial de 150 µm. Tienen de 0,93 a 2,5 mm de diámetro y una longitud de hasta 4 metros.
![]()
Fig. 10:
ALVEOLOSCOPIA con sonda confocal.
http://www.maunakeatech.com/products/cellvizio_LUNG/system_description
Cápsula endoscópica y BO
Hasta finales del siglo XX la endoscopia utilizaba la técnica PE (Push Endoscopy) con un endoscopio empujado por el medico. Desde 2001 la técnica DBE (Double balloon endoscopy) P&p (Push and pull) que permite observar la totalidad del intestino delgado y avanzar gracias al balón inflable. Más moderna es la VCE (Video-endoscopy capsule), es decir la píldora o cápsula endoscópica inalámbrica (WCE, wireless endoscopic capsule).
La VCE permite el examen directo del intestino delgado de forma no invasiva, segura y bien tolerada, aunque la estenosis y los divertículos se encuentran entre las contraindicaciones. Por eso actualmente van señalizadas con RFID que las localiza y permite su extracción.
La VCE se desarrolló inicialmente como una píldora de uso único. En la actualidad hay varios tipos (10,11).
La WCE o cápsula endoscópica inalámbrica M2A® (PillCam SB de Given Imaging) de 3,7 g y 11 x 26 mm, con cámara CMOS y 6 LEDs, equipada de un transmisor UHF que envía 2 imágenes/segundo durante unas 7 horas.
La EC tipo 1 de Olympus con una cámara CCD de alta resolución y un monitor de visualización externo a tiempo real (fig. 11).
![]()
Fig. 11:
Olympus WCE con monitor de control. De
http://www.springerlink.com/content/3j30h3585268428x/fulltext.html
El CPE® - Compact Photonic Explorer de Mediscience Technology, contiene además espectroscopia de fluorescencia incorporada, de forma que pueda detectar las lesiones neoplásicas a nivel molecular.
La tercera generación de cápsulas es la Norika 3® RF Endoscopic Robot Capsule (fig. 12) en 2001. No posee baterías y se carga mediante campos electromagnéticos externos que además la hacen rotar. Tiene de 9 x 23 mm y el 40% de su cabida está libre para adaptar sistemas quirúrgicos o terapéuticos, del tipo de sprays, láser, detección pH etc… Actualmente tiene 5,8 x 15 mm lo que permite su uso en niños. Utiliza la técnica del mosaico para combinar las imágenes y dar una visión panorámica.
![]()
Fig. 12:
Norika WCE. Sacado de The future of wireless
capsule endoscopy. Swain P. World J Gastroenterol. 2008 Jul 14; 14(26):
4142-5.
Sayaka-CE® de RF system Lab, Japon, envía 30 imágenes por segundo, no utiliza batería y emplea igualmente técnica del mosaico (fig. 13).
![]()
Fig. 13:
Sayaka® CE. La visión es lateral de forma que toma imágenes mientras
rota y luego se componen en forma de mosaico. De
http://www.rfamerica.com/sayaka/
La cuarta generación incluye locomoción activa y sistema miniaturizado de toma de muestras. Es el caso de Versatile® (Endoscopic Capsule for gastrointestinal Tumor Recognition) se incorpora además un sistema espectroscópico de IR-cercano (NIR) (12,13).
2. Sistemas de interferometría
Mejorar la resolución con DIC (differencial interference contrast), es decir con la técnica Nomarski, es conocido desde antaño.
Hoy en día las técnicas de interferometría con rejillas de difracción pueden compararse a la microscopía confocal, pero con mayor penetración (fig. 1): su resolución axial depende de la coherencia del haz lumínico y la transversal del tamaño del punto luminoso.
En interferometría se mide el retardo de la fase y de la señal, sabiendo que ambas imágenes tienen como propiedad intrínseca la confocalidad, y por tanto que su resolución espacial mejora.
Hay tres modalidades con luz de baja coherencia-LCI (Low coherence interferometry) son la CPM (sonda microscópica de coherencia), OCT (tomografía de coherencia óptica) y OCM (microscopía de coherencia óptica). El primero utiliza luz halógena y los otros dos utilizan super-LEDs ó diodos láser súper-luminiscentes (SDL). Las aplicaciones con luz halógena se han venido a llamar de campo completo o FF-OCT y FF-OCM.
Microscopio Óptico de Interferometría
El IIM (Imaging interferometric microscopy) (14) puede adaptarse a los microscopios existentes sin necesidad de acceder a plano pupilar del objetivo. Consigue una iluminación estructurada con una rejilla que deja pasar la luz a través de puntos de tamaño inferior a la
l, en el límite de NA del sistema óptico. Esto produce un desplazamiento de las frecuencias espaciales, obteniendo varias imágenes parciales en amplitud y fase que luego combina.El IIM trabaja a bajo aumento con objetivos de baja apertura numérica (NA<0,5) y sin embargo obtiene una resolución dos veces superior a la de los objetivos de alta apertura numérica (NA=1,4). La profundidad de campo, el área de visión y la distancia de trabajo es la de un objetivo de bajo aumento, aunque la imagen final integrada posea una resolución en el límite lineal del medio de transmisión (índice de refracción n)
l/4n. Desplazando el plano del objeto y transformando las frecuencias espaciales observadas (imagen patrón) en frecuencias espaciales de la imagen real, la resolución se extiende al límite de ancho de banda del medio de transmisión l/4.La extensión de la NA hasta una apertura efectiva de NAeff=1+NA se consigue con dos sub-imágenes desplazadas en la dirección x e y. En estas condiciones, un espécimen en el eje óptico tiene una frecuencia espacial limite de (1+NA)n/
l, pero desplazando el plano del objeto la difracción llega hasta el límite del ancho de banda 2n/l. El IIM utiliza la iluminación no axial para acceder a las altas frecuencias espaciales introduciendo un haz de referencia en el orden cero del sistema óptico.La microscopía molecular por interferometría es un paso más; el MI2 o molecular interferometric Imaging, permite la detección de biomoléculas.
Endoscopia espectral monofibra con Interferometría
Los endoscopios con una alta calidad de imágenes son grandes porque sus sensores también lo son (1 cm o más de diámetro).
Los micro-endoscopios estándar (2,4 a 1,2 mm diámetro) utilizan unos pocos haces de fibras ópticas que los hacen flexibles a costa de reducir la calidad de la imagen.
En la actualidad los microendoscopios monofibra alcanzaron en 2006 el grosor de un cabello (80 nm), poseen efecto HOF y son de fibra de cristal fotónico- PCF (photonic cristal fibers).
La endoscopia espectral codificada o SEE (spectrally encoded endoscopy) utiliza de una luz multicolor a través de una única fibra óptica del grosor de un cabello que se proyecta sobre los tejidos. La luz que el tejido refleja se recoge y las diferentes longitudes de ondas se analizan con un espectrómetro. Simultáneamente un interferómetro calcula la información estructural basándose en la interacción de dos fuentes de luz para crear una imagen tridimensional. Con ello obtenemos las ventajas de la FastEEM sobre una imagen tridimensional (fig. 14).
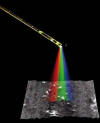
Fig. 14:
SEE o endoscopia espectral codificada. La luz
reflejada produce una imagen tridimensional. La luz Blanca transmitida a través
de un endoscopio monofibra del grosor de un cabello se descompone en el espectro
de color recorriendo la superficie y obteniendo información espectral,
http://www.sciencedaily.com/releases/2006/10/061018150820.htm
Tomografía de Coherencia Óptica
La OCT (Optical coherence tomography) es una técnica no invasiva que utiliza fuentes de luz de baja coherencia tales como diodos láser superluminiscentes (SLD), algunos en la region NIR3, para producir una tomografía basada en el retardo en el tiempo y en la fase de la luz reflejada mediante técnicas de interferometría-TDOCT(time-domainOCT) e interferometría-SDOCT (spectral-domainOCT).
Por definición trabaja sobre bajas aperturas numéricas (NA<0,5) y tiene una buena penetración (10-3 mm). La resolución axial y lateral micrométrica en 1991, era con los SLDs de 30 µm; en 2001, con los láseres pulsados de amplio espectro (>100 nm de rango) de 10 µm (H-OCT o high resolution-OCT) y hoy en día con los sistema de Ultra Alta Resolución (UH-OCT) llega a las 0,5 µm (figs. 15 y 16).
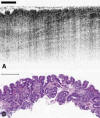
Fig. 15:
UH-OCT endoscópica. La imagen superior es la
biopsia óptica por UH-OCT y la inferior su correlación histológica (Sacado de
Hsiung P, Pantanowitz L, et al., Ultrahigh-resolution and 3-dimensional optical
coherence tomography ex vivo imaging of the large and small intestines
Gastrointestinal Endoscopy Volume 62, Issue 4, 2005).
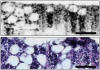
Fig. 16:
UH-OCT fibroscópica. La imagen superior es la
biopsia óptica UH-OCT de un ganglio linfático y la inferior el corolario
histológico (Sacado de Luo W, Nguyen FT, Zysk AM, Ralston TS, Brockenbrough J,
Marks DL, Oldenburg AL, Boppart SA. Optical biopsy of lymph node morphology
using optical coherence tomography. Technology in Cancer Research & Treatment,
4: 539-547, 2005.
En la actualidad la OCT está ampliamente aceptada en oftalmología y se extiende a la endoscopia (por ejemplo: en tumores de vejiga la sensibilidad es del 92% y la especificidad del 85%), a la colposcópica y otras técnicas de imagen. Existen en el mercado endoscopios-OCT de 1 mm de diámetro y fibroscopios-OCT de 400 µm de diámetro mono fibra con óptica GRINS o DRUM (16,17,18) (figs. 17 y 18).

Fig. 17:
Endoscopio OCT de Obel (19).
http://obel.ee.uwa.edu.au/research/engineering

Fig. 18:
Sonda OCT para aplicaciones de coronariografia
www.lightlabimaging.com
En el caso de la oftalmología debe ir acompañado de una óptica adaptativa (AO) con el fin de compensar las irregularidades del sistema ocular lo que encarece considerablemente el aparataje.
Microscopía de coherencia óptica
Aunque el nombre de OCM (Optical coherence Microscopy) se usa cuando se emplean objetivos de elevada NA (NA>0,5) el hecho es que hoy en día puede encontrarse óptica GRINS de NA=1,2, por lo que el detalle histológico de la imagen in vivo puede ser muy alto.
Además, sobre los datos grabados de una OCT se puede implementar una apertura sintética o ISAM (Interferometric Synthetic Aperture Microscopy) (20), de la que se saca ventaja en el OFDI que veremos más abajo.
Como bien se sabe la profundidad de campo (DoF, deapth of field) y la resolución espacial son inversas, de forma que cuando una mejora la otra disminuye. Con el método ISAM ya no existe esta limitación, captura los datos con fase estable al incluir la fase de referencia (cubreobjetos por ejemplo) en el objeto.
El procesado consiste en una serie de filtros y mapeados en el dominio de Fourier. El resultado tiene detalles histológicos de alta calidad (fig. 19).
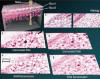
Fig. 19:
Técnica ISAM de apertura sintética en OCM. Sacado de
http://www.mdpi.com/1424-8220/8/6/3903/ Interferometric Synthetic
Aperture Microscopy: Computed Imaging for Scanned Coherent Microscopy. Brynmor
J. Davis, Daniel L. Marks, Tyler S. Ralston, P. Scott Carney and Stephen A.
Boppart. In Sensors 2008, 8, 3903-3931.
Coherencia Óptica de campo completo
La UH-OCT macroscópica (FFOCT= Ultrahigh-resolution full-field optical coherence tomography) utiliza simples lámparas halógenas y detectores del tipo de cámaras CCD; alcanza un SNR de 90-100 dB.
Algo similar es la FFOCM (Full-Field Optical Coherence Microscopy) (21). Utiliza una lámpara de tungsteno que permite un gran ancho de banda de luz térmica y combina la espectroscopia con la OCM por lo que a veces se la conoce como OCT-espectroscópica. Esta técnica con objetivos de bajo aumento de inmersión acuosa 10X y baja apertura numérica NA=0,3, captura la información espectral con cámaras en color y consigue imágenes de de alta resolución (axial de 0,8 µm y lateral de 1,4 µm) con procesado de imágenes.
El detalle microscópico alcanza el nivel de la pseudo-tinción microscópica cuando la señal de interferometría se muestra en el espacio HSL (hue-saturation-luminiscence), en el que H representa la variación
l, S el desplazamiento temporal y L es constante (22). Es decir, el tono (H) es el color predominante de la longitud de onda, la saturación (S) su pureza espectral y la luminancia (L) la intensidad del color. En (H) los cambios de reflexión de la luz se codifican en rojo, verde o amarillo según sean positivos, negativos o sin modificación; la saturación de cada H indica la reflectividad del tejido y la L se mantiene constante (23). Como puede comprobarse en la figura 20, el detalle es suficiente como para poder realizar citologías en la colposcópia, es decir una colposcopia-MIS con biopsia óptica.
![]()
Fig. 20:
Codificación espectral de la UH-OCT
http://www.rle.mit.edu/rleonline/ProgressReports/1673_5_Fujimoto_2.pdf
Microscopía en el Dominio de la Frecuencia Óptica OFDI
La OFDI (Optical Frequency Domain Imaging) es una mejora sobre la OCT ya que en vez de analizar la imagen punto a punto, analiza 1.000 puntos simultáneamente.
La punta de la sonda del cable de fibra óptica da vueltas a la vez que emite una luz láser que cambia de longitud de onda (de 1.264 a 1.376 nm). Midiendo el retraso temporal del eco y la interferencia espectral entre el tejido y la referencia en cada longitud de onda se crea una imagen cuya transformada de Fourier (dominio de la frecuencia óptica) da una visión microscópica.
Imágenes de interferometría en Terahercios (THz)
Utiliza ondas electromagnéticas de gran longitud de onda (THz), localizadas entre las microondas (MW) y los infrarrojos (IR) en la frecuencia de 1012 Hz. Se propagan a través de los metales y de los materiales no polares, por lo que son muy apreciados como detectores de metales, armas etc… Por su sensibilidad a la resonancia molecular se utilizan para sensores y detectores de imágenes por interferometría.
Los emisores de THz se clasifican en tres categorías: Térmicos incoherentes, pulsados de banda ancha y en onda continua de banda estrecha.
El método más usado es el TDTS (pulsed spectroscopic imaging based on the time-domain terahertz spectroscopy) o imágenes de espectroscopia pulsada basada en la espectroscopia temporal a THz. Permite obtener información de todo tipo sobre el espectro de absorción, profundidad y naturaleza de los objetos etc… Tiene el inconveniente de que los componentes ópticos necesarios son grandes y costos y el sistema alcanza poca potencia.
Por el contrario el método CW (continuous-wave THz imaging system) de onda continua es relativamente compacto, simple y de bajo costo ya que no requiere ni grandes aparataje ni ópticas complejas. Para un sistema multifunción de gran ancho de banda de trabajo se usan o bien múltiples frecuencias discretas o bien una fuente de luz tuneable. Tanto la fase como las amplitudes pueden obtenerse por interferometría.
Los endoscopios-THz sobre fibra de plástico por debajo de la longitud de onda (subwavelength plastic fiber) son fáciles de implementar, las imágenes de reflexión 3D-THz poseen una razonable SNR y una gran resolución espacial. Mejorando el tiempo de adquisición con un detector rápido de THz podrá obtenerse en breve una imagen endoscópica molecular.
3. Técnicas holográficas
En holografía la dispersión lumínica de un objeto se recoge en un medio de impresión que esta siendo iluminado simultáneamente por un segundo haz de referencia produciéndose una interferencia entre ambos. El campo lumínico resultante es una holografía.
Imagen de Holografía Digital (DHI)
Se usan rejillas holográficas en multitud de aplicaciones no invasivas de UV, IR-medio. Solo las avaladas técnicamente como de calidad industrial son eficaces al poseer un SNR adecuado. Estos productos pueden adaptarse para cumplir con las longitudes de onda que se requieran.
Microscopio de Holografía digital (DHM)
Los endoscopios holográficos mono-fibra producen una imagen tridimensional con una gran profundidad de campo. El endoscopio está constituido por un sistema holográfico miniaturizado y graba una holografía de reflexión. Constan de 3 partes: el medio de impresión fotográfica, un diafragma y una fibra óptica (single-mode) de 4 µm de diámetro.
Los hologramas obtenidos se visualizan con microscopios potentes que permiten el análisis de células individuales. Poseen una NA que les permite una resolución lateral de 7 µm. No es raro que antes de grabar los hologramas se utilice constaste o tinciones en el tejido como se hace en las exploraciones de ginecología y digestivo.
Holografía cuántica (QH)
En los hologramas tradicionales la luz láser ilumina en 2 direcciones un objeto para formar un objeto fantasma en 3 dimensiones que es el holograma.
Con las nuevas técnicas de holografía se puede obtener un «holograma molecular», porque la materia se ilumina con haces de electrones obteniendo un objeto electrónico que puede verse en una microscopio de escáner con efecto túnel.
Se pueden grabar varias imágenes en el mismo holograma, cada una obtenida con diferentes longitudes de onda. Los investigadores pueden leerlas como si de un libro se tratara en distintas longitudes de onda. Y esta información puede estar miniaturizada al extremo hasta conseguir una holografía quántica.
4. Iluminación no lineal
Ligada al desarrollo de la tecnología de láser pulsados utiliza pulsos ultracortos (pico alto de baja potencia) sobre fibra óptica, con lentes de alta apertura numérica. La respuesta del espécimen es no lineal al láser incidente pero sí paramétrica ya que no se transfiere energía a la muestra y abarca dos fenómenos: Generación de armónicos y una dispersión superficial Raman estimulada (SERS).
Los endoscopios ópticos mono-fibra no lineal de baja apertura numérica con fibras de mucho grosor tienen una sensibilidad muy limitada. Para evitarlo se usan fibras largas y delgadas, eficientes en ambos sentidos (excitación/emisión) que emitan una luz en el límite de la difracción óptica y soporten los pulsos cortos de láser. Esto se consigue con las fibras de cristal fotónico (PCFs photonic cristal fibers) y MEMs constituyendo endoscopios miniaturizados monofibra basados en MEMs.
Pasaremos someramente por estas técnicas propias de un microscopio químico ya que su resolución nanométrica queda lejos de las aplicaciones de Anatomía Patológica.
Coherent Anti-Stokes Raman Scattering (CARS)
El microscopio CARS esta constituido por dos láseres (el de bombeo y el generación de stokes-antistokes) sincronizados en el tiempo, cuya diferencia de frecuencia esta adaptada a la vibración de la partícula que estamos estudiando.
En el CARS se incluye la resonancia y la no resonancia. La parte resonante es proporcional al cuadrado de la dispersión Raman, aunque la señal resultante depende del cubo de la señal incidente. Por lo tanto es una técnica no lineal, que mejora la espectroscopia Raman espontánea.
Es muy sensitivo a la vibración de los enlaces C-H por lo que es ideal para los lípidos.
Microscopía confocal CARS
El CARS (24) se ha intentado integrar en la micro-endoscopia confocal con el fin de conseguir imágenes de alta resolución de partículas en vibración. La confocalidad es coherente en el CARS. Estos endoscopios son mono-fibra, con MEMs y luz NIR.
NIVI (Non lineal interferometric vibrational imaging)
Todavía mejor que las anteriores es la técnica NIVI. Utiliza los principios del CARS y de la OCM para obtener una sección transversal de la distribución de determinadas moléculas dentro de la muestra. Se generan dos señales CARS, una procedente de una molécula de referencia y la otra de la molécula que queremos estudiar en el espécimen. Ambas señales de luz coherente se interfieren; la señal de la intensidad conjunta (envelope) nos mide la concentración y las bandas de interferencia (interference fringes) la información de la fase que permite determinar las características de vibración de las moléculas.
Microscopía no lineal en el ultravioleta profundo (DUV)
La microscopía no lineal en la región del ultravioleta profundo DUV (deep ultravioleta) para tejido gruesos, extiende la microscopía óptica a la región de la longitud de onda ultravioleta profunda de forma que se puedan detectar señales biológicas endógenas en materiales no marcados. La longitud de onda DUV se encuentra entre los 230 nm a 350 nm, aunque no está totalmente cuantificada ya que no se transmite a través del cristal y por lo tanto no puede ser observada por los métodos habituales.
El procedimiento es revolucionario y no se ha probado con anterioridad.
Microscopio de excitación fotónica
Los microscopios de excitación fotónica pueden usar un solo fotón OPE (one-photon excitation) o dos fotones TPE (Two-photon excitation microscopy) el segundo en el nivel infra-rojo IR a 730 nm. Los fotones IR mejoran la profundidad de penetración debido a que, a diferencia de la luz UV, el IR tiene un menor coeficiente de absorción y un reducido coeficiente de dispersión. Por último la microscopía de excitación multi-fotónica, MPE, utiliza el mismo principio con láser en pulsado de 100 fs a 80 MHz y longitudes de 700 a 1.050 nm. (25) Ya que la fluorescencia tiene lugar tan solo en el volumen enfocado no existe una excitación fuera del foco y la resolución 3D es intrínseca.
Los endoscopios de excitación fotónica han sido miniaturizados sobre TPE con escáneres MEMs y láseres pulsados ultracortos sobre fibras HOF (hollow-core photonic-bandgap fiber) que virtualmente elimina la distorsión de los pulsos y se aplica a neurobiología.
Microscopía SHG
La microscopía SHG (second harmonic generation) o de detección de segundo armónico, que es una propiedad de las estructuras no centro-simétricas como el colágeno, y se ha aplicado con éxito al análisis de la córnea y la lámina cribosa de la esclera.
Microscopio óptico de escaneado cerca de la muestra-NSOM
Le NSOM (near-field scanning optical microscope) Escanea el objeto con una onda de luz de radio inferior a la longitud de onda, a<<l. Con el punto de emisión cercano al objeto (distancia <a), se consigue una resolución cercana a a y N=l/2a 10 veces superior.
Lo habitual es tapar la fibra óptica por lo que la luz de la fibra además de reflejarse en el tapón es muy débil en la rendija.
En muchos casos se combina con las técnicas de excitación fotónica y hoy en día se ha conseguido integrar en un microscopio trifuncional: CM o confocal, SNOM y un AFM (atomic force microscope), pasando de uno a otro al mover la torreta del microscopio.
Dispersión-SNOM
Otra solución a nivel nanométrico es s-SNOM (scattering-type Scanning Near-field Optical Microscopy). Utiliza una gran concentración de luz en la punta de un microscopio de fuerza atómica (AFM), permitiendo imágenes de 20 nm, rompiendo la barrera de la difracción con luz visible, IR y THz.
Microscopio de Fuerza Atómica
El AFM (atomic force microscope) permite una resolución nanométrica. Trabaja recorriendo la superficie como si de una aguja reproductora de vinilos se tratara. El punto sensible se posiciona al final de la palanca y puede trabajar tocando o no la superficie del espécimen.
5. Métodos híbridos
Microscopía Fotoacústica (PAM)
Pertenece a los métodos híbridos ya que incorpora tres técnicas: la irradiación óptica, la detección ultrasónica y la formación de imagen. La iluminación con una longitud de onda de 804 nm produce una deformación del tejido que es captada con una sonda de ultrasonidos de 5 MHz, esto permite obtener imágenes de alta resolución microscópica (resolución axial de 15 µ y lateral de 45 µ) en la profundidad del tejido (hasta 3 cm) (26,27) (fig. 21).
Fig. 21:
Imagen de microscopía fotoacústica (Sacado de L.
V. Wang. Photoacustic tomography and microscopy.
http://labs.seas.wustl.edu/Wang/epub/PublishedVersion.pdf.
Through-focus scanning-optical-microscope Imaging (TSOM)
Los microscopios ópticos habituales no se consideraban para detecciones nanométricas (<100 nm) debido a las limitaciones de resolución que impone la longitud de onda usada. Sin embargo el método TSOM (Through-focus scanning-optical imaging) (4) es capaz de romper este límite.
La metodología pertenece a la iluminación no coherente, no estructurada procesada por análisis de imagen sobre imágenes captadas con un microscopio óptico habitual una cámara y una platina que se mueve a distancias predeterminadas. Con esta metodología se extiende el rango de la microscopía óptica a la micro y nanoescala detectando diferencias de hasta 3 nm.
Se graban imágenes desenfocadas a distintas distancias focales y se apilan todas ellas unas encima de otras. Un algoritmo une las partes congruentes de la imagen para obtener finalmente imágenes enfocadas de objetos minúsculos al nivel de las nanopartículas, diez veces mas pequeñas que la longitud de onda utilizada.
Imagen de Difusión Óptica
Para conseguir penetrar por encima del límite de la OCT se utiliza la imagen óptica difusa también conocida como «photon-migration imaging» y se utiliza en el DOT (Diffuse optical tomography) (fig. 22).
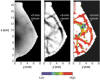
Fig. 22:
Mamografía DOT de un carcinoma de 5 mm (flecha).
Izquierda: Imagen de densidad óptica. Centro: Segunda derivada espacial con
aumento de contraste. Derecha: Imagen de oxigenación en 4 longitudes de onda con
áreas hipóxicas. Sacado de
http://www.laserfocusworld.com/articles/enlarge_image.html?siteId=lfw&id=145839
Se basa en la propiedad denominada «ventana espectral» (700-900 nm) de los tejidos en la cual la absorción lumínica debida a los cromóforos como la sangre y el agua es escasa. En esta ventana, la luz se difunde debido a la enorme dispersión. Esta difusión puede ser modelada mediante representaciones Monte Carlo o con expresiones analíticas.
El principal elemento marcador es la sangre. En NIR (Near-IR) la radiación permite la visualización del estado de oxigenación de la Hemoglobina y de la cantidad de sangre que fluye por músculo, cerebro o mama. Es una imagen NIR funcional ya que muestra la respuesta de la sangre a la función del tejido. Otra de las señales es el agua y los lípidos porque no son funcionales.
La detección de otros elementos como los cancerosos probablemente necesite balizas moleculares específicas. Una de ellas es la tricarbocianina fluorescente al NIR y que se une a una proteína específica del tumor mostrándonos su localización. También se ha ensayado con biomarcadores de los depósitos de amiloide-b en el Alzheimer.
DISCUSIÓN
Hace unos años los Departamentos de Anatomía Patológica luchaban por integrar en los mismos a todos los especialistas clínicos que hacían Anatomía Patológica (hepática, renal, ginecológica, oftalmológica, dermatológica…).
Ahora van a ser los Departamentos Clínicos los que hagan la Anatomía Patológica porque utilizarán técnicas no invasivas,
y los patólogos deberán ponerse al día para saber colaborar con los mismos en régimen de tele-diagnóstico, ya que pueden encontrarse con el tiempo con laboratorios vacíos del contenido clásico de diagnóstico quirúrgico y llenos en cambio de de subespecialidades avanzadas acordes con las nuevas tecnologías y avances técnicos (2).
De las técnicas estudiadas podemos comprobar que las de iluminación no estructurada, la iluminación estructurada y la interferometría incluyendo las técnicas holográficas y los métodos híbridos ofrecen en muchos casos imágenes morfológicas comparables a la microscopía y que por lo tanto deben estar interpretadas por un patólogo. Este es el campo de la biopsia óptica en los departamentos de Anatomía Patológica. Deben considerarse en régimen de teleconsulta ya que al estar integradas en las técnicas de microendoscopia no es viable que el patólogo se encuentre presente en las mismas, pero sí necesitarían ser examinadas por un experto en microscopía.
De las que hemos visto la endomicroscopía confocal, el PAM y la OCT de Ultra alta resolución con o sin contraste, ofrecen calidad histológica quirúrgica y deberían ir integrándose en la clínica en cooperación con la Anatomía Patológica en procesos diagnósticos para los cuales hace falta un estándar-oro.
Si consideramos los tipos de estándares-oro clásicos en Anatomía Patológica a saber: (1) Experiencia mejor que evidencia; (2) Conocimiento de la literatura; (3) Evidencia científica (4) Interpretación (6) Impresión personal, es obvio que cuanto antes acumulemos experiencia e imágenes que puedan consultarse por el mayor numero de patólogos, antes conseguiremos establecer el estándar-oro y que la técnica de la biopsia óptica, particularmente aquella de bases morfológicas, sea incorporada a la rutina diagnostica. De ahí que un banco de imágenes de biopsia óptica accesible a la comunidad científica en un entorno GRID parecido al del atlas de proteínas (28) sea en la actualidad muy necesario.
Hemos visto como la endomicroscopía confocal tiene una calidad microscópica e inmunológica extraordinaria, pero adolece de una penetración limitada (fig. 1) y por eso ha sido ampliamente aceptada en endoscopia intestinal. Sin embargo otras técnicas como el PAM o la UH-OCT posee mucha mayor penetración axial por lo que tendrán que introducirse progresivamente en la clínica para ampliar el ámbito de la biopsia óptica.
Además las técnicas HOF sobre nuevos materiales permitirán conseguir en un futuro inmediato, una calidad superior a la histológica e igualmente, la mejora de las técnicas moleculares y de inmuno-micro-endoscopia serán un campo fundamental para los especialistas de Fármaco-patología y de gran trascendencia en las terapias personalizadas, que como ya indicamos en otro lugar (2) deben ir potenciándose en un laboratorio de Anatomía Patológica.
BIBLIOGRAFÍA
Wang TD, Van Dam J. Optical Biopsy: A New Frontier in Endoscopic Detection and Diagnosis. Clin Gastroenterol Hepatol 2004; 2: 744-53.
Ferrer-Roca O. Anatomía Patológica digital. Control de calidad y patoinformática. Rev Esp Patologia 2009; 42: 85-95.
Ferrer-Roca O, Marcano F, Diaz-Cardama A. Digital Zooming in Medical Images. En Ferrer-Roca O. Ed. Tenerife: CATAI Ed., 2005; 111-18.
Attota R, Germer TA, Silver RM. Through-focus scanning-optical-microscope imaging method for nanoscale dimensional analysis. Optics Letters 2008; 33: 1990-2.
Balas C, Papoutsoglou G, Potirakis A. In Vivo Molecular Imaging of Cervical Neoplasia Using Acetic Acid as Biomarker. IEEE J Select Topics Quantum Electronics 2008; 14: 29-42.
Freeberg JA, Serachitopol DM, McKinnon N, Price R, Atkinson EN, Cox DD, MacAulay C, Richards-Kortum R, Follen M, Pikkula B. Fluorescence and reflectance device variability throughout the progression of a phase II clinical trial to detect and screen for cervical neoplasia using a fiber optic probe Journal of Biomedical Optics 2007; 12: 034015.
WavSTAT Optical Biopsy and Luma cervical imaging systems.
Disponible en:
http://www.optimum-tech.com/clientsandprojects/optical_biopsy_system.cfm.
Endomicroscopy.com. Disponibles en: http://www.endomicroscopy.com
OptiScan© website. Disponible en: http://www.optiscan.com/Technology/Five1/Five1_01.asp
Nano-based capsule-Endoscopy with Molecular Imaging and Optical biopsy. Disponible en: http://fcs.itc.it/NEMO/index.html
Swain P. The future of wireless capsule endoscopy. World J Gastroenterol 2008; 14: 4142-5.
Nakamura T, Terano A. Capsule endoscopy: past, present, and future J Gastroenterol. 2008; 43: 93-9.
New York State Science & Technology Law Center at Syracuse University College of Law. The Optical Biopsy pill. Research project for Infotonics Inc. Disponible en: http://www.medisciencetech.com/append/OpticalBiopsyPill.htm
Kuznetsova Y, Neumann A, Brueck SRJ Imaging interferometric microscopy J Opt Soc Am A 2008; 25: 811-22.
Hurlstone DP, Tiffin N, Brown SR, Baraza W, Thomson M, Cross SS. In vivo confocal laser scanning chromo-endomicroscopy of colorectal neoplasia: changing the technological paradigm. Histopathology 52: 417-26.
Hsiungn PL, Phatak, DR, Chen Y. Aguirre AD, Fujimoto JG, Connolly JL. Benign and Malignant Lesions in the Human Breast Depicted with Ultrahigh Resolution and Three-dimensional Optical Coherence Tomography Radiology 2007; 244: 865-74.
Pitris C. Optical coherence tomography in Medicine and biology. Disponible en: http://www.eng.ucy.ac.cy/biaolab/Education/tutorials/OCTMedBio2002.pdf
Lam S, Standish B, Baldwin C, McWilliams A, LeRiche J, Gazdar A, Vitkin AI, Yang V, Ikeda N, MacAulay C. In vivo Optical Coherence Tomography Imaging of Preinvasive Bronchial Lesions. Clinical Cancer Research 2008; 14: 2006-11.
Obel research. Optical Coherence tomography. Disponible en: http://obel.ee.uwa.edu.au/research/
Ralston TS, Marks DL, Carney PS, Boppart SA. Real-time interferometric synthetic aperture microscopy. Opt Express 2008; 16: 2555-69.
Dubois A, Moreau J, Boccara C. Spectroscopic ultrahigh-resolution full-field optical coherence microscopy. Optics Express 2008; 16: 17082-91.
Boppart SA, Drexler W, Morgner U, Kirtner FX, Fujimoto JG. Ultrahigh Resolution and Spectroscopic OCT Imaging of Cellular Morphology and Function. Proc Inter-Institute Workshop on In Vivo Optical Imaging at the National Institutes of Health. Ed. Gandjbakhche AH. 2008 September 16-17, pp. 56-61.
Xu C, Vinegoni C, Ralston TS, Luo W, Tan W, Boppart SA. Spectroscopic spectral-domain optical coherence microscopy. Opt Lett 2006; 31: 1079-81.
Muller M, Squier J, deLange CA, Brakenhoff GJ. CARS microsocopy with folded BoxCARS phasematching J. Microsc 2000; 197: 150-8.
Daekeun K, Ki Hean K, Siavash Y, Peter TCS. Optical biopsy in high-speed handheld miniaturized multifocal multiphoton microscopy SPIE. Multiphoton Microscopy in the Biomedical Sciences V, Ammasi Periasamy; Peter T. C. So, Ed., Proceedings 2005; 5700: 14-22.
Maslov K, Zhang HF, Hu S, Wang LV. Optical-resolution photoacoustic microscopy for in vivo imaging of single capillaries, Opt Lett 2008; 33: 929-31.
Zhang HF, Maslov K, Stoica G, Wang LV. Functional photoacoustic microscopy for high-resolution and noninvasive in vivo imaging, Nat Biotechnol 2006; 24: 848-51.
The human protein atlas. Disponible en: http://www.proteinatlas.org/