
Vol. 42, n.º 3, 2009
REVISTA
ESPAÑOLA DE
Vol. 42, n.º 3, 2009 |
CASUÍSTICA
Francisco Javier Torres Olivera1, Francisco Javier Torres Gómez2, Mario Díaz Delgado3, María Teresa Vargas de los Monteros4
1 Hospital
Universitario Virgen Macarena (Sevilla).
2 Hospital de Alta Resolución de Utrera (Sevilla).
3 Hospital General de Mérida.
4 Servicio de Anatomía Patológica. Unidad de Genética. Hospital
Universitario Virgen Macarena (Sevilla).
javiertorresgomez@yahoo.es
RESUMEN
Las descripciones del cuadro citológico del tumor fibroso solitario pulmonar (TFSP) en la literatura son escasas. Aportamos un caso de TFSP cuyas características de malignidad han sido confirmadas mediante estudio histológico, inmunohistoquímico, citogenético y FISH. La presencia de células dendríticas es un dato morfológico orientativo en el diagnóstico de esta lesión. No hemos confirmado en nuestro caso la presencia de hendiduras ni pseudoinclusiones nucleares, referidas por otros autores como hallazgo frecuente en casos de TFSP maligno.
Palabras clave: Tumor fibroso solitario pulmonar maligno, FISH, células dendríticas.
SUMMARY
Descriptions of the cytology of pleural malignant solitary fibrous tumour are uncommon in the literature. We report a case of PSFT with malignant cytological features confirmed by histology, immunochemistry, citogenetics and FISH. The presence of dendritic cells is a useful diagnostic feature. However, we were unable to confirm the presence of nuclear clefts and pseudoinclusions reported as common findings by other authors.
Keywords: Pleural malignant solitary fibrous tumor, FISH, dendritic cells.
INTRODUCCIÓN
El tumor fibroso solitario pleural (TFSP) es una neoplasia de características fibroblásticas (1,2), generalmente de curso benigno, siendo la exéresis habitualmente curativa. Las recidivas o metástasis ocurren entre el 10 y el 30% de los casos (3) sin que las características histológicas clásicas de malignidad sean siempre predictivas de esta evolución desfavorable (4,5). A pesar de la heterogeneidad de patrones histológicos entremezclados presentes en este tumor junto a la dificultad de obtener muestras representativas de las diferentes áreas mediante FNAC, se ha establecido correlación citohistológica con apoyo inmunohistoquímico (6,7,8). Utilizando muestras citológicas obtenidas mediante raspado del tejido sin fijar remitido para estudio intraoperatorio se ha logrado, además de establecer la adecuada correlación citohistológica, evaluar el comportamiento biológico en este tipo de tumores (9).
Aportamos los hallazgos citológicos obtenidos en un caso de TFSP con características histológicas de malignidad, corroboradas con el estudio inmunohistoquímico, citogenético y FISH.
CASO CLÍNICO
Mujer de 43 años que ingresa en nuestro hospital por diagnóstico de derrame pleural tabicado, disnea grado II/IV, pérdida de peso e hiperglicemia (137 mg/dl). La radiología y TAC muestran masa tumoral que sustituye lóbulos medio e inferior de pulmón derecho y derrame pleural. En la intervención se extraen 1.800 c.c. de líquido serohemático, observándose un tumor lobulado que comprime los lóbulos medio e inferior del pulmón derecho, que presentan aspecto atelectásico. El tumor se diseca con facilidad, permaneciendo unido a la pleura visceral mediante un pedículo vascular. Los lóbulos atelectásicos se expanden tras la exéresis tumoral. La paciente se encuentra bien, sin recidiva ni metástasis, 2 años después de la intervención.
Estudio macroscópico
Pieza quirúrgica de 1.455 g de peso y 17,8 x 13 x 8 cm de superficie abollonada (figs. 1 y 2). A los cortes seriados la superficie es multinodular, con áreas de aspecto fasciculado que alternan con otras microquísticas, mixoides y de aspecto necrótico. Se realiza rascado y extensión sobre portaobjetos de varias zonas de la tumoración para estudio citológico. Tras la fijación de la pieza en solución acuosa de formol al 10% durante 24 horas, las numerosas muestras obtenidas se incluyeron en parafina, obteniéndose cortes histológicos de 3 micras de espesor teñidos con HE para estudio histológico convencional y otros montados sobre portaobjetos sialinizados para estudio inmunohistoquímico. Éste se ha realizado de forma automática en un procesador tipo Ventana empleando anticuerpos frente a los antígenos CD34, bcl2, p53, proteína S100, vimentina, calretinina, beta catenina y receptores de progesterona.
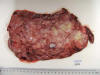
Fig. 2:
Imagen macroscópica: Detalle.
Estudio citológico
Los extendidos muestran densa celularidad a expensas de elementos fusiformes de escaso citoplasma y núcleos ovoides o redondeados con marcada anisocariosis, frecuente moldeamiento, nucleolo ausente y cromatina gruesa regularmente distribuida, lo que les confiere un aspecto hipercromático. Las mitosis son frecuentes. No se observan células multinucleadas ni pleomórficas, hendiduras ni pseudoinclusiones nucleares. En otras extensiones resulta aparente una trama vascular a expensas de capilares finos ramificados. En relación con estos, y también distribuidas de forma irregular entre las células descritas, se identifican numerosas células de aspecto dendrítico con prolongaciones finas, largas y múltiples que emergen de un citoplasma anfófilo o eosinófilo. El núcleo es central, vesicular, de borde liso, y la cromatina es fina y regularmente distribuida. Asimismo hemos observado escasas células fusiformes de tipo bipolar (figs. 3 a 8).
![]()
Figs. 3 a 5:
Células dendríticas. HE 40x.
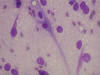
Fig. 6:
Células dendríticas. Giemsa. 40x.
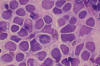
Fig. 7:
Marcada atipia nuclear y actividad mitósica. Impronta. MGG. 40x.
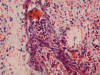
Fig. 8:
Gran capilaridad de los extendidos citológicos. Pap 20x.
Estudio histológico
El estudio microscópico convencional muestra patrones histológicos diferentes entremezclados: fusocelular, con diferentes densidades celulares, disposición fascicular o en remolinos con variable cantidad de colágeno, a veces hialinizado, mixoide, fibroso, hemangioendoteliomatoso y anaplásico, con alta densidad de células, frecuentemente multinucleadas y pleomórficas, con alto índice mitósico (> 4 x 10 CGA). No se han observado áreas de necrosis tumoral. La interfase del tumor con el tejido pulmonar es de tipo expansivo/compresivo (figs. 9 y 10).
![]()
Figs. 9 y 10:
Histología de la lesión. Puede observarse llamativo pleomorfismo nuclear e
importante actividad mitósica. HE 20x.
Estudio inmunohistoquímico
Las células tumorales exhiben inmunopositividad frente a los anticuerpos vimentina, CD34, Bcl2, beta catenina, e inmunonegatividad frente a citoqueratina, proteína S100, actina, desmina, calretinina y receptores de progesterona. La expresión de Ki-67 y p53 se encuentra muy incrementada.
Estudio citogenético y de FISH
Se ha realizado estudio cromosómico a partir del tejido tumoral no fijado al que se le han aplicado técnicas de bandas GTG y FISH con sondas WCP1, WCP9, WCP10 y LSI BCR/ABL-ES para estudio de cromosomas derivativos. El estudio cromosómico revela dos líneas celulares, una con 47 cromosomas, siendo el cromosoma supernumerario el cromosoma marcador, mostrando el cromosoma 1 deleción de parte de sus brazos largos con material genético no identificado. Asimismo se observa un cromosoma derivativo formado por fragmentos de los cromosomas 9 y 10, verificándose una delección de los brazos largos del cromosoma 9 y una deleción de parte de los brazos cortos del cromosoma 10 y complemento gonosómico XX. La línea celular restante presenta 46 cromosomas sin alteraciones y complemento gonosómico XX. Con técnicas de FISH se ha podido comprobar en 120 células que el cromosoma derivativo 1 está formado por material genético de los cromosomas 1 y 9, conteniendo éste parte del gen ABL. El cromosoma derivativo 9 está formado por material genético de los cromosomas 9 y 10. Asimismo el cromosoma marcador está formado por material genético del cromosoma 9, siendo éste parte del gen ABL.
DISCUSIÓN
El TFSP es una neoplasia mesenquimal poco frecuente también descrita en otras localizaciones (2,10). Su histogénesis es controvertida, demostrándose su naturaleza fibroblástica ultraestructural e inmunohistoquímicamente (1,2,10). Otros autores sugieren su origen en el sistema de células dendríticas intersticiales presentadoras de antígenos del tejido conectivo (11), situándolo en un extremo del espectro lesional integrado por el lipoma de células fusiformes y el fibromixolipoma de células dendríticas (12). La demostración ultraestructural de células dendríticas en las tres lesiones junto a una expresión inmunohistoquímica común (positividad frente a CD34 y Bcl-2) sugieren una estrecha relación entre ellas.
Las escasas descripciones de las características citológicas del TFSP existentes en la literatura son bastante inespecíficas y la orientación diagnóstica está basada en la inmunohistoquímica (6-8). La serie más importante de casos establece correlación entre determinadas características citológicas y el patrón histológico del tumor (9). Los hallazgos morfológicos en nuestro caso (alta densidad celular, anisocariosis marcada, cromatina gruesa, bajo cociente N/C y elevado número de células dendríticas) han sido correlacionados con el patrón histológico de tipo celular (9). Hemos observado estrecha relación entre células dendríticas y capilares. Estas exhiben núcleos vesiculares, de menor tamaño que el de las células neoplásicas acompañantes, con borde liso y cromatina fina y regular. No hemos encontrado colágeno quizás debido a que las áreas de aspecto más fibroso fueron desechadas para el rascado.
Los casos orientados citológicamente como malignos en la literatura corresponden histológicamente al patrón celular y presentan características adicionales tales como frecuentes hendiduras y pseudoinclusiones nucleares, pleomorfismo nuclear y mitosis (9). Nuestro caso muestra frecuentes mitosis pero no el resto de los hallazgos referidos. Sin embargo la presencia de células pleomórficas se ha demostrado en el estudio histológico, por lo que su ausencia en el material citológico puede deberse a la falta de muestreo de esas áreas.
Las características que definen la malignidad del TFSP son controvertidas (4). En nuestro caso el diagnóstico histológico se confirma con el estudio inmunohistoquímico y se cumplen los criterios de malignidad, salvo la necrosis tumoral, reforzados por la sobre expresión de p53 y alto Ki 67 (13,14). Sin embargo el crecimiento expansivo y la evolución favorable de la paciente contradicen dichos criterios. Las alteraciones cromosómicas encontradas sugieren una anomalía genética celular suficiente para justificar el carácter maligno de la lesión. Se ha sugerido que un gen en 9q22 puede relacionarse con la patogénesis del TFSP (15). El reordenamiento del gen ABL en el cromosoma 1 y en el cromosoma marcador junto con la delección 1p y 10p sugieren el carácter maligno de la lesión.
Creemos, junto a otros autores (9) que el conjunto de características morfológicas obtenidas mediante raspado múltiple de la pieza quirúrgica sin fijar posibilitan el diagnóstico citológico del TFSP.
Aportamos el presente caso con la pretensión de incrementar el conocimiento citológico de este tipo de lesiones poco frecuentes.
BIBLIOGRAFÍA
Scharifker D, Kaneko M. Localized fibrous «mesothelioma» of pleura (submesothelial fibroma): a clinopathologic study of 18 cases. Cancer 1979; 43: 627-35.
Westra W, Gerald W, Rosai J. Solitary fibrous tumor. Consistent CD34 immunoreactivity and occurrence in the orbit. Am J Surg Pathol 1994; 8: 992-8.
De Leval L, Defraigne G, Hermans G, Dome F, Boniver J, Herens C. Malignant solitary fibrous tumor of the pleura: report of a case with cytogenetic analysis. Virchow Arch 2003; 442: 388-92.
Moran D, Suster S: Tumors of the lung and pleura. In Diagnostic Histopatology of Tumors Vol 1, 201-202, chapter 5, C Fletcher Edit 2.ª edition. London: Churchill Livingstone; 2000.
Stratil D, Kren L, Hermanova M, Brazdil J, Votava M, Dvorak K . Solitary fibrous tumorof the pleura; description of two cases with features of malignancy. Cesk Patol 2004; 40: 106-8.
Clayton A, Salomao D, Nascimento A. Solitary fibrous tumor: a study of cytologic features of six cases diagnosed by fine-needle aspiration. Diagn Cytopathol 2001; 25: 172-6.
Ali S, Hoon V, Hoda S, Heelan R, Zakowski M. Solitary fibrous tumor. A cytologic-histologic study with clinical, radiologic and immunohistochemical correlations. Cancer 1997; 25: 116-21.
Drachenberg C, Bourquin P, Cochran L, Burke K, Kumar D, Papadimitriou JL. Fine needle aspiration biopsy of solitary fibrous tumors. Report of two cases with histologic, immunohistochemical and ultrastructural correlation. Acta Cytol 1998; 42: 1003-10.
Okada S, Ebihara Y, Kudo M, Kudo M, Serizawa H, Shimizu T et al. Scratch Cytologic Finding on Surgically Resected Solitary Fibrous Tumours of the Pleura. Acta Cytol 2001; 45: 372-80.
Chilori M, Facchetti F, DeiTos A, Lestani M, Morassi M, Montignoni G et al. Bcl2 expression in pleural and extrapleural solitary fibrous tumors. J Pathol 1997; 181: 362-7.
Van de Rijn M, Rouse RV. CD34. A review. Appl Immunohistochem 1994; 2: 71-80.
Maggio P, Szumigala J, Brooks J. CD34 positive spindle cell lipoma. Are some cases incipient solitary fibrous tumors? Mod Pathol 1996; 9: 10A
Yokoi T, Tsuzuki T, Yatabe Y, Suzuki M, Kurumaya H, Kashikawa T. Solitary fibrous tumour:significance of p53 and CD34 immunoreactivity in tits malignat transformation. Histopathology 1998; 32: 423-32.
Zhang H, Lucas D, Pass H, Che M. Disseminated malignant solitary fibrous tumor of the pleura. Pathol Int 2004; 54: 111-15.
Havlik D, Farnath D, Bocklage T. Solitary fibrous tumor of the orbit with a t(9;22) (q31;p13). Arch Pathol Lab Med 2000; 124: 756-8.