
Vol. 42, n.º 3, 2009
REVISTA
ESPAÑOLA DE
Vol. 42, n.º 3, 2009 |
CASUÍSTICA
Julio Alexander Díaz-Pérez, Jorge Andrés García-Vera, Ernesto García-Ayala
Grupo de Investigación en Patología Estructural,
Funcional y Clínica de la Universidad Industrial de Santander y Fundación para
el Avance de la Anatomía Patológica, Citología y Clínica Molecular, Bucaramanga,
Colombia.
pat_uis@yahoo.com
RESUMEN
Introducción: Los tumores de células de la granulosa, en algunas ocasiones se pueden situar en lugares aberrantes extra gonadales. Estas formas ectópicas son extremadamente infrecuentes. Sin embargo, existe un gran debate sobre el origen de estas neoplasias. Objetivo: Describir un caso de tumor de células de la granulosa extraovárico identificado en una paciente del Hospital Universitario de Santander y realizar una discusión sobre su génesis, clínica e histopatología. Caso Clínico: Mujer de 69 años de edad, que consultó por masa abdominal, con historia de histerectomía con salpingo ooferectomia bilateral, 14 años antes, por múltiples leiomiomas uterinos, a quien se le encontró una gran masa, dolorosa a la palpación, a nivel de hipocondrio y flanco izquierdo, la cual fue documentada por ecografía abdominal y Tomografía Axial Computarizada (TAC), en retroperitoneo a la altura de la cola pancreática. La masa fue resecada, encontrándose numerosas adherencias que comprometían el riñón izquierdo y el colon. Estudio Anatomo-Patológico: La masa era sólido quística, de 950 g y de 12 x 11,5 x 10 centímetros de diámetros mayores cruzados. En el estudio histopatológico e inmunofenotípico se confirmó el diagnóstico de tumor de células de la granulosa extra ovárico. Estrategia de búsqueda de la literatura: Se realizó una búsqueda estructurada de la literatura, con base en la metodología Cochrane, en las bases de datos Medline, Imbiomed y Scielo. Conclusión: Los tumores de células de la granulosa extra ováricos son neoplasias extremadamente infrecuentes, con el presente solo existen 11 casos reportados, los cuales parecen ser derivados de tejidos gonadales ectópicos, o de la diferenciación a estos, por parte de células mesenquimales primitivas. Su adecuado estudio por medio de una correcta correlación clínica, morfológica e inmunofenotipica, permite su reconocimiento entre un amplio número de diagnósticos diferenciales.
Palabras clave: Tumor de células de la granulosa, tumores de los cordones sexuales, tejido ectópico, caso clínico, revisión de la literatura (Fuente: DeCS).
SUMMARY
Introduction: Occasionally, granulosa cell tumours are found in unusual, extragonadal locations, although such ectopic forms are extremely rare and the origin of these neoplasms is controversial. Objective: A case of extraovarian granulosa cell tumour is described and its origin, clinical features and histopathology are discussed. Case history: A 69 year old woman presented with an abdominal mass. She had undergone hysterectomy and bilateral salpingooophorectomy for uterine leiomyomas 14 years previously. A large, tender mass was present in the left hypochondrium and left lumbar region, which was seen on abdominal ultrasonography and CT scan to be situated in the retroperitoneum near the tail of the pancreas. Surgery revealed that the left kidney and colon were involved. Pathology: The 950 g, 12 x 11.5 x 10 cm mass was composed of both solid and cystic areas. Histological and immunophenotypical findings indicated a diagnosis of extraovarian granulosa cell tumour. Review of the literature: A review of the literature was made from Medline, Imbiomed and Scielo databases, using the Cochrane methodology. Conclusion: Extraovarian granulosa cell tumours are extremely infrequent neoplasms, with only 10 cases reported to date. They would appear to arise from ectopic gonadal tissue or from the differentiation of primitive mesenchymal cells. Clinical, morphological and immunophenotypical features should all be considered in order to reach a correct differential diagnosis from a wide range of entities.
Keywords: Granulosa cell tumour, Sex Cord-Gonadal Stromal Tumors, ectopic tissues, case report, review of the literature (Source: MeSH).
INTRODUCCIÓN
Los tumores estromales y de los cordones sexuales del ovario son un grupo de neoplasias diversas, entre los que se encuentran, los tumores de células de la granulosa, los tumores de células de Sertoli, los tumores de células de Leydig, los fibrotecomas, los tumores de los cordones sexuales con túbulos anulares y otras neoplasias no clasificadas (1,2). Estos tumores son fácilmente identificables si se encuentran bien diferenciados y se localizan en las gónadas (1-3). Sin embargo, esto no siempre se cumple, en algunas ocasiones estas neoplasias tienen una morfología indiferenciada y además se pueden situar en lugares aberrantes (1,3,4). Estas formas ectópicas son extremadamente infrecuentes y se han reportado en diferentes localizaciones tales como la glándula adrenal, retroperitoneo, las trompas de Falopio y el ligamento ancho (4-13). Existe un gran debate sobre el origen de estos tumores cuando no tienen su localización usual (4,10,11), anteriormente se consideraba que estas neoplasias debían denominarse mesenquimomas, ya que se pensaba, tenían su origen a partir de la cresta genital embrionaria (14), concepto que se ha modificado en años recientes con la proposición de múltiples hipótesis sobre su génesis (15,16). Los tumores de células de la granulosa en la actual clasificación, se considera que derivan de las células de la granulosa o de sus progenitores, los cordones sexuales; de este tipo especifico de neoplasias también se han documentado la existencia de localizaciones aberrantes, las cuales son muy infrecuentes, con tan sólo 10 casos reportados en las bases de datos consultadas a nivel mundial, ninguno de ellos en Colombia (1,3,4-13). Por lo anterior, se trazó como objetivo describir un caso de tumor de células de la granulosa extraovárico identificado en una paciente del Hospital Universitario de Santander y realizar una discusión sobre su génesis, clínica e histopatología.
MATERIALES Y MÉTODOS
Caso clínico
Mujer de 69 años de edad, que consultó por fiebre, deposiciones diarreicas y masa abdominal; con antecedentes de histerectomía con salpingo-ooferectomia bilateral hace 14 años por múltiples leiomiomas uterinos, con resultado de Patología que descartó patología ovárica previa (fig. 1). Antecedentes no ginecológicos: colecistectomía por colelitiasis, tiroidectomía por bocio simple y diabetes mellitus en tratamiento con hipoglicemiantes orales. En la revisión por sistemas no se documentaron síntomas endocrinos específicos. Al examen físico se encontró paciente en buenas condiciones generales, con gran masa a nivel de hipocondrio y flanco izquierdo de aproximadamente 10 x 15 cm de diámetro, dolorosa a la palpación. Por lo anterior, se realizó ecografía abdominal en la cual se evidenció una masa localizada en relación al páncreas, ubicada por debajo del bazo y por encima del riñón izquierdo, de predominio sólido, con múltiples áreas quísticas, de forma redonda, de 112 x 110 x 98 mm de diámetro y un volumen de 636 cc, con ausencia quirúrgica de útero y ovarios. En este examen no se reconocieron otras alteraciones (fig. 2) Posteriormente se realizó Tomografía Axial Computarizada (TAC) de abdomen en la cual se encontró masa de 11 x 12 cm, que ocupa el hemiabdomen izquierdo adyacente, a la altura de la cola pancreática, con textura heterogénea, con escasa impregnación del medio de contraste y con áreas hipondensas que sugirieron componentes quísticos o necróticos; además se reconocieron contornos bien definidos con nodulaciones internas que se impregnaron ligeramente con el contraste. Se documentó elevación de los niveles séricos de estrógenos, los cuales alcanzaron un nivel de 173 pg/ml (valor normal 10-50).
![]()
Fig. 1:
En la imagen se muestra el ovario derecho (A) y
el ovario izquierdo (B) los cuales exhibían múltiples cuerpos albicans y muy
escasos folículos dispuestos sobre un estroma fusocelular (HE 4x).
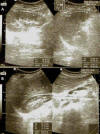
Fig. 2:
Imágenes ecográficas en las cuales se puede
reconocer la lesión, localizada en relación al páncreas, ubicada por debajo del
bazo y por encima del riñón izquierdo, de predominio sólido, con múltiples áreas
quísticas, de forma redonda, de 112 x 110 x 98 mm de diámetro y un volumen de
636 cc.
Durante el ingreso hospitalario, la paciente cursa con múltiples episodios de emesis, ausencia de deposiciones y ruidos intestinales, por lo cual se considera obstrucción intestinal, y se lleva a cirugía, encontrándose un tumor localizado en retroperitoneo, bien encapsulado, sin compromiso directo de estructuras adyacentes, pero con múltiples adherencias fibróticas que comprometían vasos cólicos izquierdos y vasos renales izquierdos, así como algunas adherencias laxas sobre aorta abdominal inferior. Se realizó resección de tumor retroperitoneal, con nefrectomía izquierda y resección segmentaria de colón descendente con anastomosis término-terminal de colon, por el compromiso de la vasculatura de los mismos. No se administró ningún tipo de terapia adyuvante. Después de la cirugía la paciente evolucionó adecuadamente. Actualmente la paciente se encuentra asintomática, sin signos de recurrencia tras un seguimiento de 15 meses.
Estudio Anatomo-Patológico
En el Departamento de Patología de la Universidad Industrial de Santander se recibió masa sólido quística, encapsulada, de superficie externa irregular, pardo amarillenta, congestiva y hemorrágica, de 950 g y de 12 x 11,5 x 10 centímetros de diámetros mayores cruzados; la cual al corte, mostró múltiples loculaciones repletas de líquido seroso amarillento. Aparte se recibió segmento del colon descendente de 19 x 5 cm, desvitalizado, sin compromiso macroscópico por el tumor, con adherencias mesentéricas, así como riñón izquierdo, producto de nefrectomía simple, de 10,8 x 7 x 4,5 cm, y 205 gr, de aspecto desvitalizado, sin compromiso macroscópico por el tumor (fig. 3).
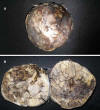
Fig. 3:
La pieza quirúrgica era una gran masa (950 g y de
12 x 11,5 x 10 centímetros de diámetros mayores cruzados) de superficie externa
irregular, pardo amarillenta, congestiva y hemorrágica; la cual al corte,
evidenció múltiples áreas quísticas y sólidas, de superficie heterogénea, que
contenían un segmento de colon, múltiples vasos sanguíneos, y el uréter del
riñón izquierdo.
En el estudio histopatológico se reconoció lesión tumoral derivada de los cordones sexuales, compuesta por gran cantidad de células, de pequeño tamaño, con núcleos vesiculosos, irregulares, de contorno hipercromático, con ocasionales hendiduras nucleares longitudinales y citoplasma escaso y eosinófilo. Estas células se disponían formando rosetas, cordones y trabéculas (fig. 4). En el estudio inmunohistoquímico, se utilizó el panel de anticuerpos mostrados en la tabla 1. Esta lesión mostró expresión citoplasmática marcada para inhibina, siendo negativa para S100, Calretinina y Melan-A. Con lo anterior se emitió el diagnóstico del tumor de células de la granulosa extra ovárico (fig. 5).
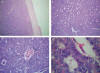
Fig. 4:
En los cortes con Hematoxilina-Eosina se reconoce
una neoplasia con una cápsula de tejido conectivo (A, 4x), constituida por
células de núcleo oval, vesículoso y citoplasma escaso, dispuestas formando
estructuras foliculares de pequeño tamaño «cuerpos de Call-Exner» (B y C, 10 y
40x). A mayor aumento (D, 100x), se reconocieron ocasionales hendiduras
nucleares longitudinales.

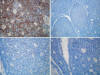
Fig. 5:
Perfil de inmunohistoquímica, en el que se
reconoce marcada expresión citoplasmática para inhibina en A, y ausencia de
expresión para calretinina en B S100 en C y MelanA en D.
Estrategia de búsqueda de la literatura
Se realizó una búsqueda estructurada de la literatura, con base en la metodología Cochrane, en las bases de datos Medline, Imbiomed y Scielo, utilizando las palabras clave «granulosa cell tumor», «extraovarian», y «Sex Cord-Gonadal Stromal Tumors» desde el año 1990 a Diciembre de 2008, limitando la búsqueda a artículos originales escritos en idioma inglés y español, la metodología empleada se muestra en la tabla 2. De los artículos encontrados, se seleccionaron los considerados relevantes por los autores.

DISCUSIÓN
Los tumores de las celulas de la granulosa y los demas tumores de los cordones sexuales se pueden originar en otras ubicaciones diferentes al mesenquima de las gónadas (4), lo anterior se ha expuesto en ocasionales casos, el primero de ellos fue publicado por Voigt en el año de 1938, y posteriormente se han informado 10 casos en estas extrañas localizaciones (tabla 3) (4-13). De estos casos, ha llamado gran interés su origen, ya que hasta la fecha se cree que los tumores de las células de la granulosa del ovario, según criterios morfologicos, bioquímicos y moleculares, se derivan de las celulas de la granulosa de los folículos ováricos (3,15). Hasta el momento se conoce que el perfil de prolifereción genética observado en estos tumores es similar al de las células de la granulosa de los folículos ováricos (16,17). Estas células de la granulosa proliferan al ser estimuladas por la hormona folículo estimulante (FSH, por sus siglas en inglés, Follicle Stimulating Hormone) (17); por lo anterior, se ha sugerido que la activación de la vía de la FSH es de particular importancia en su génesis. Sin embargo, esta teoría no se ha comprobado por completo (17-19). Otras hormonas que tienen importancia en su desarrollo son los estrógenos. Se ha observado sobreexpresión del gen del receptor de los estrógenos en algunos de estos tumores (20).

En el origen de estas neoplasias en sitios aberrantes se han planteado diversas hipótesis (4,9-11), como:
1. Presencia de ovarios supernumerarios o accesorios.
2. Células germinales y primordiales desplazadas o detenidas en su migración del saco embrionario a las crestas gonadales con capacidades para diferenciarse en células de los cordones sexuales.
3. La inducción por parte de los folículos primordiales, al mesotelio para proliferar y formar tejidos ováricos.
4. La participación del mesonefros en la creación de los cordones sexuales.
5. Y por último, algunos tumores extraováricos podrían originarse de células somáticas, particularmente del estroma endometrial, o bien, del mesénquima gonadal primitivo que haya sufrido diferenciación hacia los cordones sexuales.
De las anteriores hipótesis ninguna se ha comprobado ni descartado, pero en la actualidad se cree que estos tumores son derivados de tejidos gonadales ectópicos, o de la diferenciación a estos, por parte de células mesenquimales primitivas.
Los tumores de células de la granulosa extraováricos se pueden encontrar en un amplio rango de edad, informándose desde los 30 años, hasta los 69 años, siendo el de mayor edad hasta el momento informado el actual caso (tabla 3), con estos casos se calcula una media de edad 49,63 años. Estos tumores se asocian a múltiples alteraciones secundarias al alto nivel de las hormonas producidos por ellos, como son sangrado vaginal anormal, amenorrea o hiperplasia endometrial, las cuales fueron referidas en 9 de los 11 casos encontrados, en nuestro caso la paciente cursó con niveles de estrógenos elevados sin repercusión debido a la ausencia quirúrgica de útero y ovarios. A pesar de lo anterior, parece ser que el mejor dato clínico para su sospecha diagnostica es la presencia de masa pélvica en una paciente previamente ooforectomizada (4-13). Estas neoplasias también producen inhibina, un péptido hormonal cuyo nivel depende del volumen del tumor (23,22). La inhibina sérica no tiene utilidad diagnóstica, pero si es utilizada como marcador de recurrencia y respuesta la terapia (23,24).
Macroscópicamente estas lesiones deben estar separadas del ovario y suelen observarse como tumores macizos, multilobulados y bien limitados, de color amarillo, de consistencia elástica y con frecuente infiltración a estructuras adyacentes (1-3,25).
Los tumores derivados cordones sexuales se pueden distribuir en dos grandes categorías: el grupo de los tumores de células de la granulosa y el grupo de los tecomas fibromas, según la presencia o ausencia de un componente significativo de células de la granulosa (1-3,15). Ocasionalmente, las neoplasias de células de la granulosa pueden contener elementos fibrotecomatosos. En la actualidad, para definir un tumor de células de la granulosa, este debe estar compuesto por más de un 10% de células de la granulosa (15). Estos tumores se han clasificado en tipo adulto y tipo juvenil, teniendo en cuenta la edad de presentación, la presencia de cuerpos de Call-Exner y las características nucleares (23,25).
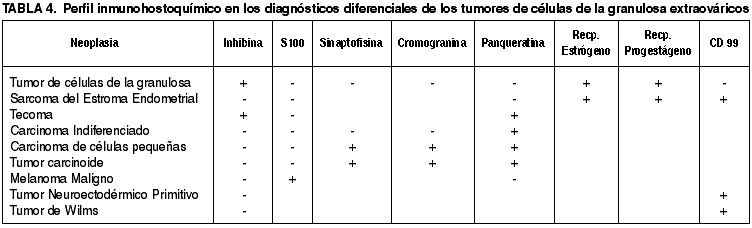
Debido a su localización anómala su diagnóstico es un gran reto, ya que semejan múltiples lesiones como el sarcoma del estroma endometrial, el tecoma, el carcinoma indiferenciado, los carcinomas de células pequeñas, el tumor carcinoide, el melanoma maligno, el tumor de Wilms y el tumor neuroectodermico primitivo periférico (3,25,26). No obstante, la inmunohistouímica brinda una gran ayuda en su identificación (tabla 4). Generalmente, los tumores de células de la granulosa expresan intensamente alfa inhibina (27-29). Otros marcadores también utilizados son calretinina (30), que es altamente sensible pero es poco específica, vimentina que suele ser positiva junto con el antígeno de membrana epitelial, y la citoqueratina 7, que es negativa (30-33). La falta de expresión para CD99 excluye el diagnóstico de tumor neuroectodérmico primitivo y marcadores como WT-1 y desmina lo hacen con el diagnóstico de tumor de Wilms (34,35).
La recurrencia de los tumores de las células de la granulosa es poco frecuente, lo que también se evidencia en su presentación extraovárica, ya que de los 11 casos encontrados sólo 1 recurrió (tabla 3) (10). En general para estas neoplasias, el único factor asociado con una baja sobrevida, es la presencia de tumor residual y un estadio avanzado al momento del diagnóstico (36-38). Recientemente, otros factores como el recuento mitósico elevado también se han asociado con un peor pronóstico (37).
En conclusión, los tumores de células de la granulosa extraováricos son neoplasias extremadamente infrecuentes, que parecen ser derivadas de tejidos gonadales ectópicos o de la diferenciación a estos, por parte de células de células mesenquimales primitivas. Su adecuado estudio por medio de una correcta correlación clínica, morfológica e inmunofenotípica, permite su reconocimiento entre el amplio número de variados diagnósticos diferenciales.
BIBLIOGRAFÍA
Tavassoli FA, Devilee P, eds. Pathology and Genetics of Tumours of the Breast and Female Genital Tract. Lyon: IARC Press, 2003.
Scully RE, Sobin LH. Histological typing of ovarian tumours. 2nd ed. International Histological Classification of Tumours, Berlin: Springer, 1999.
Young RH, Scully RE. Sex cord-stromal, steroid cell, and other ovarian tumors with endocrine, paraendocrine and paraneoplastic manifestations. En: Kurman RJ, editor. Blaustein’s Pathology of the female genital tract, 5.ª edición. New York Springer-Verlag; 2002; 19, p. 905-66.
Costero-Barrios CB, López-Briano MR. Tumor mesenquimatoso extraovárico del cordón sexual. Gac Méd Méx 2003; 139: 611-6.
Voigt WW. Primary giant granulosa cell tumor of retroperitoneal origin with development into the mesosigmoideum. Am J Obstet Gynecol 1938; 36: 688.
Regins AB, Frankel L. Intraligamentous granulosa cell tumor. Am J Obstet Gynecol 1940; 40: 302-6.
Powel C, Black WC. Extraovarian granulosa cell tumor. Am J Obtet Gynecol 1940; 40: 318-23.
Reddy DB, Bassler TJ. The granulosa cell tumor. J Indian Med Assoc 1963; 41: 254-7.
Orselli RC, Bassler TJ. Theca granulosa cell tumor arising in the adrenal gland. Cancer 1973; 31: 474-7.
Keitoku M, Konishi I, Nanbu K, Yamamoto S, Mandai M, Kataoka N, Oishi T, Mori T. Extraovarian sex cord-stromal tumor: case report and review of the literature. Int J Gynecol Pathol 1997; 16: 180-5.
Robinson JB, Im DD, Logan L, McGuire WP, Rosenshein NB. Extraovarian granulosa cell tumor. Gynecol Oncol 1999; 74: 123-7.
Hameed A, Coleman RL. Fine-needle aspiration cytology of primary granulosa cell tumor of the adrenal gland: a case report. Diagn Cytopathol 2000; 22: 107-9.
Kim SH, Park HJ, Linton JA, Shin DH, Yang WI, Chung WY, Kim YT. Extraovarian granulosa cell tumor. Yonsei Med J 2001; 42: 360-3
Busby T, Anderson GW: Feminizing mesenchymomas of the ovary. Am J Obstet Gynecol 1954; 68: 1391-420.
Roth LM. Recent advances in the pathology and classification of ovarian sex cord-stromal tumors. Int J Gynecol Pathol 2006; 25: 199-215.
Mayr D, Kaltz-Wittmer C, Arbogast S, et al. Characteristic pattern of genetic aberrations in ovarian granulosa cell tumors. Mod Pathol 2002; 15: 951-7.
Fuller PJ, Chu S, Fikret S, Burger HG. Molecular pathogenesis of granulosa cell tumours. Mol Cell Endocrinol 2002; 191: 89-96.
Keri RA, Lozada KL, Abdul-Karim FW, Nadeau JH, Nilson JH. Luteinizing hormone induction of ovarian tumors: oligogenic differences between mouse strains dictates tumor disposition. Proc Natl Acad Sci 2000; 97: 383-7.
Kotlar TJ, Young, RH Albanese C, Crowley WF Jr, Scully, R.E, Jameson JL. A mutation in the follicle-stimulating hormone receptor occurs frequently in human ovarian sex cord tumors. J Clin Endocrinol Metab 1997; 82: 1020-6.
Fuller PJ, Chu S. Signalling pathways in the molecular pathogenesis of ovarian granulosa cell tumours. Trends Endocrinol Metab 2004; 15: 122-8.
Ala-Fossi SL, Aine R, Punnonen R, Maenpaa J. Is potential to produce inhibins related to prognosis in ovarian granulosa cell tumors? Eur J Gynaecol Oncol 2000; 21: 187-9.
Fuller PJ, Zumpe ET, Chu S, Mamers M, Burger HG. Inhibin-activin receptor subunit gene expression in ovarian tumours. J Clin Endocrinol Metab 2002; 87: 1395-401.
Zanagnolo V, Pasinetti B, Sartori E. Clinical review of 63 cases of sex cord stromal tumors. Eur J Gynaecol Oncol 2004; 25: 431-8.
Schumer ST, Cannistra SA. Granulosa cell tumor of the ovary. J Clin Oncol 2003; 21: 1180-9.
Scully RE, Young RH, Clement PB. Atlas of Tumor Pathology. Tumors of the Ovary, Maldeveloped Gonads, Fallopian Tube, and Broad Ligament, Third Series. Washington, DC: Armed Forces Institute of Pathology, 1998.
Chou YY, Shun CT, Huang SC, Chuang SM: Primary ovarian carcinoid tumor. J Formos Med Assoc 1996; 95: 148-52.
Riopel MA, Perlman EJ, Seidman JD, Kurman RJ, Sherman ME: Inhibin and epithelial membrane antigen immunohistochemistry assist in the diagnosis of sex cord-stromal tumors and provide clues to the histogenesis of hypercalcemic small cell carcinomas. Int J Gynecol Pathol 1998; 17: 46-56.
Kommoss F, Oliva E, Bhan AK, Young RH, Scully RE: Inhibin expression in ovarian tumors and tumor-like lesions: an immunohistochemical study. Mod Pathol 1998; 11: 656-64.
McCluggage WG. Value of inhibin staining in gynecological pathology. Int J Gynecol Pathol 2001; 20: 79-85.
McCluggage WG, Young RH. Immunohistochemistry as a diagnostic aid in the evaluation of ovarian tumors. Semin Diagn Pathol 2005; 22: 3-32.
Baker PM, Oliva E. Immunohistochemistry as a tool in the differential diagnosis of ovarian tumors: an update. Int J Gynecol Pathol 2005; 24: 39-55.
McCluggage WG. Immunoreactivity of ovarian juvenile granulose cell tumours with epithelial membrane antigen. Histopathology 2005; 46: 235-6
Benjamin E, Law S, Borrow LG. Intermediate filaments cytokeratin and vimentin in ovarian sex cord-stromal tumours with correlative studies in adult and fetal ovaries. J Pathol 1987; 152: 253-63.
Cathro HP, Stoler MH. The ultility of calretinin, inhibin, and WT1 immunohistochemical staining in the differential diagnosis of ovarian tumors. Hum Pathol 2005; 36: 195-201.
Vang R, Herrmann ME, Tavassoli FA. Comparative immunohistochemical analysis of granulosa and Sertoli components in ovarian sex cord-stromal tumors with mixed differentiation: potential implications for derivation of Sertoli differentiation in ovarian tumors. Int J Gynecol Pathol 2004; 23: 151-61.
Auranen A, Sundström J, Ijäs J, Grénman S. Prognostic factors of ovarian granulosa cell tumor: a study of 35 patients and review of the literature. Int J Gynecol Cancer 2007; 17: 1011-8.
Pectasides D, Pectasides E, Psyrri A. Granulosa cell tumor of the ovary. Cancer Treat Rev 2008; 34: 1-12.
Sehouli J, Drescher FS, Mustea A, et al. Granulosa cell tumor of the ovary: 10 years follow-up data of 65 patients. Anticancer Res 2004; 24: 1223-9.