
Vol. 37, n.º 2, 2004
REVISTA
ESPAÑOLA DE
Vol. 37, n.º 2, 2004 |
Juvenal Baena1, Ana Martínez Peñuela1, José Echeveste1, Federico García Bragado2, Iosu Sola1, Gemma Toledo1, Javier Pardo1
1 Clínica Universitaria, Universidad de Navarra, Pamplona, España. 2 Residencia «Virgen del Camino», Osasunbidea, Pamplona, España. jpardo@unav.es
RESUMEN
Se estudiaron los linfomas gástricos para intentar identificar características que ayuden a distinguir entre linfomas MALT, linfomas MALT transformados en difusos de alto grado (LMTAG) y linfomas difusos de células grandes B no asociados a linfomas MALT (LDCGB). Se revisó la morfología de 78 lesiones gástricas linfoproliferativas primarias (29 linfomas MALT, 28 LMTAG y 21 LDCGB) y posteriormente se clasificaron histológica e inmunofenotípicamente. La apoptosis se estudió por el método TUNEL y se evaluó el reordenamiento monoclonal de genes por PCR. Las características morfológicas asociadas estadísticamente al diagnóstico de linfoma MALT fueron: infiltración reactiva del estrato superior de la mucosa por células plasmáticas, infección por Helicobacter pylori, lesiones linfoepiteliales, ausencia de dilatación vascular y bajos índices de mitosis y apoptosis. Grupos de más de 15 inmunoblastos con diferenciación plasmocitoide, dilatación vascular y altos índices mitóticos y apoptósicos se asociaron estadísticamente a linfomas gástricos de alto grado. La infiltración eosinofílica se asoció con más frecuencia a LMTAG. La morfología puede ser de ayuda para el diagnóstico diferencial de estos tres subtipos de linfomas gástricos, especialmente cuando las muestras son pequeñas o no están bien preservadas.
Palabras claves: Linfoma MALT, estómago, linfoma de células grandes B.
SUMMARY
In order to identify the morphological features that can be used to differentiate MALT lymphomas from diffuse high grade transformed MALT lymphomas (HGTML) and from diffuse large B-cell lymphomas (DLBCL) unassociated with MALT lymphoma, we reviewed 78 primary gastric lymphoproliferative lesions (29 MALT-lymphomas, 28 HGTML and 21 pure DLBCL). The lesions were charactericed histologically and immunophenotypically.
Apoptosis was studied by the TUNEL method and assessment of monoclonality gene rearrangement was performed using PCR. The morphologic features statistically associated with the diagnosis of MALT-lymphoma were: reactive plasma cell infiltration of the upper layer of the mucosa, Helicobacter pylori infection, lymphoepithelial lesions, absence of vascular dilatation wand low-mitotic and apoptotic indexes. Clusters of more than 15 immunoblasts with plasmacytoid differentiation, vascular dilatation, and high mitotic and apoptotic indexes were statistically associated with the diagnosis of high grade gastric lymphomas. Eosinophils infiltration was statistically associated more often with the diagnosis of HGTML. Morphology can be helpful in the differential diagnosis of these three subtypes of gastric lymphomas especially when the specimens are small or poorly preserved.
Key words: Mucosa-Associated Lymphoid Tissue, MALT lymphoma, stomach, large B-cell lymphoma.
INTRODUCCIÓN
En 1983, Isaacson and Wright describieron un subtipo de linfoma no Hodgkin gastrointestinal que se parecía a la enfermedad inmunoproliferativa de intestino delgado (también conocida como linfoma mediterráneo) (1). Los autores observaron que estos tumores tenían características histológicas que recordaban a las placas de Peyer del intestino y sugirieron que estas neoplasias se originaban del tejido linfoide asociado a mucosas (MALT, mucosa-associated lymphoid tissue). El linfoma de células B extranodal de la zona marginal tipo MALT es un linfoma de bajo grado y actualmente es reconocido como una entidad clinicopatológica distinta en la clasificación de la Organización Mundial de la salud(2(. Los linfomas MALT transformados en difusos de alto grado (LMTAG) y los linfomas difusos de células grandes B (LDCGB) también se han descrito en el estómago (2-5). Se ha supuesto que los LMTAG se originan de la transformación histológica de los linfomas MALT de bajo grado, ya que estos se componen de células de linfoma MALT más grupos de células linfoides blásticas grandes. Se han presentado algunos casos en los que hay evidencia molecular que demuestra una relación clonal entre los linfomas MALT y los componentes del alto grado (6-8). El origen de los LDCGB en sitios extranodales MALT no está bien establecido y es aún tema de debate (9). En las clasificaciones de la OMS y REAL, estas neoplasias son designadas como linfomas difusos de células grandes B, aunque recomiendan que cuando aparecen características moleculares o patológicas sugestivas de MALT, deberían anotarse (2,10). Varios estudios concluyeron que los LMTAG y los LDCGB originados en el estómago son clínicamente agresivos y tienen peor pronóstico que los linfomas MALT puros (4,11,12). Sin embargo, el diagnóstico diferencial de estos tumores frecuentemente es problemático, especialmente en biopsias gástricas pequeñas en las cuales puede ser difícil evaluar con certeza el tamaño y morfología de las células linfoides tumorales. Con el objetivo de esclarecer los criterios histológicos e inmunohistoquímicos de estas neoplasias, revisamos retrospectivamente 78 casos de linfomas gástricos primarios recogidos de dos hospitales. Identificamos algunas características morfológicas que proporcionan claves adicionales en el diagnóstico diferencial entre linfoma MALT, LMTAG y LDCGB, especialmente cuando las muestras de biopsias gástricas son pequeñas o están mal procesadas.
MATERIAL Y MÉTODO
Selección de casos
Seleccionamos 81 lesiones gástricas linfoproliferativas de los archivos de los departamentos de anatomía patológica del Hospital Virgen del Camino y de la Clínica Universitaria de Navarra diagnosticados entre 1994 y 2001. La localización primaria gástrica fue definida clínicamente sobre el hecho que el proceso maligno estuviera confinado al estómago. Se excluyeron tres casos debido a que el origen primario en estómago no pudo ser confirmado, quedando 78 casos disponibles para el estudio. Sesenta y siete casos fueron obtenidos por gastroscopia y 11 casos fueron obtenidos por gastrectomía. Todas las preparaciones histológicas revisadas por dos patólogos fueron teñidas con hematoxilina-eosina (H&E), ácido periódico de Shift (PAS), reticulina y verde metilo pironina. La presencia de Helicobacter pylori fue evaluada mediante la tinción de Giemsa. Los linfomas de células B fueron diagnosticados y clasificados de acuerdo la clasificación de linfomas de la OMS (2). Para el objetivos de este estudio, cada caso fue incluído en uno de estos tres grupos: linfoma MALT, LMTAG y LDCGB. Los linfomas MALT fueron definidos como una proliferación de células tipo centrocitos con formación de lesiones linfoepiteliales (estructuras epiteliales invadidas y dañadas por agregados de células linfoides neoplásicas pequeñas). LMTAG comprendieron linfomas MALT con áreas de proliferación de células grandes (>15) en forma de grupos o sábana. LDCGB consistieron en una proliferación difusa de células grandes con núcleos grandes y vesiculosos con nucléolos notables. Las series incluyeron 29 casos de linfomas MALT, 28 LMTAG y 21 LDCGB. A modo de controles, también revisamos 22 biopsias gástricas que fueron diagnosticadas previamente de gastritis crónica y úlcera gástrica benigna.
Inmunohistoquímica
Las tinciones inmunohistoquímicas fueros realizadas en cortes de tejidos fijados en formol e incluidos en parafina, utilizando el método del complejo avidina-biotina-peroxidasa y anticuerpos dirigidos contra los siguientes: CD3 (1:200, policlonal, Dako, Carpinteria, Ca), CD20 (1:1000, L26, Dako), CD79a (1:100, JCB117, Dako), LCA (1:800, 2B11&PD7, Biogenex, San Ramon, CA), CD45RO (1:1800, UCHL1, Biogenex), CD43 (1:400, MT1, Biogenex), AE3/AE1 (1:400, Biogenex), ciclina-D1 (1:50, DCS-6, Novocastra, Newcastle, UK), bcl-2 (1/50, cl-2/100/D5, Novocastra), CD10 (1:100, 56C6, Novocastra) y CD5 (1:50, 4C7, Novocastra). En todos los casos se realizó recuperación antigénica con microondas. Se utilizó para la detección el método Estreptavidina-biotina (LSAB; Dako) y diaminobenzidina como cromógeno. Se emplearon cortes de ganglios linfáticos como controles positivos.
Estudios genotípicos moleculares
En 17 casos (11 casos de Linfoma MALT, 3 LMTAG y 3 LDCGB) se realizaron estudios moleculares para evaluar el reordenamiento del gen IgH utilizando PCR. El ADN se extrajo de tejido fijado en formol e incluido en parafina de acuerdo con un procedimiento estandar descrito anteriormente (13). La amplificación de PCR se practicó en un termociclador XX (PE/Applied Biosystems, Foster City, CA) usando un procedimiento seminested como se describió anteriormente (13). En la primera reacción de PCR se utilizó un primer dirigido a la zona FR-III de la región variable (V) y un primer dirigido a la región JH. En el ciclo nested, el mismo primer VH fue utilizado con un primer JH, interno al JH usado en el primer ciclo. El control positivo consistió en ADN extraído de la línea celular Namalwa B diluido a 10-2 y 10-3 en ADN de la línea celular eritroleucemia K562. El control negativo fue agua esteril. Se realizó en todos los casos, la amplificación de una secuencia de 184 pares de bases (bp) del gen beta globina para confirmar la calidad adecuada del ADN. En un gel de poliacrilamida al 8% fueron corridos por electroforesis 15 ul de los productos de PCR.
Método Tunel (Terminal Deoxynucleotidyl Transferase-Mediated dUTP Nick-end Labeling)
La detección in situ de hebras fragmentadas de ADN por la técnica TUNEL fue realizada por un kit de detección de apoptosis in situ, comercialmente disponibl, ApopTag (ONCOR, Gaithersburg, MD). Los cortes fueron incubados con proteinasa K a temperatura ambiente durante 15 minutos y se inactivó la peroxidasa endógena (14). Los cortes tisulares fueron teñidos con el sistema ApopTag, y la reacción fue detenida después de 60 minutos. Posteriormente, los cortes fueron cubiertos con peroxidasa antidigoxigenina, incubados durante 30 minutos a temperatura ambiente y teñidos con DAB para la detección de los núcleos marcados. Para los controles negativos se utilizó agua deionizada en vez de TdT. Las células se consideraron positivas cuando en los núcleos se detectó una intensa tinción marrón.
Análisis estadístico
Los resultados fueron analizados usando SSPS (SPSS Inco, Chicago, IL). Para comparar la media de la edad de los pacientes en las tres categorías de linfomas gástricos, se utilizó el test T de Student. Otras comparaciones, tales como evaluación de la técnica TUNEL, se realizaron mediante el test exacto de Fisher, método de correlación ordinal Tau-b de Kendall, test chi-cuadrado de Pearson y ANOVA de una vía. Las diferencias fueron consideradas significativas si el valor de p era menor de 0.05.
RESULTADOS
Hallazgos clínicos
Las 78 lesiones linfoproliferativas fueron recopiladas de los archivos y se confirmó el origen primario gástrico. En cada caso se estableció la pertenencia a una de las tres categorías, linfoma MALT, LMTAG, LDCGB a través de la reevaluación patológica realizada para este estudio. Veintinueve pacientes (37%) presentaron Linfoma MALT, 28 pacientes (36%) LMTAG y 21 pacientes (27%) LDCGB. El linfoma MALT fue más frecuente en hombres (24 de 29) que en mujeres y el LDCGB fue más corriente en mujeres (13 de 21) que en hombres (tabla 1). La edad de los pacientes (49 hombres y 29 mujeres) osciló entre 29 y 97 años (media de la edad 64,04 sd 13,88). La mediana de la edad de los pacientes con linfoma MALT fue 61 años (rango 47-83 años), 66 años (rango 56-83 años) con LMTAG y 65 años (rango 34-73 años) con LDCGB. El período de seguimiento promedio, medido desde la fecha del diagnóstico, fue de 36 meses con un rango de 3 a 83 meses. No hubo diferencias estadísticamente significativas para sexo, edad y características histológicas.

Hallazgos patológicos
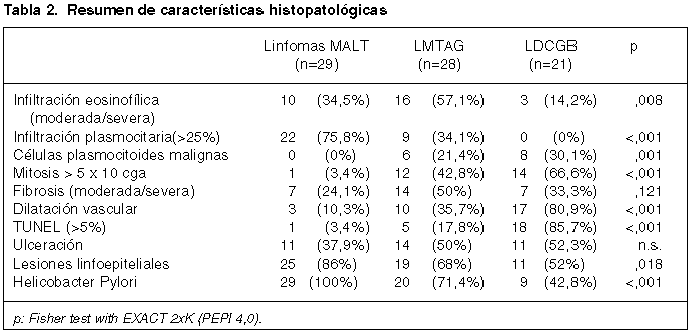
La morfología característica de los linfomas MALT en los cortes teñidos con H&E incluyó (fig. 1): un denso infiltrado de linfocitos pequeños con núcleos irregulares asemejando centrocitos (células tipo centrocitos) en la lámina propia alrededor de fóliculos no neoplásicos, habitualmente sin infiltrado de células neoplásicas en la porción más superficial de la mucosa. Frecuentemente se observó un infiltrado de células neoplásicas linfoides, de pequeño a mediano tamaño, que presentaban un espectro de características citológicas que recordaban linfocitos pequeños, células linfoplasmocitoides y células con citoplasma claro, amplio, con bordes celulares bien definidos semejantes a células B monocitoides. Las lesiones linfoepiteliales estuvieron presentes en el 86% de los casos y habitualmente notables (fig. 2). Los centros germinales reactivos estuvieron presentes en 21 casos (72,4%) y la colonización folicular se observó ocasionalmente (31%). Otras características morfológicas encontradas en los linfomas MALT incluyeron: un bajo índice mitótico (menos de 2 mitosis por 10 cga), escasos eosinófilos, infiltrados focales de plasmocitos en la parte superior de la mucosa (fig. 3), ulceración de la mucosa (en 11 casos) y ausencia de fibrosis en la lámina propia (tabla 2).

Fig. 1: Linfoma MALT de bajo grado.
Proliferación difusa de células linfoides pequeñas.

Fig. 2: Lesiones linfoepiteliales en
linfoma MALT de bajo grado.
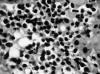
Fig. 3: Mucosa adyacente al linfoma MALT
que presenta un infiltrado focal de plasmocitos.
En el LMTAG, las células tumorales incluyeron una proporción variable (generalmente alrededor del 25% de las células) de inmunoblastos de gran tamaño con núcleo redondo y nucleolo prominente dispuestos en grupos de más de 15 por campo de gran aumento. En estos casos, había un aumento considerable de eosinófilos, escasas células plasmáticas, una fibrosis significativa de la lámina propia, dilatación vascular, ulceración de la mucosa, y un índice mitótico en la mayoría de los casos mayor de 3,5 por 10 campos de gran aumento (fig. 5). Con frecuencia, el infiltrado linfoide y la fibrosis de la lámina propia aparecían en las mismas áreas.
La característica morfológica más distintiva del LDCGB fue la presencia de una proliferación difusa de inmunoblastos con diferenciación plasmocitoide (fig. 4). A diferencia del LMTAG, en el LDCGB puro los eosinófilos eran escasos o incluso estaban ausentes. Otras características morfológicas fueron dilatación vascular (81% de los casos), ulceración de la mucosa, y el índice mitótico mayor de 10 mitosis por 10 campos de gran aumento (figs. 6 y 7). Se encontraron lesiones linfoepiteliales compuestas por células grandes en 11 casos (52%) y Helicobacter pylori en 9 (42,8%), frecuencia mucho menor que otros grupos (tabla 2), siendo las diferencias estadísticamente significativas (P=0,018 para las lesiones linfoepiteliales y P<0,001 para infección por Helicobacter pylori).

Fig. 4: LDCGB con componente de bajo
grado. Se observan células linfoides pequeñas junto con inmunobalstos aislados o
en pequeños grupos.
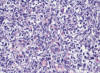
Fig. 5: Eosinófilos, plasmocitos y una
fibrosis marcada de la lámina propia son frecuentes en los LDCGB con componente
de bajo grado.
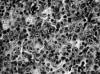
Fig. 6: LDCGB están compuestos por
inmunoblastos grandes con núcleos irregulares y numerosas mitosis.

Fig. 7: La dilatación vascular y fibrosis
están presentes en muchos LDCGB.
Inmunofenotipo, túnel y estudios moleculares
Los resultados de los estudio de inmunofenotipo están resumidos en la tabla 3. En todos los casos examinados, las células neoplásicas expresaron CD45 (ALC) y CD20 (fig. 8). Veintidós (36%) de los 60 casos expresaron bcl-2 en más del 50% de las células (fig. 9). Se observó coexpresión CD20 y CD43 en el 18,75% de los linfomas MALT, 20,8% de LMTAG y en el 25% de los LDCGB puros. El CD5 fue negativo en la mayoría de los casos. El CD10 fue focalmente positivo en un caso de linfoma MALT de bajo grado, en un caso de LMTAG y en dos casos de LDCGB. AE3/AE1 fue negativo en las células neoplásicas linfoides en todos los casos, pero fue de utilidad para poner de relieve las lesiones linfoepiteliales.


Fig. 8: La inmunotinción para CD20 es
positiva en todos los linfomas MALT.

Fig. 9: La expresión de Bcl-2 es más
frecuente e intensa en los LDCGB.
LDCGB mostró mayores índices apoptóticos que los otros dos subtipos. Se encontraron más del 5% de células apoptóticas en el 86% de los LDCGB puros, en el 18% de LMTAG y en el 3% de los linfomas MALT (P<0,001). La media de células apoptóticas detectadas por la técnica de TUNEL en el LDCGB puro, el LMTAG y el linfoma MALT fue de 6,3%, 3,1% y 0,9% respectivamente, siendo estas diferencias estadísticamente significativas (P<0,001) (fig. 10).
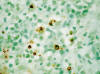
Fig. 10: Células en apoptosis positivas
para la técnica TUNEL son más numerosas en los LDCGB.
Todos los casos examinados mostraron reordenamientos monoclonales del gen IgH, detectados por PCR.
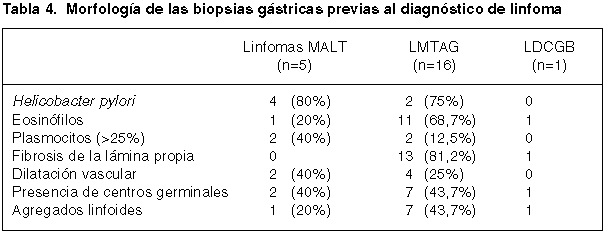
Hallazgos patológicos en las biopsias gástricas previas
A veiticinco de los pacientes se les había realizado una biopsia gástrica de 5 a 41 meses antes del diagnóstico de linfoma gástrico. La revisión histológica de dichas biopsias confirmó la ausencia de linfoma. A pesar de todo, en 14 casos encontramos un infiltrado eosinófilo y en otros 14 fibrosis de la lámina propia. La mayoría de estos casos se correspondían con pacientes que posteriormente fueron diagnosticados de LMTAG (tabla 4).
DISCUSIÓN
La mayoría de los linfomas primarios gástricos son linfomas MALT, LMTAG o LDCGB. La frecuencia relativa de cada uno de estos subtipos es similar. El diagnóstico diferencial entre estos tres subtipos es clínicamente relevante y el diagnóstico correcto es un indicador pronóstico independiente (4,11,15). Muchos son los estudios que han enfatizado la importancia del tamaño de los linfocitos neoplásicos y de las lesiones linfoepiteliales para distinguir los linfomas MALT de los linfomas de alto grado gástricos, pero han rechazado otras características morfológicas (16). Tanto el pequeño tamaño de las biopsias gástricas como las diferencias tan sutiles entre la gastritis crónica, los linfomas MALT, LMTAG y LDCGB, obligan al uso de características morfológicas, inmunohistoquímicas, e incluso moleculares para proporcionar un diagnóstico más preciso (17). Así, además de los criterios morfológicos e inmunohistoquímicos, intentamos buscar características diagnósticas que pudieran ayudar a diferenciar con mayor precisión estos linfomas, especialmente cuando las muestras a estudiar son pequeñas o están mal procesadas. Identificamos diversas características morfológicas que pueden ser de utilidad en el diagnóstico del linfoma MALT gástrico de bajo grado y en distinguirlo de los linfomas de alto grado. Estas características morfológicas fueron: infiltrado reactivo de células plasmáticas en la porción más superficial de la mucosa, ausencia de inmunoblastos con diferenciación linfoplasmocitoide, bajos índices tanto de apoptosis como de mitosis, ausencia de dilatación vascular, presencia de la infección por Helicobacter pylori y lesiones linfoepiteliales. La presencia de células plasmáticas reactivas en la superficie de los linfomas MALT gástricos podría estar en relación con la diferenciación de células plasmáticas descritas en algunas localizaciones (19). Todas estas características fueron reproducibles ya que su frecuencia variaba poco en los linfomas MALT. El desarrollo del linfoma MALT gástrico depende en gran medida de la infección por Helicobacter pylori (20). Como ya es bien sabido, la infección bacteriana estimula las células del linfoma B a través de la estimulación inmunológica tanto directa como indirecta. El descenso del porcentaje de casos con Helicobacter pylori en el LDCGB puede ser debido a un mecanismo diferente de carcinogénesis o a la pérdida de la dependencia de la reacción inmune frente al Helicobacter pylori para el crecimiento tumoral (18).
También se identificaron diversas características morfológicas típicas de los linfomas gástricos de alto grado. Además de los blastos plasmocitoides agrupados o difusos, las biopsias mostraron fibrosis de la lámina propia, dilatación vascular, ausencia de células plasmáticas, y un elevado índice tanto mitótico como apoptótico. La fibrosis y la dilatación capilar es, probablemente, una reacción estromal inducida por las células del LDCGB ya que estos cambios son inusuales en las biopsias gástricas de pacientes con úlceras crónicas o con linfoma MALT. LDCGB mostró el mayor índice apoptótico probablemente debido a los múltiples cambios genéticos asociados a la progresión tumoral (21). Sin embargo, la identificación de células linfoides grandes o pequeñas, es absolutamente necesaria para el diagnóstico de cualquiera de estos linfomas.
Desde el punto de vista inmunofenotípico, ningún anticuerpo puede ayudar en el diagnóstico diferencial entre los linfomas MALT y los tumores de alto grado. La expresión de bcl-2 en algunos casos de LDCGB, podría estar relacionada con el origen folicular de algunos de estos tumores. Bcl-2 mostró tener un efecto adverso en los resultados en varios ensayos clínicos a gran escala en el LDCGB ganglionar (22,23), sin embargo en los linfomas extranodales no se ha probado todavía. Basados en estudios de gran escala, parece ser que el bcl-2 tiene un efecto adverso de cara al desarrollo del LDCGB ganglionar (22,23), sin embargo esto no se ha comprobado en los linfomas extranodales. La negatividad para diversos marcadores puede ayudar en le diagnóstico de estos tumores ya que por ejemplo CD5 y la ciclina D1 son positivos habitualmente en los linfomas del manto (24) y el CD10 en el linfoma folicular clásico. En nuestra serie, sólo dos casos (un linfoma MALT y un LMTAG) fueron positivos para CD 10, y la reacción positiva fue débil y focal en los dos casos en los que el bcl-6 fue negativo. En estos dos casos, no podemos excluir la posibilidad, como ya ha sido sugerido por otros (25), de un linfoma compuesto, un linfoma MALT y un linfoma folicular. Dos casos de LDCGB mostraron expresión difusa de CD10 que puede estar reflejando su origen folicular. Takeshita y colaboradores (26) encontraron que el LDCGB CD-10 positivo gástrico, tiene similares hallazgos inmunofenotípicos que los del linfoma folicular ganglionar. Un hecho destacable es la presencia de numerosos eosinófilos fue estadísticamente asociado con el diagnóstico de LMTAG. El infiltrado eosinófilo puede ser una respuesta inflamatoria mediada por citokinas como la interleukina-4 (IL-4) y la IL-10 y/o inductores de la apoptosis como la perforina y las granzymas (21,25,27-29).
Los linfomas MALT gástricos se dan predominantemente en personas mayores de 50 años con una relación hombre- mujer de 1.5:1. La media de edad de los pacientes con LDCGB es alrededor de 10 años más que los pacientes con linfomas MALT (30,31). En nuestros casos, encontramos que la media de edad de los pacientes con LDCGB fue de 65 años, pero encontramos, como otros autores (32) que la incidencia de LDCGB mostraban dos picos de edad: uno en pacientes menores de 51 años y otro en pacientes mayores de 68 años. Esto también sugiere que la patogenia de la enfermedad puede ser diferente en estos dos grupos. Acorde con esto, diversos estudios recientes han demostrado que los linfomas MALT se desarrollan a través de dos vías patogénicas diferentes: aquellos con t (11;18), y aquellos sin t (11;18) pero con aneuploidia (33,34). En todos los casos, algunas de las alteraciones que se observan habitualmente en los linfomas MALT pueden estar presentes en las biopsias antes de la transformación maligna de las células linfoides, como el infiltrado eosinófilo, la dilatación vascular, la aparición de agregados linfoides o la fibrosis de la lámina propia. Esto sugiere que estas alteraciones morfológicas son inespecíficas, aunque todas juntas pueden ayudar al diagnóstico precoz delo linfomas MALT. En conclusión, aunque el diagnóstico de los linfomas MALT esta basado en la distribución, morfología, y características inmunohistoquímicas de las células linfoides malignas, otras alteraciones morfológicas secundarias que incluyen el infiltrado inflamatorio eosinófilo y de células plasmáticas, la fibrosis de la lámina propia, la dilatación vascular y los índices mitóticos y apoptóticos, pueden también ayudar en el diagnóstico diferencial entre el linfoma MALT gástrico y los linfomas de alto grado, especialmente en los casos en los que las biopsias son demasiado pequeñas o están mal procesadas.
REFERENCIAS
Isaacson P, Wright DH. Malignant lymphoma of mucosa-associated lymphoid tissue. A distinctive type of B-cell lymphoma. Cancer 1983; 52: 1410-16.
Harris NL, Jaffe ES, Diebold J, et al. The World Health Organization classification of neoplasms of the hematopoietic and lymphoid tissues: report of the Clinical Advisory Committee meeting—Airlie House, Virginia, November, 1997. Hematol J 2000; 1: 53-66.
Hsi ED, Eisbruch A, Greenson JK, Singleton TP, Ross CW, Schnitzer B. Classification of Primary Gastric Lymphomas According to Histologic Features. Am. J. Surg. Pathol 1998; 22: 17-27.
Ferreri AJ, Freschi M, Dell’Oro S, Viale E, Villa E, Ponzoni M. Prognostic Significance of the Histopathologic Recognition of Low- and High-Grade Components in Stage I-II B-Cell Gastric Lymphomas. Am. J. Surg. Pathol 2001; 25: 95-102.
Krugmann J, Dirnhofer S, Gschwendtner A, et al. Primary gastrointestinal B-cell lymphoma. A clincopathological and immunohistochemical study of 61 cases with an evaluation of prognostic parameters. Pathol. Res. Pract 2001; 197: 385-93.
Chan JK, Ng CS, Isaacson PG. Relationship between high-grade lymphoma and low-grade B-cell mucosa-associated lymphoid tissue lymphoma (MALToma) of the stomach. Am. J. Pathol 1990; 136: 1153-64.
Peng H, Du M, Diss TC, Isaacson P, Pan L. Genetic evidence for a clonal link between low and high grade components in gastric MALT B-cell lymphoma. Histopathology 1997; 30: 425-9.
Montalban C, Manzanal A, Castrillo JM, Escribano L, Bellas C. Low grade gastric B-cell MALT lymphoma progressing into high grade lymphoma. Clonal identity of the two stages of the tumour, unusual bone involvement and leukaemic dissemination. Histopathology 1995; 27: 89-91.
Vega F, Medeiros LJ. Marginal-zone B-cell lymphoma of extranodal mucosa-associated lymphoid tissue type: molecular genetics provides new insights into pathogenesis. Adv Anat Pathol 2001; 8: 313-26.
Harris NL, Jaffe ES, Stein H, et al. A revised European–American classification of lymphoid neoplasms: a proposal from the International Lymphoma Study Group. Blood 1994; 84: 1361-92.
Cogliatti SB, Schmid U, Schumacher U, et al. Primary B-cell gastric lymphoma: a clinicopathological study of 145 patients. Gastroenterology 1991; 101: 1159-70.
Filippa DA, Lieberman PH, Weingrad DN, Decosse JJ, Bretsky SS. Primary lymphomas of the gastrointestinal tract. Analysis of prognostic factors with emphasis on histological type. Am J Surg Pathol 1983; 7: 363-72.
Lozano MD, Tierens A, Greiner TC, Wickert RS, Weisenburger DD, Chan WC. Clonality analysis of B-lymphoid proliferations using the polymerase chain reaction. Cancer 1996; 77: 1349-55.
Vega F, Panizo A, Pardo-Mindán J, Diez J. Susceptibility to apoptosis measured by MYC, BCL-2, and BAX expression in arterioles and capillaries of adult spontaneously hypertensive rats. Am J Hypertens 1999; 12: 815-20.
Pozzi B, Hotz AM, Feltri M, Cornaggia M, et al. Primary gastric lymphomas. Clinico-pathological study and evaluation of prognostic factors in 65 cases treated surgically. Patologica 2000; 92: 503-15.
Hoshida Y, Kusakabe H, Furukawa H, et al. Reassessment of gastric lymphoma in light of the concept of mucosa-associated lymphoid tissue lymphoma: analysis of 53 patients. Cancer 1997; 80: 1151-9.
Krugmann J, Dirnhofer S, Gschwendtner A, Berresheim U, Greil R, Krugmann K. Primary gastrointestinal B-cell lymphoma. A clincopathological and immunohistochemical study of 61 cases with an evaluation of prognostic parameters. Pathol Res Pract 2001; 197: 385-93.
Du MQ Molecular Biology of Gastric MALT Lymphoma: Application in Clinical Management. Hematology 2002; 7: 339-44.
Tanimoto A, Hamada T, Yamamoto T, Kimura S, Matsuki Y, Sasaguri Y MALT lymphoma with extreme plasma cell differentiation of the rectum. Am J Gastroenterol 2002; 97: 1860-2.
Go MF, Smoot DT. Helicobacter pylori, gastric MALT lymphoma, and adenocarcinoma of the stomach. Semin Gastrointest Dis. 2000;11: 134-41.
Guidoboni M, Doglioni C, Laurino L, Boiocchi M, Dolcetti R. Activation of infiltrating cytotoxic T lymphocytes and lymphoma cell apoptotic rates in gastric MALT lymphoma. Am J Pathol 1999; 155: 823-9.
Barrans SL, Carter I, Owen RG, et al. Germinal center phenotype and bcl-2 expression combined with the International Prognostic Index improves patient risk stratification in diffuse large B-cell lymphoma. Blood 2002; 99: 1136-43.
Gascoyne RD, Adomat SA, Krajewski S, et al. Prognostic significance of Bcl-2 protein expression and Bcl-2 gene rearrangement in diffuse aggressive non-Hodgkin’s lymphoma. Blood 1997; 90: 244-51.
Swerdlow SH, Williams ME. From centrocytic to mantle cell lymphoma: a clinicopathologic and molecular review of 3 decades. Hum Pathol 2002 Jan; 33: 7-20.
LeBrun DP, Kamel OW, Cleary ML, Dorfman RF, Warnke RA. Follicular lymphomas of the gastrointestinal tract. Pathologic features in 31 cases and bcl-2 oncogenic protein expression. Am J Pathol 1992; 140: 1327-35.
Takeshita M, Iwashita A, Kurihara K, et al. Histologic and immunohistologic findings and prognosis of 40 cases of gastric large B-cell lymphoma. Am J Surg Pathol 2000; 24: 1641-9.
Greiner A, Knorr C, Quin Y, et al. Low-grade B cell lymphomas of mucosa-associated lymphoid tissue (MALT-type) require CD40-mediated signaling and th-2 type cytokines for in vitro growth and differentiation. Am. J. Pathol 1997; 150: 1583-93.
Lui CC, Walsh CM, Yong JD. Perforin: structure and function. Immunol Today 1995; 16: 194-201.
Smyth MJ, Trapani JA. Granzymes: exogenous proteinases that induce target cell apoptosis. Immunol Today 1995; 16: 202-6.
Isaacson PG. Gastrointestinal lymphomas and lymphoid hyperplasias. In Knowles DM Ed. Neoplastic Hematopathology. 2nd Edition. Philadelphia: Lippincott Williams & Wilkins; 2001; 1235-61.
Hoeve MA, Gisbertz IA, Schouten HC, et al. Gastric low-grade MALT lymphoma, high-grade MALT lymphoma and diffuse large B cell lymphoma show different frequencies of trisomy. Leukemia 1999; 13: 799-807.
Yoshino T, Omonishi K, Kobayashi K, et al Clinicopathological features of gastric mucosa associated lymphoid tissue (MALT) lymphomas: high grade transformation and comparison with diffuse large B cell lymphomas without MALT lymphoma features. J. Clin. Pathol 2000; 53: 187-90.
Remstein ED, Kurtin PJ, James CD, Wang XY, Meyer RG, Dewald GW. Mucosa-Associated Lymphoid Tissue Lymphomas with t(11;18) (q21;q21) and Mucosa-Associated Lymphoid Tissue Lymphomas with Aneuploidy Develop Along Different Pathogenetic Pathways. Am J Pathol 2002; 161: 63-71.
Starostik P, Patzner J, Greiner A, et al. Related Articles Gastric marginal zone B-cell lymphomas of MALT type develop along 2 distinct pathogenetic pathways. Blood 2002; 99: 3-9.