
Vol. 37, n.º 3, 2004
REVISTA
ESPAÑOLA DE
Vol. 37, n.º 3, 2004 |
Alejandro Pascual1, Amparo Argüello2, Nieves Climent2, Paloma Lobo2, Armando Guerrero2
1
Servicio de Anatomía Patológica. 2 Servicio de Obstetricia y Ginecología. Hospital General Universitario de Albacete.
RESUMEN
Antecedentes: Los tumores carcinoides de ovario con componente carcinomatoso son una patología infrecuente.
Caso clínico: Presentamos un caso de tumor carcinoide mucinoso con componente carcinomatoso asociado a un teratoma quístico maduro de ovario en una mujer de 39 años a la que se realizó una salpingo-ooforectomía izquierda. No se encontró otra patología en órganos abdominales. En una segunda operación se realizó una histerectomía con salpingo-ooforectomía derecha, apendicectomía, omentectomía y linfadenectomía iliaca bilateral. La paciente no mostró tumor residual.
Conclusión: La revisión de la literatura indica que estos tumores en el estadio I-a tienen un pronóstico excelente. Un estudio adecuado para realizar la estadificación del tumor es importante ya que los estadios II y III tienen muy mal pronóstico.
Palabras clave: Carcinoide mucinoso, carcinoide de células caliciformes, neoplasia ovárica, carcinoide mucinoso con carcinoma, factores pronósticos.
SUMMARY
Background: An ovarian mucinous carcinoid tumor with carcinomatous component is a very rare event.
Case: We report a case of a mucinous carcinoid tumor with carcinomatous component associated to a mature cystic ovarian teratoma in a 39 year-old woman who underwent left salpingo-oopherectomy. No other pathology was found in the abdominal organs. In a second operation, a hysterectomy with right salpingo-oopherectomy, appendicectomy, omentectomy and bilateral iliac lymphadenectomy, were performed. The patient did not show any residual tumor.
Conclusion: Review of the literature indicates that these tumors have an excellent prognosis in an I-a stage. An adequate study for the tumor staging must be carried out since stages II and III have very poor prognosis.
Key words: Mucinous carcinoid, goblet cell carcinoid, ovarian neoplasm, mucinous carcinoid with carcinoma, prognostic factors.
INTRODUCCIÓN
El teratoma quístico maduro del ovario es la neoplasia más frecuente en la edad reproductiva de la mujer (1,2). Estas tumoraciones con áreas de transformación maligna son poco comunes. La forma más frecuente de malignización del teratoma quístico maduro es la de carcinoma epidermoide (3). Su asociación con tumor carcinoide es poco frecuente (4,5) y es aún más raro que se asocie a un tumor carcinoide mucinoso o de células «goblet» (6). En este artículo describimos un teratoma quístico maduro asociado a un tumor carcinoide mucinoso con un componente carcinomatoso.
PRESENTACIÓN DEL CASO
Una paciente de 39 años asintomática acude a consulta externa ginecológica de nuestro hospital en febrero de 2002 por el hallazgo casual en una radiografía de abdomen de una masa pélvica sospechosa de teratoma. Menarquia a los 11 años y tuvo dos embarazos con partos normales. A la exploración se palpaba una masa en anejo izquierdo. La tumoración fue confirmada con la ecografía (fig. 1).
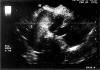
Fig. 1. Ecografía: Se observa la presencia de una zona hiperecoica
(relacionada con la parte sólida del tumor), junto a otras hipoecoicas de
aspecto quístico.
Útero de tamaño normal, homogéneo y regular. Ovario derecho normal. Ovario izquierdo: Formación adherida a útero de 10 x 6,6 cm irregular con estructuras heterogéneas e hiperecogénicas predominando áreas sólidas y zonas anecoicas, sin aumento significativo de la vascularización.
Se realizó una laparotomía el 22 de marzo del 2002 encontrándose una tumoración en el ovario izquierdo con adherencias a cara lateral del útero. No existía ascitis ni hallazgos patológicos en otros órganos abdominales, incluyendo útero, trompas y ovario derecho. Se realizó una salpingo-ooforectomía izquierda.
Hallazgos patológicos
Macroscópico (fig. 2): Se recibió una pieza de anexectomía izquierda. El ovario estaba sustituido por una tumoración de 10 x 7 x 4,5 cm con una superficie externa lobulada. Al corte se identificó una zona quística multiloculada con un contenido amarillento pastoso entremezclado con pelos. En la pared del quiste existía una zona de consistencia ósea en la que se observó una pieza dentaria. Se apreció, también, una zona sólida adyacente al quiste de consistencia fibro-elástica y coloración blanquecina-grisácea de 5 x 2,5 cm. La trompa de Falopio midió 4 cm de longitud y no mostró alteraciones.
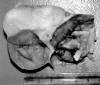
Fig. 2. Se identifica junto al teratoma quístico maduro una zona sólida
de 5 x 2,5 cm.
Microscópico: La zona quística estaba revestida por un epitelio plano poliestratificado queratinizado con presencia en la pared del quiste de abundantes folículos pilosebáceos, grasa, músculo liso y cartílago.
La zona sólida de la tumoración estaba formada por numerosas glándulas de pequeño tamaño revestidas por células tipo «goblet» y algunas células cilíndricas. Las glándulas estaban rodeadas por moco y este material aparecía también de forma aislada en pequeños lagos. El estroma que rodeaba estas zonas era denso y con moderada celularidad (fig. 3).

Fig. 3. Grupo celulares en los que se observan células "goblet" rodeados
por material mucoide separados por un estroma fibroso. H-E. 200x.
En otras zonas (con 10 mm de diámetro) se observó un patrón de crecimiento infiltrante con formación de cordones celulares y presencia de abundantes células en anillo de sello (fig. 4). Las células mostraron núcleos atípicos con frecuentes mitosis, 17 mitosis por 10 campos de gran aumento (fig. 5). La neoplasia estaba limitada al ovario sin infiltrar la cápsula. Con tinciones de inmunohistoquímica existía positividad para citoqueratinas en todas las células. Las tinciones de cromogranina (fig. 6) y sinaptofisina fueron positivas en escasas células basales de las estructuras glandulares, mientras que las tinciones para enolasa y serotonina fueron negativas. Las células del componente carcinomatoso mostraron negatividad para cromogranina, sinaptofisina, enolasa y serotonina. Observándose en esta zona un alto índice de proliferación con Ki-67.

Fig. 4. Zonas de carcinoma del tumor carcinoide mucinoso. Patrón de
crecimiento infiltrante en nidos y cordones celulares con presencia de células
en anillo de sello. H-E 100x.
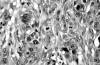
Fig. 5. Las células tumorales muestran marcadas atipias nucleares,
nucleolos prominentes y numerosas mitosis. H-E 400x.
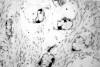
Fig. 6. Tinción inmunohistoquímica para cromogranina muestra positividad
focal. 200x.
Diagnóstico: Teratoma quístico maduro con transformación maligna. Carcinoide mucinoso con componente carcinomatoso.
Se procedió a un segundo tiempo quirúrgico en el que se realizó histerectomía con anexectomía derecha, linfadenectomía iliaca bilateral, apendicectomía y omentectomía. El estudio anatomopatológico de estas muestras no evidenció tumor carcinoide en apéndice, ni presencia de tumor en ovario contralateral ni ganglios linfáticos. Estadio I-a (F.I.G.O).
DISCUSIÓN
Los tumores de células germinales representan entre 15-30% de los tumores de ovario. El 95% de ellos son teratomas (1,7). Un tumor maligno secundario se encuentra asociado a un 1-2% de los teratomas quísticos maduros, siendo aproximadamente en un 80% de los casos carcinomas epidermoides (3,8). Los tumores carcinoides son tumores primarios raros dentro del ovario (4,5). Son más frecuentes cuando son de tipo metastásico con un origen apendicular, siendo en estos casos bilaterales (9,10). Los carcinoides de ovario son morfológicamente idénticos a los de tracto gastrointestinal o respiratorio; pueden ser insulares, trabeculares, mucinosos y mixtos. La variante mucinosa, en el ovario es extremadamente rara y en la literatura existen 19 casos recogidos (6,10-13). Tan solo ha sido descrito un caso de tumor carcinoide con componente carcinomatoso asociado a teratoma quístico maduro (6).
Aunque se ha descrito un caso donde se evidenció metástasis en el ovario contralateral, los tumores carcinoides mucinosos suelen ser unilaterales (6). No se asocian a síndrome carcinoide. Este hecho puede estar relacionado con la escasa cantidad de células que muestran positividad inmunohistoquímica para cromogranina y sinaptofisina. El síndrome carcinoide se asocia con mayor frecuencia al tumor carcinoide de tipo insular (14).
El tumor carcinoide mucinoso puede encontrarse como un tumor sólido o bien asociado a teratoma quístico maduro, tumores mucinosos, tumor de Brenner o quiste epidermoide (6).
Tres tipos de tumores carcinoides han sido referidos: bien diferenciado, atípico y con componente carcinomatoso. Las dos primeras formas siempre se asociaron a un estadio I-a, mientras que el tipo con componente carcinomatoso presentó en un caso un estadio II y en otro caso un estadio III. Estos dos casos tuvieron un pronóstico malo, produciéndose la muerte de las pacientes antes de un año. Sin embargo, los tumores con componente carcinomatoso en estadio I-a tienen un pronóstico excelente (6) al igual que los otros tipos de tumores carcinoides de ovario (4,5).
La necesidad de realizar una correcta estadificación de estos tumores es clara, ya que el pronóstico es muy distinto entre el estadio I y los estadios II y III. La utilización de la tomografía con emisión de positrones (P.E.T.) en pacientes con este tipo de tumor puede ser de gran utilidad para valorar la presencia de metástasis. El componente carcinomatoso del tumor carcinoide mucinoso, como hemos visto, tiene un alto índice mitótico y por lo tanto debe tener un aumento del metabolismo celular. Este hecho puede ayudar ha demostrar la presencia de metástasis usando P.E.T. (15).
En pacientes jóvenes con deseo genésico y un tumor en estadio I-a, el tratamiento conservador con anexectomía unilateral y seguimiento estrecho es apropiado (4,6).
En nuestro caso la paciente tenía dos hijos. La realización del segundo tiempo quirúrgico confirmó que el tumor no presentaba extensión a otros órganos.
BIBLIOGRAFÍA
Katsube Y, Berg JW, Silvergerg SG. Epidemiologic pathology of ovarian tumors: a histopathologic review of primary ovarian neoplasms diagnosed in the Denver standard metropolitan statistical area. 1 July- 31 December 1969 and 1 July-31 december 1979. Int J Gynecol Pathol 1982; 1: 3-16.
Koonings PP, Campbell K, Mishell DR Jr, Corines DA. Relative frecuency of primary ovarian neoplasms, a 10 years review. Obstet Gynecol 1989; 74: 921-26.
Stamp GWH, McConnell EM. Malignancy arising in cystic ovarian teratoma. A report of 24 cases. Br J Obstet Gynaecol 1983; 90: 671-75.
Davis KP, Hartmann LK, Keeney GL, Shapiro H. Primary ovarian carcinoid tumor. Gynecol Oncol 1996; 61: 259-65.
Soga J, Osaka M, Yakuwa Y. Carcinoids of the ovary: an analysis of 329 reported cases. J Exp Clin Cancer Res 2000; 19: 271-80.
Baker PM, Oliva E, Young RH, Talerman A, Scully RE. Ovarian mucinous carcinoids including some with a carcinomatous component. Am J Surg Pathol 2001; 25: 557-68.
Young RH et al. The ovary. En: Stenberg S. et al (eds). Diagnostic Surgical Pathology. New York: Raven Press; 1994. p. 2195.
Peterson WF. Malignant degeneration of bening cystic teratomas of the ovary. Collective review of literature. Obstet Gynecol Surg 1957; 12: 793-830.
Robboy SJ, Scully RE, Norris HJ. Carcinoid metastatic to the ovary a clinicopathologic analysis of 35 cases. Cancer 1974; 33: 798-811.
Talerman A. Carcinoid tumor of the ovary. J Cancer Res Clin Oncol 1984; 107: 125-35.
Alenghat E, Okagati T, Talerman A. Primary mucinous carcinoid tumor of ovary. Cancer 1986; 58: 777-82.
Ammaturo C, Gerardi G, Giardiello C, et al. Il carcinoide mucinoso primitivo dell´ovario. Minerva Chir 1990; 45: 535-37.
Matias-Guiu X, Forteza J, Prat J. Mixed stromal and mucinous carcinoid tumor of the ovary. Int J Gynecol Pathol 1995; 14: 179-83.
Wolpart HR, Fuller AF, Bell DA. Primary mucinous carcinoid tumor of the ovary. A case report. Int J Gynecol Pathol 1989; 8: 156-62.
Scott A. Current status of positron emission tomography in oncology. Australian Radiol 2002; 46: 154-62.