
Vol. 42, n.º 2, 2009
REVISTA
ESPAÑOLA DE
Vol. 42, n.º 2, 2009 |
REVISIONES
José I. López1, Aitor Fernández de Larrinoa2, Rosa Zabala3, José Luis del Cura3
1 Departamento de
Anatomía Patológica. Hospital de Cruces. Universidad del País Vasco (EHU/UPV).
48903 Barakaldo, Bizkaia.
2 Servicio de Anatomía Patológica. Hospital de Basurto. Universidad
del País Vasco (EHU/UPV). 48013 Bilbao, Bizkaia.
3 Servicio de Radiodiagnóstico. Hospital de Basurto. Universidad del
País Vasco (EHU/UPV). 48013 Bilbao, Bizkaia.
joseignacio.lopez@ehu.es
RESUMEN
La biopsia de tiroides obtenida con aguja guiada por control ecográfico es una alternativa a la punción aspiración con aguja fina que, según múltiples autores, ofrece mayor sensibilidad y especificidad diagnóstica que ésta. Este trabajo revisa de una manera crítica la metodología de obtención de la muestra, su manipulación óptima en el Laboratorio de Anatomía Patológica, lo que se puede diagnosticar, cómo hacerlo, y lo que no, y por qué no. El rendimiento óptimo de este procedimiento se obtiene en el contexto de un comité multidisciplinario en el que los diversos especialistas implicados discuten los casos complejos.
Palabras clave: Nódulo tiroideo, ultrasonografía, punción-biopsia, diagnóstico histológico, comité hospitalario.
SUMMARY
Thyroid biopsy obtained with a sonographically guided needle is a more specific and sensitive alternative to fine needle aspiration cytology, according to several authors. This article presents a critical review of the methodology for obtaining the sample, its optimal management in the pathology laboratory and how and what can be diagnosed as well as the reasons for what can not be not be diagnosed. The best results of this technique are obtained when the specialists involved cooperate on a multidisciplinary committee to discuss complex cases.
Keywords: Thyroid nodule, sonography, core-biopsy, histological diagnosis, hospital committee.
INTRODUCCIÓN
Las exploraciones radiológicas en el cuello (Ecografía, TC, RM), en muchos casos realizadas por motivos no relacionados con la glándula tiroides, provocan el descubrimiento de muchos nódulos tiroideos, tanto palpables como no palpables, algunos de los cuales nunca darán síntomas clínicos. Habitualmente se biopsian los nódulos de más de 1 cm, realizándose control ecográfico estricto del resto. La proporción de cáncer en estos nódulos oscila entre el 3 y el 6%, siendo similar esta proporción en nódulos palpables y no palpables. Recientemente Liebeskind y cols (1) han demostrado en una serie de 225 pacientes una mayor proporción de carcinomas entre los nódulos hallados de forma incidental, llegando ésta hasta el 17%.
La ecografía es la técnica radiológica más preconizada en la aproximación a los nódulos tiroideos debido a que es barata, no invasiva, fácil de realizar y muy sensible, y forma parte de la mayoría de los protocolos clínicos. Supera con creces a la palpación física, ya que detecta 5 veces más nódulos que ésta (2,3). Sin embargo, no está exenta de limitaciones puesto que su fiabilidad para predecir malignidad es baja. En este contexto, la combinación del estudio ecográfico con la punción del nódulo y la valoración cito-histológica del mismo parece ser lo más rentable desde el punto de vista diagnóstico.
El control ecográfico de la punción no sólo reduce la posibilidad de error en el muestreo, sino que permite valorar adecuadamente uno o varios nódulos en el caso de bocios multinodulares, aumenta la sensibilidad y especificidad de la técnica (4), y permite muestrear las áreas sólidas de lesiones quísticas. Parece, por lo tanto, razonable utilizar la guía ecográfica de forma sistemática en el estudio de cualquier nódulo tiroideo.
A pesar de su utilización casi universal y de la experiencia acumulada, hasta un 20% de las punciones aspiraciones con aguja fina (PAAF) obtienen muestras insuficientes, o no diagnósticas, dependiendo de las series estudiadas. Esta cifra puede ser incluso superior en aquellas lesiones que tengan un gran componente quístico. La repunción reduce estas cifras aproximadamente a la mitad, por lo cual es una práctica recomendada por algunos autores (5,6).
La obtención de una biopsia cilindro en la punción ecoguiada en lugar de especimenes puramente citológicos es una práctica que, aunque minoritaria comparativamente, viene realizándose desde hace más de una década con resultados superiores a los de la PAAF (7-11). Renshaw y Pinnar (10), por ejemplo, en un trabajo reciente en el que estudian 377 pacientes a los que se les realizó PAAF y biopsia cilindro, muestran diferencias estadísticamente significativas en el porcentaje de diagnósticos adecuados a favor de la punción biopsia (82,2% en biopsias frente al 70,3% en PAAF), aunque reconocen que la conjunción de ambos métodos ofrece los mejores resultados (88,9%).
La puesta en marcha de este procedimiento diagnóstico obtiene los mejores resultados si los hallazgos se contextualizan en la clínica. En este sentido, la existencia de un comité específico de tumores tiroideos es siempre de gran ayuda y en él se debe analizar el riesgo/beneficio de la técnica en cada candidato. En él, cirujanos, endocrinólogos, radiólogos y patólogos ponen en común sus respectivos puntos de vista en los casos complejos y se valoran mejor las limitaciones intrínsecas del procedimiento. Así, se debe asumir de manera colegiada que el muestreo está sujeto a las limitaciones propias del procedimiento, que puede tratarse de fragmentos pequeños de una lesión grande y probablemente heterogénea, que la lesión puede ser pequeña y difícilmente abordable, y que existe una posibilidad cierta de resultados escasos y/o frustrantes. Por último, el patólogo debe admitir que la información que proporciona en este tipo de material es un eslabón más de la cadena diagnóstica.
OBTENCIÓN DE LA MUESTRA
El muestreo de las lesiones se debe realizar con control ecográfico. La punción guiada solo mediante palpación tiene claras limitaciones sobre la guiada por imagen: es menos precisa en el acceso a la lesión, no discrimina entre las áreas líquidas de la lesión y las sólidas (que son las que deben ser muestreadas), no diferencia las lesiones tiroideas de las situadas en vecindad, y no diferencia las lesiones difusas, como las tiroiditis, que no precisan punción, de las lesiones focales. Como consecuencia, la punción guiada por ecografía es más fiable y presenta menos falsos negativos que la realizada mediante palpación (12).
Antes de realizar el procedimiento es preciso realizar una ecografía de control y seleccionar el trayecto de entrada más adecuado (fig. 1). El procedimiento guíado por ecografía se puede realizar utilizando dos técnicas para guiar la aguja: mediante sistemas de guiado adaptados a la sonda o usando la técnica de manos libres. Los primeros, son dispositivos que se acoplan al transductor y a través de los cuales se introduce la aguja, la cual sigue una dirección prefijada marcada en el plano de corte. Existen también sondas diseñadas especialmente con orificios para introducir las agujas a su través.
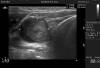
Fig. 1:
Imagen ecográfica de un carcinoma papilar de tiroides en el estudio previo a la
punción.
En cuanto a la técnica de manos libres, consiste en la introducción de la aguja desde uno de los laterales de la sonda, siguiendo el plano de corte del ecógrafo mientras se controla con la sonda que se sostiene libremente, con la otra mano, procurando mantener el trayecto de la aguja lo más paralelo posible a la superficie del transductor. Esta última técnica permite una mayor libertad al elegir el trayecto de entrada y al ajustar el trayecto durante el procedimiento y es la utilizada por los autores (fig. 2).
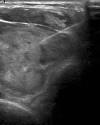
Fig. 2:
Imagen ecográfica de una hiperplasia multinodular mostrando la aguja dentro del
nódulo predominante.
Para obtener las muestras de tejido las agujas de biopsia más útiles son las automáticas de corte frontal (fig. 3). En ellas, la aguja hueca es la que realiza la biopsia. Cuando se dispara, la cánula externa hueca avanza dejando el fiador central atrás y cortando un fragmento de tejido que queda en su interior. Las que usan los autores tienen diferentes longitudes de avance que permiten adaptarse a los diferentes diámetros de las lesiones.
![]()
Fig. 3:
Pistola y aguja 18G de corte frontal idónea para realizar la técnica.
Para realizar la toma de material guiamos la aguja hasta colocar la punta adyacente al nódulo que se va a biopsiar y, posteriormente accionamos el disparador, con lo que la aguja avanzará la distancia prefijada obteniendo un cilindro de tejido. Preferentemente dirigimos la aguja para tomar la muestra de las áreas más periféricas de la lesión, si esto es posible.
Para seleccionar las lesiones que se van biopsiar, los autores utilizan los criterios del consenso de Washington (13), aunque ligeramente modificados. Se biopsian todas las lesiones mayores de 1 cm que presenten calcificaciones, todas las lesiones sólidas de más de 1 cm, las lesiones con componentes quísticos y sólidos que tengan más de 1,5 cm, incluyendo aquí las lesiones quísticas con nódulos murales, y las lesiones que han crecido significativamente desde el último control, exceptuando las puramente quísticas.
Para biopsiar las lesiones que tienen un importante componente quístico, primero se vacía el líquido existente (que es procesado mediante estudio citológico) y posteriomente se biopsia el nódulo que queda después. Por otra parte, si se detectan adenopatías sospechosas (grandes o con microcalcificaciones), también se biopsian.
PROCESAMIENTO DEL MATERIAL
Los cilindros de tejido deben procesarse de manera que pueda optimizarse al máximo el rendimiento. Normalmente son pocos cilindros, 2 ó 3 como mucho, que contienen tejido normal y patológico. Al tratarse de un órgano como el tiroides con muy escaso armazón interno, el material es muy frágil y tiende a colapsarse debido a que los folículos se rompen con facilidad. La manipulación del material, por lo tanto, deberá ser exquisita, poniendo especial cuidado en no fragmentar la muestra al rescatarla del líquido de transporte en el Laboratorio de Anatomía Patológica.
Si el líquido de transporte es suero fisiológico, se podrá realizar el centrifugado del mismo a bajas revoluciones, con la consecuente obtención de muestra citológica que en ocasiones resulta muy útil para valorar los núcleos. En este caso la refrigeración del suero en nevera evitará la autolisis del tejido y ayudará a preservar el material en condiciones óptimas para el diagnóstico. Este procedimiento ya ha sido utilizado por los autores en muestras similares de otras localizaciones (14-17). Alternativamente puede usarse el líquido fijador de la citología en fase líquida implantada ya en la mayoría de los Laboratorios de Anatomía Patológica.
Los cilindros de tejido se procesan de manera rutinaria, con fijación en formalina e inclusión en parafina. El corte del bloque de parafina en el microtomo debe aprovechar el material desde el principio, reservando 2 ó 3 cortes en blanco montados sobre portas especiales para la realización de pruebas de inmunohistoquímica en el caso de ser éstas necesarias. Es necesario recalcar que el estado de conservación y el procesamiento posterior del tejido, desde la fijación hasta el montaje y tinción, deben ser exquisitos para que todas las características histológicas estén bien preservadas, ya que la cantidad de tejido para evaluar es habitualmente escasa y los criterios diagnósticos poco abundantes.
LO QUE SE PUEDE DIAGNOSTICAR, Y CÓMO HACERLO
Como planteamiento inicial del patólogo, es útil realizar el ejercicio de analizar piezas quirúrgicas de tiroides con patologías comunes, como hiperplasia, tiroiditis, carcinoma papilar, y también la zona de tiroides «histológicamente normal», y hacerlo con los objetivos de gran aumento para crear ficticiamente las condiciones de escasez de tejido con las que nos vamos a encontrar en los cilindros, y de paso para familiarizarse con situaciones o imágenes que con frecuencia no se valoran suficientemente cuando tenemos el «exceso de datos» que proporciona una biopsia quirúrgica. Es bueno, por lo tanto, colocarse con los objetivos de 20 y de 40 aumentos en diversas zonas de una hiperplasia multinodular, por ejemplo, en el centro de los nódulos donde a veces hay esclerosis, o hemosiderina, en el borde con el tejido normal frecuentemente comprimido por el nódulo adyacente, etc, porque ésta será la forma imperfecta pero habitual de «asomarse» a este material en la práctica real. De este ejercicio se desprenden los comentarios que aparecen en los siguientes párrafos sobre las distintas situaciones clínicas.
Tejido tiroideo normal
Es poco probable que se biopsie el tiroides si no se detectan nódulos, quistes, tumores u otras lesiones. Lo común es que se obtenga tejido normal cuando el radiólogo marra la punción no alcanzando la diana. Esto puede ocurrir bien por inexperiencia o bien por dificultades intrínsecas del caso, en nódulos pequeños, o localizados en zonas difícilmente accesibles.
Se puede diagnosticar tejido tiroideo normal, o sin alteraciones reseñables, cuando los cilindros biopsia contengan folículos regulares, sin plegamientos u otros signos que denoten hiperfunción, sin rigidez en el contorno de los mismos, simulando «balones de playa desinflados» (fig. 4), que estén inmersos en un estroma escaso o inaparente, sin fibrosis, inflamación, ni hemorragia. Las células que constituyen los folículos muestran de forma característica talla baja y núcleos pequeños e hipercromáticos (fig. 4).
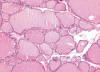
Fig. 4:
Tejido tiroideo normal. Obsérvese los folículos tiroideos de contornos
ondulantes (imagen de balón de playa deshinchado), las células con escaso
citoplasma y núcleo cromático y el escaso estroma, edematoso.
(Hematoxilina-Eosina, x250).
Tejido tiroideo hiperplásico
Bien sea único o múltiple, el nódulo hiperplásico es la patología más frecuentemente biopsiada. Los hallazgos son muy variables, dependiendo de las características de la hiperplasia, del tamaño de los nódulos, de su situación, etc.
El tejido tiroideo hiperplásico contiene folículos de morfología y tamaño variables mezclados unos con otros. Su contorno es rígido, simulando «balones de playa bien inflados» (fig. 5), pudiendo contener plegamientos internos, señales todas ellas que reflejan de alguna manera hiperfunción. Dependiendo de la zona puncionada, es posible encontrar estroma ampliado con fibrosis, hemorragia antigua y/o reciente, inflamación, edema intersticial, acúmulos de macrófagos, cristales de colesterol, coloide extravasado y reacción a cuerpo extraño, y calcificaciones (fig. 6). La punción de zonas centrales esclerosadas o cicatriciales puede simular un adenoma debido a la frecuente presencia en ellas de microfolículos. Las células hiperplásicas tienen talla más alta que las normales, pero conservan su núcleo pequeño e hipercromático.
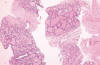
Fig. 5:
Tejido tiroideo hiperplásico. Los cilindros contienen bandas de fibrosis que se
paran grupos de folículos de morfología y diámetro variable
(Hematoxilina-Eosina, x40).

Fig. 6:
Zona esclerótica calcificada en el centro de un gran nódulo hiperplásico
(Hematoxilina-Eosina, x250).
Tiroiditis
El enfoque clínico es fundamental para diagnosticar una tiroiditis en este tipo de material tan escaso ya que, dependiendo del contexto, la misma imagen histológica puede corresponder a una tiroiditis linfocítica o a una tiroiditis de Hashimoto, por ejemplo.
El centrifugado del líquido de transporte muestra grupos o células foliculares sueltas en un fondo linfocitario (fig. 7). Los cilindros de tejido tiroideo muestran un importante infiltrado linfoide (fig. 8), presentándose de forma difusa, en simples acúmulos, o incluso formando auténticos folículos linfoides con centros claros. En la misma medida que aumenta la inflamación disminuye el número de folículos tiroideos, apareciendo simultáneamente microfolículos agrupados compuestos por células con transformación oxifílica. La inflamación puede contener células gigantes en número variable, y también células plasmáticas. Dependiendo del momento evolutivo, las tiroiditis contienen un grado variable de fibrosis estromal. Ésta puede ser muy notoria en la variedad fibrosa de tiroiditis de Hashimoto o en la extraordinariamente rara tiroiditis de Riedel.
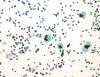
Fig. 7:
Tiroiditis de Hashimoto. Imagen citológica obtenida del citocentrifugado del
líquido de transporte. Obsérvese las células epiteliales sueltas mostrando
amplio citoplasma de aspecto oxifílico en un fondo inflamatorio (Papanicolaou,
x250).
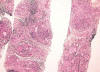
Fig. 8:
Tiroiditis de Hashimoto. Imagen histológica de
los cilindros mostrando una arquitectura lobulada del tejido tiroideo, con
fibrosis e inflamación parcheada (Hematoxilina-Eosina, x40).
La manipulación vigorosa en la exploración física del tiroides previa a la punción puede hacer que los cilindros de tejido contengan abundantes linfocitos.
Quistes y otras estructuras peritiroideas
El estudio ecográfico previo es muy útil para determinar la naturaleza del quiste y detectar las áreas sólidas si las tiene, pudiendo puncionarlas selectivamente.
Los quistes en el tiroides pueden depender de restos embriológicos, y en esos casos la localización dirá si se trata de quistes del conducto tirogloso (línea media) o de quistes branquiales (laterales), o pueden ser el resultado de la quistificación de nódulos previamente sólidos, en este caso casi siempre de naturaleza hiperplásica. De no contener polos sólidos, el tejido obtenido en los quistes suele ser muy escaso, o incluso nulo. El contenido del mismo es variable, desde coloide hasta purulento. Si el contenido es líquido transparente debe considerarse seriamente la posibilidad de haber pinchado un quiste de paratiroides. En el mejor de los casos, se obtendrá tejido fibroso de la pared, normalmente desprovista de epitelio, conteniendo algunos folículos tiroideos atrapados.
Dependiendo de la localización exacta del tiroides, de su tamaño y forma, y de la patología que contenga, se puede pinchar, en lugar de tiroides, ganglios linfáticos, timo y glándulas paratiroides. Todas estas estructuras muestran una histología característica. La glándula paratiroides puede estar mínimamente representada en una punción de tiroides. Recordar que sus células forman cordones y pequeños folículos en un estroma con tejido adiposo, que su citoplasma es escaso y claro, y que a veces muestran cambio oxifílico prominente, es importante para evitar confusiones.
Es frecuente encontrar fragmentos de músculo estriado y/o tejido adiposo acompañando al tejido tiroideo en los cilindros de punción. Es poco frecuente encontrar la cápsula fibrosa normal de la glándula.
Carcinoma papilar
El diagnóstico del carcinoma papilar reside en la identificación de las características nucleares y en este sentido la escasez de la muestra no debe ser un obstáculo para el diagnóstico. La problemática, sin embargo, está condicionada fundamentalmente por el muestreo y por la representatividad de los especímenes obtenidos. Así, según explican LiVolsi y Baloch (18) en una revisión reciente, el carcinoma papilar puede constituir un nódulo tumoral en sí mismo, o formar parte de un nódulo hiperplásico, bien de manera unifocal o multifocal. En estas circunstancias, el muestreo es difícil y azaroso, y el tejido obtenido aún más escaso. Conviene recordar, por lo tanto, que se puede estar delante de un carcinoma papilar en vecindad de un tiroides hiperplásico, y que un diagnóstico no excluye al otro. En este caso, se mezclarán las características de tejido hiperplásico anteriormente mencionadas y las de carcinoma papilar.
Es bien conocida la asociación entre tiroiditis de Hashimoto y carcinoma papilar de tiroides (19). En este caso el diagnóstico de carcinoma papilar es más difícil, o incluso imposible dependiendo del caso, debido a los consabidos cambios celulares que induce la autoagresión en las células foliculares tiroideas.
El carcinoma papilar puede contener papilas, a veces sólo de manera muy focal, o no contenerlas en absoluto (fig. 9). La citología muestra células de núcleo claro, a veces superpuestas en capas, con hendiduras, formando grupos tridimensionales papiliformes o placas poco cohesivas (fig. 10). En el corte histológico del cilindro, el agrandamiento, solapamiento y aclaramiento nucleares, junto con las hendiduras y las perforaciones, son datos histológicos claves (fig. 11) en el diagnóstico. A veces se añaden cuerpos de psammoma, esclerosis de estroma y otros cambios bien conocidos por los patólogos. La inmunotinción con HBME-1 (fig. 12) y con CK19 ayudará a identificar dichas células como neoplásicas. La positividad con CK19 debe ser intensa pero debe interpretarse con cuidado sobre todo en un contexto de tiroiditis. La positividad con HBME-1 es mucho más fiable, sin falsos positivos apreciables, aunque es negativa en aproximadamente el 30% de los casos de carcinoma papilar.
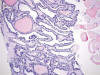
Fig. 9:
Carcinoma papilar. Imagen panorámica que muestra una proliferación de
estructuras foliculares en un estroma esclerosado. Focalmente se aprecia
solapamiento y aclaramiento de núcleos (Hematoxilina-Eosina, x100).
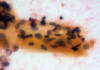
Fig. 10:
Carcinoma papilar. Citología del líquido de transporte mostrando una papila en
la que aparecen aclaramiento y agrandamiento nuclear así como hendiduras.
(Papanicolaou, x400).
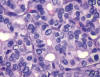
Fig. 11:
Carcinoma papilar. Detalle histológico de los cambios nucleares típicos
(Hematoxilina-Eosina, x400).
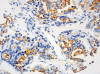
Fig. 12:
Carcinoma papilar. Intensa positividad de membrana con HBME-1 (HBME-1, Dako,
contratinción con hematoxilina, x250).
Por último, es conveniente examinar cuidadosamente los extremos de los cilindros, no despreciando la evaluación de aquellas áreas manifiestamente extratiroideas ya que, en caso de contener tumor, el dato que proporciona el patólogo es de vital importancia clínica. De hecho, es bien conocido que la extensión extratiroidea al diagnóstico es uno de los factores de peor pronóstico en estos pacientes.
Carcinoma medular
Siempre hay que pensar en el carcinoma medular cuando el patólogo se encuentra frente a un tumor epitelial de características poco definidas. La aproximación diagnóstica en cortes de hematoxilina-eosina de muestras tan pequeñas como las que aquí se están comentando puede ser difícil. Sin embargo, la intensa positividad para calcitonina (fig. 13), cromogranina y CEA, y la ausencia de marcaje con tiroglobulina delatan claramente la naturaleza del tumor.
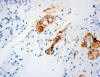
Fig. 13:
Carcinoma medular. Intensa positividad focal con calcitonina (Calcitonina, Dako,
contratinción con hematoxilina, x250).
La citología del líquido de transporte muestra una celularidad poco cohesiva compuesta por elementos de hábito oncocitoide con las técnicas de Papanicolaou. El tumor contiene células poliédricas organizadas en nidos, cordones, lóbulos sólidos, y pseudoglándulas inmersos en una matriz con esclerosis (fig. 14), a veces con depósitos de material eosinófilo y acelular identificable como amiloide con las técnicas específicas. Las células muestran un citoplasma eosinófilo granular.
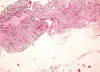
Fig. 14:
Carcinoma medular. Imagen panorámica mostrando la esclerosis del estroma con
abundante material eosinofílico y grupos cordonales de células con abundante
artefacto (Hematoxilina-Eosina, x40).
Otros carcinomas tiroideos primarios
Aparte de los carcinomas papilar y medular comentados, y a excepción de carcinoma folicular cuyas dificultades diagnósticas se revisarán posteriormente, existen muy pocas posibilidades reales de toparse con otras variedades histológicas de carcinoma tiroideo. En todo caso, siempre que la clave resida en la demostración de las características intrínsecas de tumor, el diagnóstico podrá realizarse si en material remitido en el cilindro es representativo. A continuación se comentan dos ejemplos.
El carcinoma insular, o carcinoma pobremente diferenciado, es una neoplasia derivada de los folículos tiroideos que se sitúa a medio camino entre los tumores bien diferenciados y el carcinoma anaplásico (20). En ocasiones se pueden identificar focalmente rasgos nucleares de carcinoma papilar que indican su origen. El tumor crece formando nidos sólidos y es difícil de encontrar formación de folículos. Se observa actividad mitósica, expresión elevada de Ki67, focos de micronecrosis.
El carcinoma mucoepidermoide esclerosante (21), es una neoplasia muy poco frecuente. El cilindro de tejido tiroideo es fibroso y se puede manipular con facilidad en el Laboratorio, a diferencia de lo que ocurre en la mayor parte de la patología tiroidea comentada hasta el momento. La citología del líquido muestra grupos irregulares de células de hábito escamoide, con citoplasmas bien definidos anfófilos, a veces vacuolados (fig. 15) e inflamación crónica variable de fondo. El corte histológico muestra un tejido en el que predomina el estroma (fig. 16) con inflamación linfocítica variable, y en el que aparecen nidos irregulares de células atípicas con vacuolas intracitoplásmicas azul Alcian positivas (fig. 17).
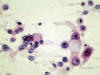
Fig. 15:
Carcinoma mucoepidermoide esclerosante. Detalle citológico del citocentrifugado
del líquido de transporte en el que aparecen grupos de células malignas con
nucleolo prominente y con vacuolas citoplásmicas (Hematoxilina-Eosina, x400).
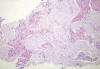
Fig. 16:
Carcinoma mucoepidermoide esclerosante. Corte histológico del cilindro mostrando
gran esclerosis de fondo y nidos cohesivos de células de citoplasma amplio y
hábito escamoide (Hematoxilina-Eosina, x250).
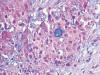
Fig. 17:
Carcinoma mucoepidermoide esclerosante. Detalle histológico mostrando nidos de
células malignas con vacuolas de mucina intracitoplásmicas (Pas Alcian, x250).
Linfomas
Los linfomas y plasmocitomas primarios del tiroides son raros, y la afectación secundaria del tiroides por casos de distribución sistémica, también lo es. En este terreno es particularmente importante la contextualización de los datos histológicos en la clínica concreta del paciente En primer lugar, la presencia de un infiltrado linfoide denso en el tiroides debe hacer pensar sobre todo en tiroiditis, cuyas características ya se han comentado en párrafos anteriores.
Descartadas las tiroiditis, es necesario demostrar la naturaleza del infiltrado linfoide valorando los datos citológicos e inmunohistoquímicos clásicos en los linfomas, que permitan etiquetar el caso como linfoma de células grandes, pequeñas, de células B, folicular, etc.
Otros tumores
Las metástasis en el tiroides no son frecuentes. Los tumores primarios que más frecuentemente metastatizan en el tiroides son el carcinoma renal y el pulmonar (22). Algo más frecuente es la extensión secundaria al tiroides de carcinomas localizados en órganos o estructuras vecinas, como la laringe o los ganglios cervicales. En todos estos casos, la clínica y los estudios radiológicos de extensión deben proporcionar datos clave para enfocar correctamente el diagnóstico histológico.
Teratomas, timomas ectópicos, angiosarcomas, tumores derivados del tejido muscular, de la vaina nerviosa periférica, paragangliomas, tumores fibrosos solitarios, enfermedad de Rosai-Dorfman, tumores de las células foliculares dendríticas, histiocitosis de Langerhans, son entidades excepcionales en el tiroides que difícilmente van a ser objeto de punción biopsia pero que pueden ser sugeridas o diagnosticadas y sus características histológicas definitorias aparecen en los cilindros.
LO QUE NO SE PUEDE DIAGNOSTICAR, Y POR QUÉ
No se puede diagnosticar la dualidad adenoma/carcinoma folicular, ni en sus formas convencionales ni en sus variantes oncocíticas, y en este sentido la técnica no mejora las limitaciones ya conocidas en la punción aspiración con aguja fina. En ambos casos se observa una proliferación microfolicular citológicamente anodina, tanto en el citocentrifugado del líquido de transporte (fig. 18) como en el corte histológico (fig. 19). La determinación del índice de proliferación celular (fig. 20) y otros marcadores inmunohistoquímicos no han demostrado efectividad a la hora de diferenciar ambas entidades.
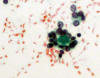
Fig. 18:
Detalle citológico de un carcinoma folicular diagnosticado «a posteriori» en la
pieza quirúrgica. Obsérvese el microfolículo centrado por material coloide
(Papanicolaou, x400).
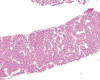
Fig. 19:
Carcinoma folicular (diagnosticado «a posteriori»). Corte histológico mostrando
microfolículos, cordones y nidos sólidos indistinguibles de un adenoma folicular
(Hematoxilina-Eosina, x40).
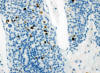
Fig. 20:
Carcinoma folicular (diagnosticado «a posteriori») mostrando bajo índice de
proliferación (MIB-1, Dako, contratinción con hematoxilina, x250).
Un diagnóstico anatomopatológico de carcinoma folicular es un hecho muy serio para el paciente, ya que se trata de una neoplasia poco frecuente pero agresiva y con gran potencial metastatizante. Aunque la variante mínimamente invasiva se asocia a porcentajes bajos de fallecimiento, entre el 3 el 5%, la mortalidad relacionada con la enfermedad a largo plazo en el carcinoma folicular convencional alcanza hasta el 50% (23). Por el contrario, el adenoma folicular es una lesión muy frecuente y banal. La responsabilidad del patólogo en este campo es muy alta y la aplicación de los criterios debe ser muy estricta.
Sólo se puede diagnosticar carcinoma folicular en presencia inequívoca de invasión capsular y/o vascular según esquemas ampliamente publicados en revistas y libros especializados (24). Para ser valorada como tal, la invasión capsular debe ser penetración completa de todo el espesor de la cápsula que limita al nódulo, que por lo general es gruesa y fibrosa. La invasión vascular debe descartar de forma inequívoca el arrastre de nidos foliculares hacia la luz de los vasos durante el procesamiento del bloque de parafina. En este sentido, ayuda la identificación de fenómenos de trombosis asociado al nido de células «problema» o el hecho de encontrar adhesión del grupo de células a la pared endotelial.
Todas estas circunstancias se dan de manera focal en las piezas quirúrgicas y es habitualmente necesario incluir abundante tejido para demostrarlas. Por eso, la posibilidad de encontrar estos datos histológicos definitorios en los cilindros de biopsia es prácticamente nula y, en consecuencia, el diagnóstico imposible.
CONCLUSIONES
La biopsia de tejido tiroideo obtenida por punción con control ecográfico es un procedimiento diagnóstico barato, rápido, y fiable en la patología tiroidea. Aunque no anula la validez de la punción aspiración con aguja fina, mejora los resultados de ésta según varias series publicadas recientemente. El procedimiento de punción y manejo de la muestra que se detalla en la presente revisión proporciona cortes histológicos y centrifugado del líquido de transporte aunando de alguna manera ambas técnicas en un solo acto. Con material apropiado y un mínimo de experiencia, se puede diagnosticar con fiabilidad toda la patología tiroidea excepto el adenoma/carcinoma folicular. La técnica obtiene sus mejores resultados cuando se contextualizan sus resultados en un comité multidisciplinario propio que estudie de manera integral y consensuada los casos especialmente problemáticos.
REFERENCIAS
Liebeskind A, Sikora AG, Komisar A, Slavit D, Fried K. Rates of malignancy in incidentally discovered thyroid nodules evaluated with sonography and fine-needle aspiration. J Ultrasound Med 2005; 24: 629-34.
Deandrea M, Mormile A, Veglio M, Motta M, Pellerito R, Gallone G, Grassi A, y cols. Fine-needle aspiration biopsy of the thyroid: Comparison between thyroid palpation and ultrasonography. Endocr Pract 2002; 8: 282-6.
Izquierdo R, Arekat MR, Knudson PE, Kartum KF, Khurana K, Kort K, Numann PJ. Comparison of palpation-guided versus ultrasound-guided fine-needle aspiration biopsies of thyroid nodules in an outpatient endocrinology practice. Endocr Pract 2006; 12: 609-14.
Danese D, Sciacchitano S, Farsetti A, Andreoli M, Pontecorvi A. Diagnostic accuracy of conventional versus sonograpgy-guided fine-needle aspiration biopsy of thyroid nodules. Thyroid 1998; 8: 15-21.
Flanagan MB, Ohori NP, Carty SE, Hunt JL. Repeat thyroid nodule fine-needle aspiration in patients with initial benign cytologic results. Am J Clin Pathol 2006; 125: 698-702.
Furlan JC, Bedart YC, Rosen IB. Single versus sequential fine-needle aspiration biopsy in the management of thyroid nodular disease. Can J Surg 2005; 48: 12-8.
Taki S, Kakuda K, Kakuma K, Annen Y, Katada S, Yamashita R, Kosugi M, Michigishi T, Tonami N. Thyroid nodules: Evaluation with US-guided core biopsy with an antomated biopsy gun. Radiology 1997; 202: 874-7.
Screaton NJ, Berman LH, Grant JW. US-guided core-needle biopsy of the thyroid gland. Radiology 2003; 226: 827-32.
Harvey JN, Parker D, De P, Shrimali RK, Otter M. Sonographically guided core biopsy in the assessment of thyroid nodules. J Clin Ultrasound 2005; 33: 57-62.
Renshaw AA, Pinnar N. Comparison of thyroid fine-needle aspiration and core needle biopsy. Am J Clin Pathol 2007; 128: 370-4.
Frates MC, Benson CB, Charboneau JW, et al. Management of Thyroid Nodules Detected at US. Radiology 2005; 237:794-800.
Danese D, Sciacchitano S, Farsetti A, Andreoli M, Pontecorvi A. Diagnostic accuracy of conventional versus sonography-guided fine-needle aspiration biopsy of thyroid nodules. Thyroid 1998; 8:15-21.
Strauss EB, Iovino A, Upender S. Simultaneous fine-needle aspiration and core biopsy of thyroid nodules and other superficial head and neck masses using sonographic guidance. AJR 2008; 190:1697-9.
Lopez JI, del Cura JL, Zabala R, Bilbao FJ. Usefulness and limitations of ultrasound-guided core biopsy in the diagnosis of musculoskeletal tumours. APMIS 2005; 113: 353-60.
Lopez JI, del Cura JL, Fernández de Larrinoa A, Gorriño O, Zabala R, Bilbao FJ. Role of ultrasound-guided core biopsy in the evaluation of spleen pathology. APMIS 2006; 114: 492-9.
Lopez JI, Fernández de Larrinoa A, Zabala R, Oleada L, del Cura JL, Bilbao FJ. Utilidad de la biopsia cilindro guiada por control ecográfico en el diagnóstico y manejo de los tumores renales. Rev Esp Patol 2006; 39: 219-27.
Fernández de Larrinoa A, del Cura JL, Zabala R, Fuertes E, Bilbao FJ, Lopez JI. Value of ultrasound-guided core biopsy in the diagnosis of malignant lymphomas J Clin Ultrasound 2007; 35: 295-301.
LiVolsi VA, Baloch ZW. Follicular neoplasms of the thyroid. View, biases, and experiences. Adv Anat Pathol 2004; 11: 279-87.
Liu LH, Bakhos R, Wojcik EM. Concomitant papillary thyroid carcinoma and Hashimoto’s thyroiditis. Semin Diagn Pathol 2001; 18: 99-103.
Sobrinho-Simoes M, Albores-Saavedra J, Tallini G y cols. Poorly differentiated carcinoma. En Pathology and Genetics of Tumours of Endocrine Organs, Eds.: DeLellis RA, Lloyd RV, Heitz PU, Eng C., IARC Press, Lyon, 2004, pp 73-6
Lopez JI, Gaafar A, Garmendia M, Velasco V, Ortega FJ, del Cura JL. Sclerosing mucoepidermoid carcinoma of the thyroid gland: Cytohistological findings of a case. Hematol Oncol Stem Cell Ther 2008; 1: 62-5.
DeLellis RA. Secondary Tumours of the thyroid, En Pathology and Genetics of Tumours of Endocrine Organs, Eds.: DeLellis RA, Lloyd RV, Heitz PU, Eng C., IARC Press, Lyon, 2004, pp122-3
Sobrinho-Simoes M, Asa SL, Kroll TG y cols. Follicular carcinoma. En Pathology and Genetics of Tumours of Endocrine Organs, Eds.: DeLellis RA, Lloyd RV, Heitz PU, Eng C., IARC Press, Lyon, 2004, pp 67-72.
Chan JKC. Tumors of the thyroid and parathyroid glands. En: Fletcher CDM, ed., Diagnostic Histopathology of Tumors, 3rd Edition, Churchill Livingstone Elsevier, Philadelphia, 2007, pp 997-1097.