
Vol. 42, n.º 4, 2009
REVISTA
ESPAÑOLA DE
Vol. 42, n.º 4, 2009 |
ORIGINALES
Rogelio González González1, Ronell Bologna Molina2, Nelly Molina Frechero3, Guillermo Amezcua Rosas4, Patricia Mendoza Roaf2, Cintia Paola Morales Martínez1, Iveth Correa Prado5 Hugo Domínguez Malagon6
1 Centro
Interdisciplinario de Ciencias de la Salud, Departamento de Ciencias
Morfofisiológicas, Instituto Politécnico Nacional (CICS-IPN) México DF.
2 Instituto de Investigaciones Odontológicas, Universidad de
Guadalajara (U de G) Guadalajara, México.
3 Departamento de Atención a la Salud, Universidad Autónoma
Metropolitana, México.
4 Instituto Dermatológico de Jalisco «Dr. José Barba Rubio».
5 Centro de Investigaciones Universidad de Cuautitlan Izcalli
(CIUCI).
6 Departamento de Patología Quirúrgica, Instituto Nacional de
Cancerología, México. (INCan).
rogegg26@yahoo.com
RESUMEN
El factor de crecimiento del endotelio vascular (VEGF) es un factor importante que participa en la angiogénesis. Un incremento en su expresión se asocia a progresión tumoral y mal pronóstico en diversos tipos de tumores malignos. El propósito de este estudio es evaluar la expresión de VEGF y su receptor (KDR/VEGF-2) en carcinomas papilares de tiroides (CPT) mayores y menores a 10 mm con extensión extracapsular (CPT-E) y sin extensión extracapsular (CPT-NE) y la relación de esta expresión con el comportamiento clínico (CPT-E y CPT-NE). Métodos: La expresión de VEGF-A y KDR se estudió con técnica de matrices tisulares (MAT), en un total de 62 casos de CPT-E y CPT-NE mayores y menores a 10mm. La positividad de VEGF-A y KDR fue predominantemente citoplasmática y evaluada en 0-, 1+ y 2+. Resultados: La expresión de VEGF-A fue equiparable en CPT-E y CPT-NE, no encontrando significación estadística entre tamaño tumoral y entre CPT-E y CPT-NE, pero se encontró una mayor intensidad en CPT-E >10 mm, mientras que en KDR la expresión fue más frecuente en CPT-NE ≤10 mm. La intensidad fue semejante entre ambos grupos y con respecto al tamaño tumoral. Conclusiones: Los resultados obtenidos concuerdan con los anteriormente publicados, sin embargo no se han realizado estudios con invasión extracapsular, relación clínica y expresión de VEGF-A y KDR. La intensidad de VEGF-A en la expresión de las células tumorales fue mayor en CPT-E >10 mm, mientras que la intensidad de expresión en KDR fue semejante entre ambos grupos. Concluyendo que la sobreexpresión de VEGF-A y no de KDR se encuentra relacionada a la invasión extracapsular y por tanto a mal pronóstico.
Palabras Clave: VEGF, KDR, VEGFR-2, factores pronóstico de carcinoma papilar de tiroides, carcinoma papilar de tiroides, inmunohistoquímica.
SUMMARY
Angiogenesis is important in the growth and progression of tumours. Vascular endothelial growth factor (VEGF) is the most important factor in vascular neoformation and an increase in its expression is associated with tumour progression and a worse prognosis. The purpose of this study is to evaluate the expression of VEGF-A and its receptor KDR/VEGF-2 in papillary thyroid carcinomas (PTC), larger or smaller than 10 mm, and with or without extracapsular extension (PTC-E and PTC-NE). Methods: VEGF-A and KDR were studied with tissue microarray (TMA) in a total of 62 cases of PTC-E and PTC-NE larger and smaller than 10mm. Results: the positivity of VEGF-A and KDR was predominantly similar in PTC-E and PTC-NE with no statistical significance between tumour size and PTC-E and PTC-NE. However, the intensity of expression was higher for PTC-E >10mm, while KDR was more frequently expressed in PTC-NE ≤10mm. The intensity was similar for both groups and sizes. Conclusion: the results obtained correlate with previously published results, however, there are no reports in the literature related to the correlation of extracapsular extension and VEGF-A and KDR. Whereas the expression of KDR was similar in both groups, VEGF-A was higher in PTC-E >10mm, which would indicate that an over expression of VEGF-A may be related to extracapsular invasion.
Keywords: VEGF, KDR, VEGFR-2, prognostic factors in papillary carcinoma of the thyroid, papillary carcinoma of the thyroid, immunohistochemistry.
INTRODUCCIÓN
El carcinoma papilar de tiroides (CPT) es una de las neoplasias malignas más comunes de esta glándula, es frecuente en mujeres y se clasifica dentro de los carcinomas bien diferenciados (1). El CPT con extensión extratiroidea (CPT-E) se asocia directamente a recurrencias locales, relacionándose con otros factores de mal pronóstico como, edad >45 años, género masculino, tamaño >4cm y metástasis a distancia (1,2). El CPT sin extensión extratiroidea (CPT-NE) en conjunto con otras características, como edad <45 años, tamaño tumoral ≤3 cm y variantes histológicas encapsulada, folicular, oncocítica, entre otras, son considerados factores que favorecen un buen pronóstico. Características histopatológicas como invasión vascular y linfática, angiogénesis, proliferación celular, desprendimiento de células neoplásicas y variedades como carcinomas de células altas, columnares y esclerosante difusa, son considerados factores de mal pronóstico asociados a progresión de enfermedad, recurrencias e incluso muerte por tumor (3,4). En proliferación celular, angiogénesis, tamaño tumoral, extensión extratiroidea, desprendimiento de células neoplásicas, participan diversas moléculas de adhesión y factores de crecimiento. Algunos de estos factores de crecimiento pueden estimular angiogénesis encontrándose estrechamente relacionados con la implantación, el crecimiento y el desarrollo tumoral. Esta característica es debida a que las células tumorales secretan diversos tipos de factores de crecimiento que participan en angiogenesis (b-FGF, PDGF, EGF, TNF, VEGF, angiogenina, entre otros), siendo estos factores necesarios para el desarrollo y crecimiento tumoral (5-8). De los factores de crecimiento, el que tiene una mayor participación en la angiogénesis es VEGF que es un factor angiogénico y mitogénico con unión a heparina, tiene alta especificidad para células endoteliales y participa tanto en angiogénesis fisiológica como patológica incrementando la proliferación y migración de células endoteliales (9,10).
VEGF Pertenece a una familia compuesta por cinco miembros: A, B, C, D y factor de crecimiento placentario, no solamente induce respuesta angiogénica si no que también participa en la degradación de la matriz extracelular de las células endoteliales que lo rodean (11,12) Su acción la ejerce por medio de receptores tirosina-cinasa, de los cuales los más importantes son FLK-1/KDR y Flt-1. Estos receptores tienen funciones distintas: mientras que KDR induce cambios en la morfología celular de células endoteliales y hematopoyéticas, Flt-1 participa en el ensamblaje de canales vasculares. VEGF se expresa en una gran variedad de tejidos incluyendo tiroides, en esta glándula se le considera como el principal mediador de angiogenesis y es secretado por células foliculares, probablemente en respuesta a hormona estimulante de tiroides (13,14). Su expresión es mínima en glándula tiroides normal, pero en carcinomas tiroideos se ha visto que existe sobreexpresión de este factor relacionado directamente con el tamaño, extensión y recurrencia tumoral (15,16). Esto ocurre durante el proceso de transformación maligna de las células tiroideas por diversos eventos que regulan la expresión de VEGF y sus receptores, dentro de los más importantes se encuentran: hipoxia, deficiencia de p53 y mutaciones de RAS y BRAF aunque todavía no se ha evaluado si existe relación entre mutación de BRAF y la expresión de VEGF. Por lo anteriormente mencionado, VEGF juega un papel importante en las fases tempranas de la tumorogénesis observándose una sobreexpresión en etapas más tardías, sugiriendo que pueda existir una estimulación paracrina o autocrina de las células tumorales (17) Con el objeto de identificar a VEGF y su receptor KDR como posibles mediadores en la invasión extracapsular y en la progresión tumoral del CPT. Se explora un grupo de pacientes con factores clínicos adversos (extensión extratiroidea), y la posible sobreexpresión de los marcadores VEGF y su receptor KDR para determinar su asociación de estos factores con el pronóstico.
MATERIALES Y METODOS
Se estudiaron los registros del departamento de tumores de cabeza y cuello del Instituto Nacional de Cancerología, México (INCan) entre los años 2000 a 2005, identificando los pacientes con carcinoma papilar de tiroides y evaluando variables demográficas como: edad (<45 años y ≥45 años), genero y tamaño tumoral ( ≤10 mm y >10 mm). El material de patología incluyendo laminillas y bloques de parafina se extrajeron del archivo de patología, 40 casos correspondieron a CPT-E, y 22 casos correspondieron a CPT-NE. Todas las muestras obtenidas fueron reevaluadas por 3 diferentes patólogos del INCan, para confirmar el diagnostico de acuerdo a la última revisión de la OMS (18). Se realizaron matrices tisulares (MAT) de acuerdo al método descrito por Pan CC et al (19), elaborando cortes de 4 mm de diámetro de las zonas representativas de cada caso. Cada muestra fue tomada de áreas de invasión extracapsular para los CPT-E y áreas hipercelulares y cercanas a la capsula para los CPT-NE. Para los estudios de inmunohistoquímica cada bloque de MAT fue cortado a 2 µm de grosor y montados en laminillas tratadas con poli-lisina y posteriormente secadas a temperatura ambiente por una noche. Después de la desparafinización y rehidratación cada corte fue tratado con 0,1 M, de citrato de sodio (pH 6,2) y con tween 20 para revelar los epitopos. La peroxidasa endógena fue bloqueada con 0,9% de peróxido de hidrógeno, posteriormente se incubó en PBS con 1% de suero de bovino por 5 minutos, para eliminar uniones ligando no específicas, Se utilizó anticuerpo policlonal anti-VEGF-A (clone Z-CVF3, Zymed Laboratories Inc. Dilution 1:50) y anticuerpo monoclonal anti-KDR (clone KDR-1, Sigma Chemical Corporation. Dilution 1:25). Las laminillas fueron incubadas 45 minutos con el anticuerpo primario y posteriormente fueron incubados 30 minutos con anticuerpos biotinilados antiratón/anticonejo y con el complejo estreptavidina/peroxidasa (LSAB + Labeled streptavidin-Biotin, Dako Corportion, Carpinteria, CA, USA) respectivamente.
Para visualizar la reacción se utilizó como sustrato 3,3’-diaminobencidina-H2O (Dako Corporation, Carpintería Calif. USA). Las laminillas fueron contrateñidas con solución de hematoxilina de Mayer. Para los controles negativos el anticuerpo primario fue reemplazado por PBS. Posteriormente cada TMA fue evaluado de manera independiente con microscopia de luz por tres diferentes patólogos, sin acceso a información clínica. Cuando la opinión de los tres evaluadores difería se llegaba a un acuerdo por consenso.
CUANTIFICACIÓN DE LA INMUNOEXPRESIÓN SOBRE CÉLULAS TUMORALES
La expresión de VEGF y KDR en células tumorales fue calculado usando un microscopio de luz con objetivos 10x y 40x, (Olympus CX-31) tomando fotografías con una cámara digital (Olympus C-7070) las fotomicrografías fueron tomadas de la interface tumor-estroma. La expresión de VEGF y KDR fue predominantemente citoplasmática, su intensidad fue evaluada de manera arbitraria usando una escala modificada del método descrito previamente por Martin Götte et al (20). Las muestras con inmunoexpresión de moderada a intensa (1+ y 2+) fueron catalogadas como positivas y las muestras con expresión débil o ausente (0–) fueron definidas como negativas.
ANÁLISIS ESTADÍSTICO
Para el análisis estadístico se utilizaron las pruebas x2 Pearson y exacta de Fisher. Para obtener valores esperados, La prueba de Mann-Whitney (U-test) y Kurskal Wallis, fueron utilizadas para detectar diferencias entre CPT-E y CPT-NE, los resultados se consideraron significativos con p ≤0.05. Y fueron tabulados y analizados usando el paquete estadístico SPSS 12.0 (SPSS Professional Statistics, SPSS Inc., IL, USA).
RESULTADOS
Se revisaron 206 casos de carcinoma papilar de tiroides, de los cuales se eligieron 62 que reunieron criterios de inclusión al estudio: 14 hombres (22,5%) y 48 mujeres (77,5%), con edad media de 45.4±14.7 años (mínimo 17, máximo 76). 40 corresponden a carcinoma CPT-E y 22 casos a CPT-NE. La distribución por etapa clínica fue como sigue: Etapa clínica I, 32 casos (52%); II 3 (5%), III 2 (3%), IVA 20 (32%), IVB 4 (6%), IVC 1(2%). (Grafica 1 y 2). No se encontró en ambos grupos, asociación significativa entre edad, género, etapa clínica y expresión de VEGF y KDR.
Expresión de VEGF y KDR en carcinomas papilares de tiroides
Expresión de VEGF-A: VEGF-A presentó expresión en CPT-E, en 30/40 (75%) casos, equiparable a la encontrada en CPT-NE 17/22 (77,2%) casos. No se encontró asociación significativa en la expresión de VEGF entre ambos grupos y con respecto al tamaño tumoral (tabla 1). (figs. 1 y 2, a y c)
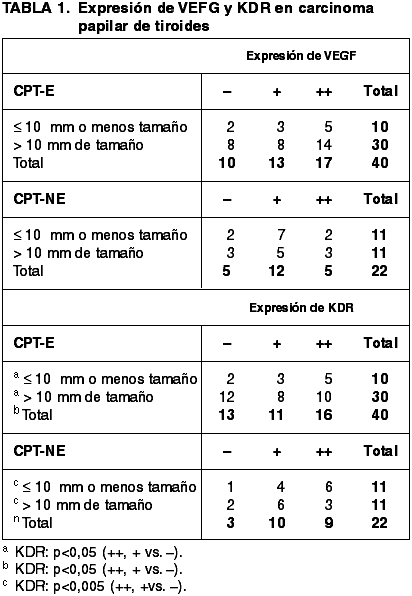
Expresión de KDR: KDR presentó expresión en 27/40 (67,5%) casos de CPT-E versus 19/22 (86,3%) casos de CPT-NE (p<0,05). Con respecto al tamaño tumoral los CPT-E >10 mm, la expresión fue de 18/30 (60%) casos. Mientras que en los ≤10 mm fue de 9/10 (90%) casos (p<0,05 vs. tamaño tumoral). En CPT-NE la expresión en >10 mm fue en 9/11 (81,8%) casos y en ≤10 mm fue en 10/11 (90,9%), (p<0,005 vs. tamaño tumoral) (tabla 1) (figs. 1 y 2, b y d).
Expresión de VEGF-A y KDR y su relación clínica
Los CPT-E >10 mm (30/40) que presentaron mayor positividad de VEGF-A (2+) y no de KDR, se asociaron a recurrencias tempranas, con extensión a tejidos blandos peritiroideos. Solamente dos (2/40) casos con datos clínicos de mal pronóstico (hombre de 65 años de edad) con extensión a tejidos blandos peritiroideos, cartílago traqueal y mediastino, el segundo caso (mujer de 45 años) de CPT-E >10 mm en un tiempo de seguimiento de 3 años desarrollo carcinoma anaplásico de tiroides con metástasis pulmonares y óseas, se asociaron a mal pronóstico y expresión de VEGF-A (2+), pero no de KDR. El resto (28/40-30%) presentó extensión a músculos peritiroideos y metástasis ganglionares sin datos de actividad tumoral y con buen pronóstico después del tratamiento. En los CPT-E ≤10mm con expresión de VEGF-A (2+) y KDR (1+) (2 casos-10%) se asociaron a multifocalidad tumoral con metástasis a ganglios linfáticos cervicales sin datos de actividad tumoral y buen pronóstico en el seguimiento. Ocho de 10 casos (20%) mostraron persistencia de la enfermedad de tipo ganglionar cervical, presentando metástasis ganglionares en su diagnostico inicial, siendo el tamaño de los nódulos recurrentes de ≥4 mm. Los pacientes se encontraron en un tiempo de seguimiento de 3 y 5 años libres de enfermedad a excepción de los 2 casos anteriormente mencionados de CPT-E > 10 mm. Los periodos libres de enfermedad fueron demostrables por examen clínico, radiografía de tórax y rastreo de yodo negativos.
Con respecto al tratamiento realizado para los CPT-E > a 10 mm se realizó tiroidectomía total bilateral y cirugía radical modificada de cuello para los que presentaron metástasis ganglionares. Se realizó laringectomía total en casos de invasión a cartílagos laríngeos y disección de tejidos blandos para los casos que presentaron extensión tumoral a dichas zonas, se realizó dosis ablativa con yodo radioactivo I131 post cirugía. En los casos de CPT-E ≤10 mm, con nódulos palpables y PAAF (punción con aspiración de aguja fina) positiva para CPT se realizó tiroidectomía total derecha e izquierda dependiendo de la localización del tumor, en los casos que presentaron multifocalidad se realizó tiroidectomía total y disección radical modificada de cuello para los casos que presentaron metástasis, se realizó dosis ablativa con I131 post cirugía. Para el caso de los CPT-NE ≤10 mm, se asociaron a tiroidectomías realizadas por enfermedades no relacionadas con CPT.
DISCUSIÓN
La sobreexpresión de VEGF en glándula tiroides está asociada a diversas neoplasias tanto benignas como malignas (21) y una mayor expresión de esta proteína y sus receptores principalmente KDR, están relacionados a un mayor riesgo de recurrencia y metástasis, participando de manera importante en el mantenimiento tumoral y en la transición de carcinomas bien diferenciados y poco diferenciados (22). Los resultados obtenidos en este estudio concuerdan con los anteriormente publicados, ya que la expresión de VEGF, se presentó tanto CPT-E como CPT-NE, observando una intensidad similar en el citoplasma de las células tumorales de CPT-E y CPT-NE, no encontrando significación estadística con respecto al tamaño tumoral (figs. 1 y 2), este resultado podría justificarse en el hecho de que VEGF comienza a sobre-expresarse a partir de que el tumor crece >2 mm (23), probablemente por esa característica no exista una relación entre el tamaño tumoral y la expresión de VEGF. Sin embargo se encontró un aumento en expresión en los tumores con invasión extracapsular, tanto en cantidad de las células tumorales como en la intensidad de la inmunoreacción en el citoplasma de las células tumorales. Con estos resultados se podría sugerir que la sobreexpresión de VEGF se encuentra relacionada a invasión extracapsular y progresión de la enfermedad, independientemente del género, edad y tamaño tumoral. Estos resultados concuerdan con lo publicado por Lennard CM. et al (24), que aunque no evaluaron invasión extracapsular, encontraron una mayor intensidad en la expresión de VEGF en aquellos CPT con características clínicas e histológicas de mal pronóstico, que en los de mejor pronóstico. Los resultados obtenidos con KDR fueron distintos a los obtenidos con VEGF-A, encontrando significación estadística con respecto al tamaño tumoral y expresándose con mayor frecuencia en aquellos CPT-NE ≤10 mm que en CPT-E >10 mm, este hallazgo es interesante, ya que en estudios realizados por Jebreel y cols. (21), mencionan que la expresión de KDR se presenta con la misma intensidad en neoplasias benignas y malignas, y que la regulación de VEGF puede ser autónoma, independientemente de la expresión de KDR. KDR es una proteína esencial para el desarrollo hematopoyético de células troncales del embrión. VEGF se une a KDR ejerciendo una función intrínseca tirosina-cinasa, una vez que VEGF se une a KDR, el receptor se fosforila, iniciando una cascada intracelular de señalizaciones y finalmente una proliferación de células endoteliales (25). En conclusión: Se observó una mayor intensidad en la expresión de VEGF en CPT-E >10 mm, con estos hallazgos probablemente, VEGF se exprese independientemente de la expresión de KDR.
Estos resultados concuerdan con lo publicado por Jeebrel et al, aunque en este caso no se hicieron estudios con tumores benignos de glándula tiroides. Sin embargo KDR se expresó de manera similar tanto en intensidad como en número de células neoplásicas de CPT-E y CPT-NE ≤10 mm y >10 mm, por lo cual, se sugiere que la expresión de KDR es constante. Mientras que la expresión de VEGF aumenta conforme al tamaño y progresión tumoral y probablemente participe en la invasión extracapsular.
BIBLIOGRAFÍA
Zou M, Al-Baradie RS, Al-Hindi H, Farid NR, Shi Y. S100A4 (Mts1) gene overexpression is associated with invasion and metastasis of papillary thyroid carcinoma. Br J Cancer 2005; 93: 1277-84.
Carcangiu ML, Zampi G, Pupi A, Castagnoli A, Rosai J. Papillary carcinoma of the thyroid. A clinicopathologic study of 241 cases treated at the University of Florence, Italy. Cancer 1985; 55: 805-28.
McWilliams RR, Giannini C, Hay ID, Atkinson JL, Stafford SL, Buckner JC. Management of brain metastases from thyroid carcinoma: a study of 16 pathologically confirmed cases over 25 years. Cancer 2003; 98: 356-62.
Michels JJ, Jacques M, Henry-Amar M, Bardet S. Prevalence and prognostic significance of tall cell variant of papillary thyroid carcinoma. Hum Pathol 2007; 38: 212-9.
Patel VA, Hill DJ, Eggo MC, Sheppard MC, Becks GP, Logan A. Changes in the inmunohistochemical localization of fibroblast growth factor-2, transforming growth factor-beta-1 and thrombospondin-1 are associated with early abgiogenic events in the hyperplastic rat thyroid. J Endocrin 1996; 148; 485-99.
Sato K, Yamazaki K, Shizume K, Kanaji Y, Obara T, Ohsumi K, et al. Stimulation of thyroid-stimulating hormone and Graves’ immunoglobulin G of vascular endothelial growth factor mRNA expression in human thyroid follicles in vitro and flt mRNA expression in the rat thyroid in vivo. J Clin Invest 1995; 96: 1295-302.
Shpitzer T, Feinmesser M, Stern Y, Feinmesser R. Angiogenesis in follicular tumors of the thyroid. J Surg Oncol 1996; 63: 95-8.
Ziche M, Magglione D, Ribatti D, Morbidelli L, Lago CT, Battisti M, et al. Placenta growth factor-1 is chemotactic, mitogenic, and angiogenic. Lab Invest 1997; 76: 517-31.
Katoh R, Miyagi E, Kawaoi A, Hemmi A, Komiyama A, Oyama T et al. Expression of vascular endothelial growth factor (VEGF) in human thyroid neoplasms. Hum Pathol 1999; 8: 891-7.
Yves A. Muller, Bing Li, Hans W. Christinger, James A. Wells, Brian C. Cunningham, and Abraham M. de Vos. Vascular endothelial growth factor: Crystal structure and functional mapping of the kinase domain receptor binding site. PNAS 1997; 94: 7192-7.
Veikkola T, Alitalo K: VEGF receptors and Angiogenesis. Semin Cancer Biology 1999: 211-20. Leung DW, Cachianes G, Kuang W-J, Goeddel DV, Ferrara N. Vascular endothelial growth factor is a secreted angiogenic mitogen. Science 1989; 246:1306-9.
Jakeman LB, Altar CA, Winer J, Bennett GL, Ferrara N. Binding site for vascular endothelial growth factor are localized on endothelial cells in adult rat tissues. J Clin Invest 1992; 89: 244-54.
Hanahan D, Folkmann J Patterns and emerging mechanisms of the angiogenetic switch during tumorigenesis. Cell 1996; 86: 353-64
Viglietto G, Maglione D, Rambaldi M, Cerutti J, Romano A, Trapasso F, Fedele M, Ippolito P, Chiappetta G, Botti G Upregulation of vascular endothelial growth factor (VEGF) and downregulation of placenta growth factor (PlGF) associated with malignancy in human thyroid tumors and cell lines. Oncogene 1995; 11: 1569-79.
Bunone G, Vigneri P, Mariani L, Buto´ S, Collini P, Pilotti S, Pierotti MA & Bongarzone I. Expression of angiogenesis stimulators and inhibitors in human thyroid tumours and correlation with clinical pathological features. American Journal of Pathology 1999; 155: 1967-76.
Klein M, Picard E, Vignaud JM, Marie B, Bresler L, Toussaint B, Weryha G, Duprez A & Leclere J. Vascular endothelial growth factor gene and protein: strong expression in thyroiditis and thyroid carcinoma. Endocrinology 1999; 161: 41-9.
Sosa JA, Udelsman R. Total thyroidectomy for differentiated thyroid cancer. J. Surg Oncol 2006; 94: 701-7
DeLellis R.A Lloyd R.V.,Heitz P.U., Eng C (Eds) World Health Organization Classification of Tumours. Pathology and Genetics of Tumours of Endocrine Organs. 2004; IARC Press:Lyon.
Pan CC, Chen PC, Chiang H. An easy method for manual construction of high-density tissue arrays. Appl Immunohistochem Mol Morphol 2004 ; 2: 370-2.
Götte M, Kerting C, Radke I, Kiesel L, Wülfing P. An expression signature of syndecan-1 (CD138). E- cadherin and c-met is associated with factors of angiogenesis and lymphangiogenesis in ductal breast carcinoma in situ. Breast Cancer Res 2007;9: R8.
Jebreel A, England J, Bedford K, Murphy J, Karsai L, Atkin S. Vascular endothelial growth factor (VEGF), VEGF receptors expression and microvascular density in benign and malignant thyroid diseases. Int J Exp Pathol 2007; 4: 271-7.
Soh EY, Duh QY, Sobhi SA, Young DM, Epstein HD, Wong MG, Garcia YK, Min YD, Grossman RF, Siperstein AE, Clark OH. Vascular endothelial growth factor expression is higher in differentiated thyroid cancer than in normal or benign thyroid. J Clin Endocrinol Metab 1997; 82: 3741-7
Lantuéjoul S, Constantin B, Drabkin H, Brambilla C, Roche J, Brambilla E. Expression of VEGF, semaphorin SEMA3F, and their common receptors neuropilins NP1 and NP2 in preinvasive bronchial lesions, lung tumours, and cell lines. J Pathol. 2003; 3: 336-47.
Lennard CM, Patel A, Wilson J, Reinhardt B, Tuman C, Fenton C, Blair E, Francis GL, Tuttle RM. Intensity of vascular endothelial growth factor expression is associated with increased risk of recurrence and decreased disease-free survival in papillary thyroid cancer. Surgery 2001; 5: 552-8.
Vajkoczy P, Thurnher A, Hirth KP, Schilling L, Schmiedek P, Ullrich Axel, et al. Measuring VEGF-Flk-1 Activity and Consequences of VEGF-Flk-1 Targeting In Vivo Using Intravital Microscopy: Clinical Applications. The Oncologist 2000; 5 (Suppl 1): 16-9.